
- •Часть 2. Основы коллоидной химии
- •1. Дисперсные системы. Смачивание. Капиллярные явления.
- •Степень раздробленности дисперсной фазы характеризуют дисперсностью где - поперечный размер частиц (диаметр при их сферической форме).
- •1.1. Типы дисперсных систем
- •1.2. Смачивание
- •1.3. Капиллярные явления. Фазовые равновесия при искривленной поверхности раздела фаз
- •1.3.1. Фазовые равновесия в двухфазных системах с искривленной поверхностью раздела фаз
- •1) Жидкость ↔ насыщенный пар
- •2) Твердый электролит ↔ ионы в насыщенном растворе.
- •1.3.2. Равновесия при контакте трех фаз с искривленными межфазными границами
- •А) Сферическая поверхность жидкость – газ в капилляре
- •Из хорошо смачиваемого материала
- •Б) Цилиндрическая поверхность жидкость – газ в капилляре
- •1.4. Примеры решения задач
- •Задачи для самостоятельной работы
- •2. Устойчивость, получение, свойства, стабилизация и коагуляция коллоидных систем
- •2.1. Термодинамика образования. Лиофильные и лиофобные коллоидные системы
- •2.2. Особые свойства коллоидных систем
- •Особые свойства коллоидных систем можно подразделить на две основные группы :
- •2.3. Методы получения лиофобных коллоидных систем
- •2.4. Стабилизация лиофобных коллоидных систем (золей, эмульсий)
- •2.4.1. Стабилизация электролитами
- •2.4.2. Стабилизация в присутствии пав и полимеров
- •2.5. Коагуляция коллоидных систем
- •2.6. Примеры решения задач
- •Задачи для самостоятельной работы
- •Лабораторная работа № 1. Получение, коагуляция и стабилизация лиофобных коллоидных систем
- •Опыт 3. Получение и коагуляция золя гидроксида трехвалентного железа
- •Опыт 4. Определение порога коагуляции
- •Литература по курсу коллоидной химии*
2.4.2. Стабилизация в присутствии пав и полимеров
Эффективными стабилизаторами лиофобных коллоидных систем, к которым можно отнести также эмульсии и пены, являются поверхностно-активные вещества (ПАВ, см. часть 1, раздел 1.3) и полимеры, растворимые в дисперсионной среде. Без стабилизаторов слияние капель в эмульсиях или газовых пузырьков в пенах при столкновении происходит легче, чем соединение твердых частиц в агрегаты. Обеспечить их устойчивость способны только ПАВ (называемые в этом случае эмульгаторами или пенообразователями) или макромолекулы.
Как Вы уже знаете, наиболее распространены ПАВ трех типов: неионогенные, анионные и катионные. Их молекулы состоят из неполярной (обычно – углеводородной части) и полярных или заряженных функциональных групп. Полярными группами неионогенных ПАВ могут быть спиртовые (-ОН), а также карбоксильные (-СООН) в кислых средах или аминогруппы (-NН2, -NRН) в щелочных средах.
Анионные ПАВ – соли сильных оснований и слабых или сильных кислот, диссоциирующие в водной среде с образованием анионов дифильного строения (например, натриевые соли жирных органических кислот: стеарат натрия C17Н35СОО−Na+, додецилсульфат натрия
C12Н25 SO3−Na+ ).
Катионные ПАВ – соли сильных кислот и слабых или сильных оснований, диссоциирующие в водной среде с образованием катионов дифильного строения (например, соли органических аминов общей формулы СnН2n+1N+Н3 Сl− , СnН2n+1N+(CН3)3 Сl− ).
Молекулы ПАВ хорошо адсорбируются на поверхности твердых частиц из неполярных веществ, капель неполярных жидкостей или пузырьков газа. При этом они определенным образом ориентируются, так как неполярные части молекул сильнее притягиваются неполярными молекулами дисперсной фазы, а полярные или заряженные гидрофильные группы - полярными молекулами воды (рис. 2.7). Это является причиной снижения σт/ж, σж/ж или σж/г на границе раздела фаз и возрастанием устойчивости дисперсной фазы к агрегации.
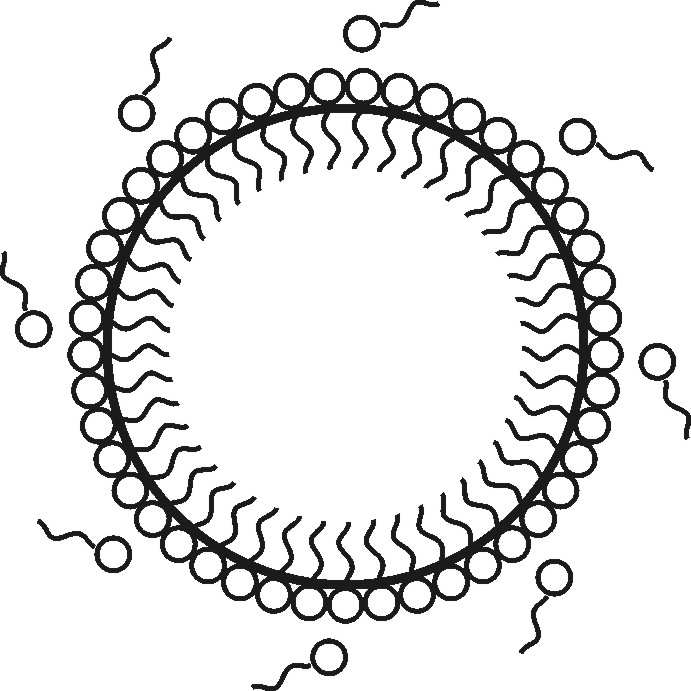
Рис. 2.7. Схема стабилизации капель эмульсии типа масло / вода
в водном растворе ПАВ
В случае адсорбции катионных или анионных ПАВ поверхность частиц золя, капель эмульсии или пузырьков пен приобретает соответственно положительный или отрицательный заряд, что также способствует стабилизации коллоидной системы.
При достаточной концентрации ПАВ (эмульгатора) на поверхности капли образуется как бы частокол из ориентированных молекул, обладающий известной механической прочностью (рис. 2.7).
Природа эмульгатора определяет устойчивость и тип эмульсии. Гидрофильные эмульгаторы, лучше растворимые в воде, чем в углеводородах, способствуют образованию эмульсий М/В (масла в воде), а гидрофобные (или олеофильные) эмульгаторы, лучше растворимые в углеводородах, - эмульсий типа В/M (воды в масле).
При введении в эмульсию избытка поверхностно-активного вещества, являющегося стабилизатором эмульсий противоположного типа, первоначальная эмульсия может обращаться: (М/В) → (В/М), т.е. дисперсная фаза становится в ней дисперсионной средой, а дисперсионная среда - дисперсной фазой.
Для стабилизации лиофобных коллоидных систем широко используются полимеры, растворимые в дисперсионной среде. Размер макромолекул в разбавленных растворах такой [1], что одной макромолекулы может быть достаточно для стабилизации не только одной, но и нескольких частиц размером 2 – 20 нм.
