
- •Розділ 12. Біохімія крові
- •12.1. Функції крові
- •12.2. Гемоглобін
- •12.2.2. Похідні гемоглобіну. Молекула гемоглобіну, взаємодіючи з різними лігандами, утворює похідні (рис. 12.2).
- •12.3. Буферні системи крові
- •12.4. Білки плазми крові
- •12.5. Ферменти плазми крові
- •12.6. Небілкові органічні сполуки плазми крові
- •12.7. Згортальна та фібринолітична системи крові
- •12.8. Біохімічні основи імунної системи
- •12.9. Біохімічні механізми імунодефіцитних станів
12.2.2. Похідні гемоглобіну. Молекула гемоглобіну, взаємодіючи з різними лігандами, утворює похідні (рис. 12.2).
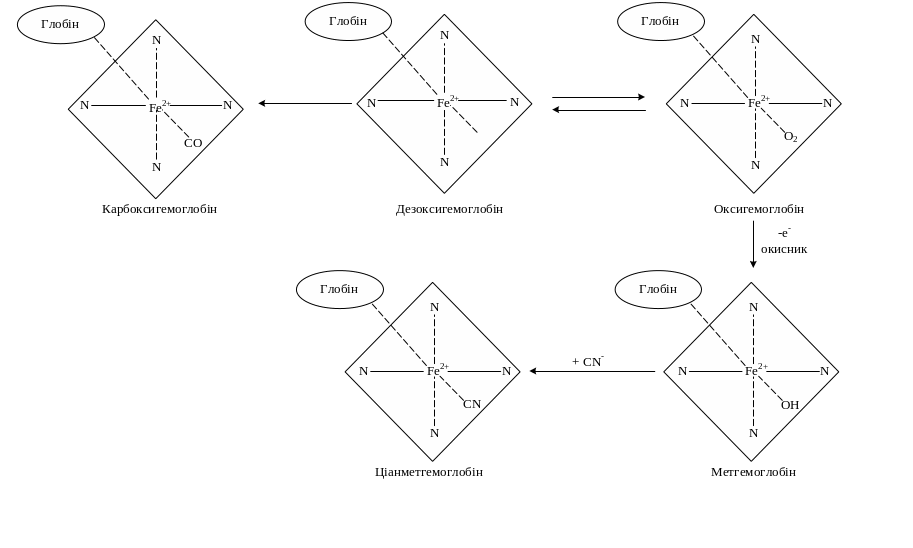
Рис.12.2. Схема утворення похідних гемоглобіну
Оксигемоглобін (HbО2) – сполука гемоглобіну з киснем. У ньому кисень, крім заліза, зв’язується слабким зв’язком з залишком другого гістидину молекули глобіну (рис. 12.1). Такий зв'язок легко руйнується сумішшю ацетону та хлоридної кислоти з утворенням денатурованого глобіну, який випадає в осад, та гему, в якому залізо окиснюється до тривалентного.
Метгемоглобін (МеtHb) містить іон Fе3+. У молекулі метгемоглобіну кисень замінений групою ОН-, тому метгемоглобін не може слугувати носієм кисню. У крові дорослої людини завжди є невелика кількість метгемоглобіну (0,3 - 3 г/л), однак його концентрація за умов норми не повинна перевищувати 20 г/л. За такої концентрації метгемоглобін відіграє захисну роль. Зокрема, (знешкоджує) ціаніди, перетворюючи їх на порівняно нешкідливий ціанметгемоглобін. Весь метгемоглобін крові людини може зв'язати до 1/3 смертельної дози ціанистих отрут (від 10 до 20 мг). Тому для лікування отруєнь ціанідами застосовують метгемоглобіноутворювачі (нітрит натрію).
Крім того, метгемоглобін знешкоджує гідрогенсульфід, масляну кислоту та інші речовини; проявляє більш виражену пероксидазну дію порівняно з гемоглобіном. Значення цього процесу полягає не тільки в руйнуванні токсичних для організму перекисів, але і в тому, що метгемоглобін при цьому відновлюється в гемоглобін.
Властивість відновлювати метгемоглобін має також аскорбінова кислота і глутатіон. В еритроцитах існує спеціальна ферментна система: НАДФН2-залежна метгемоглобінредуктаза (діафораза), яка каталізує відновлення метгемоглобіну на гемоглобін:
![]()
Патологічні метгемоглобінемії можуть бути природженими (первинними) і набутими (вторинними). Перші зумовлені, головним чином, атиповою будовою гемоглобіну (HbМ) або дефектами ферментних систем, що беруть участь у відновленні метгемоглобіну в гемоглобін. Набуті метгемоглобінемії виникають при отруєнні різними хімічними сполуками. Метгемоглобін має темніше забарвлення порівняно з гемоглобіном, тому при надмірній його концентрації в крові з'являється ціанотичне забарвлення шкіри.
Карбоксигемоглобін (HbCO) утворюється при отруєнні монооксидом вуглецю (чадним газом). Оскільки спорідненість монооксиду вуглецю до гемоглобіну значно вища, ніж у кисню (приблизно в 300 разів), то навіть при невеликих концентраціях його в крові він швидко сполучається з гемоглобіном. Так, при концентрації СО в повітрі 0,07 %, а О2 - 21 % вже 50 % гемоглобіну перетворюється на карбоксигемоглобін, а при наявності в повітрі 1 % СО фактично весь гемоглобін перетворюється на карбоксигемоглобін. Токсична дія моноксиду вуглецю виявляється при концентраціях його 0,11 мг/л. Моноксид вуглецю може сполучатися як з гемоглобіном, так і з оксигемоглобіном, в останньому випадку кисень витісняється.
Карбгемоглобін (HbCO2) – сполука гемоглобіну з СО2. Проте СО2 приєднується не до гему, а до NH2-груп глобіну: НbNH2 + СО2 → НbNНСОО- + H+. Дезоксигемоглобін зв'язує СО2 значно швидше, ніж оксигемоглобін. Шляхом утворення карбгемоглобіну виводиться 10 - 15 % СО2 з організму.
Сульфогемоглобін (HbSO) утворюється під час взаємодії оксигемоглобіну з сіркою або гідрогенсульфідом. Поява сульфогемоглобіну є наслідком тривалого зловживання медикаментами (наприклад, фенацетину) і називається сульфогемоглобінемією.
12.2.3. Механізм зв’язування гемоглобіном кисню. Як вже зазначалося, основна функція гемоглобіну полягає в зв’язуванні кисню та перенесенні його від легенів до тканин. Еритроцит містить біля 400 млн молекул гемоглобіну, кожна з яких може зв’язати 4 молекули О2, тобто по одній на субодиницю. Процес приєднання гемоглобіну до кисню називають оксигенацією.
Перша молекула О2 приєднується до α1-субодиниці гему (рис. 12.3).
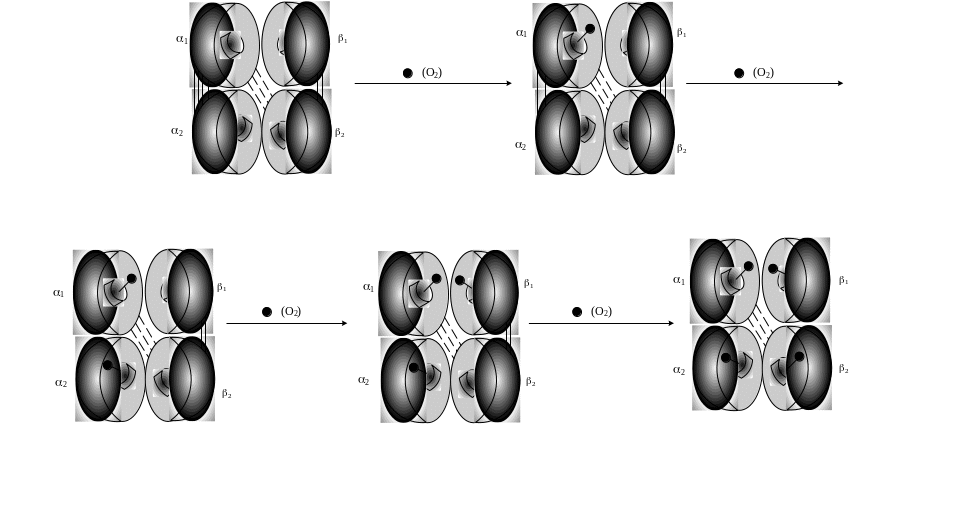
Рис. 12.3. Схема зв’язування кисню із гемоглобіном: послідовне приєднання до гему кисню і розрив іонних зв’язків між однаковими субодиницями
При цьому два іонні зв'язки α1 – α2 розриваються, що дає можливість іншим гемам прийняти вигідне положення для приєднання кисню. Третя молекула О2 приєднується до β1-субодиниці. Один із іонних зв'язків β1-β2 розривається, тим самим полегшує доступ кисню до останнього атома заліза β2-субодиниці гему. При цьому розривається останній іонний зв’язок β1 - β2. Найважче приєднується перша молекула кисню, а кожна наступна все легше (наприклад, четверта (остання) малекула кисню звя'зується у 300 разів швидше, ніж перша).
Зміна конформації всіх протомерів олігомерного білка при приєднанні ліганда лише до одного з них називається кооперативними змінами конформації протомерів і має важливе фізіологічне значення. Оксигемоглобін звільняється від кисню всього на 80 % при чотирикратному перепаді парціального тиску кисню з 10,6 до 2,6 кПа. Якби геми працювали автономно, то таке звільнення гемоглобіну від кисню вимагало б 90-кратного перепаду тиску. Оскільки це не можливо, то основна частина кисню не могла б відірватися від гемоглобіну і використовуватися тканинами. Людина задихнулася б навіть в атмосфері чистого кисню.
М
Рис.
12.4. Залежність ступеня оксигенації (%
від максимального) від парціального
тиску О2
для гемоглобіну (ІІ) та для міоглобіну(І)
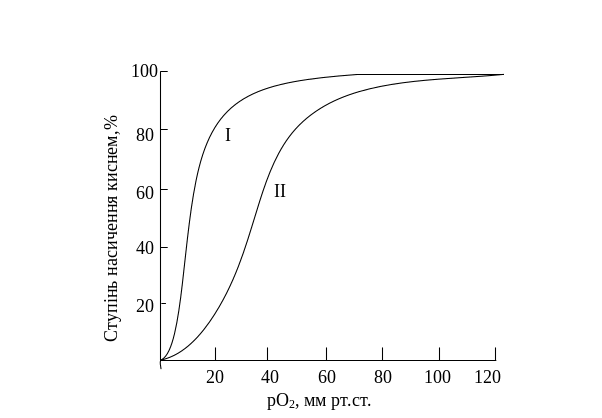
Крива зв'язування гемоглобіном кисню та, відповідно, дисоціації оксигемоглобіну, має S-подібну форму, що свідчить про кооперативний характер процесу, оскільки приєднання молекули О2 до першої субодиниці гемоглобіну внаслідок конформаційних змін, що відбуваються, підвищує здатність гемопротеїну до взаємодії з наступними трьома молекулами кисню (рис. 12.4). У капілярах м’язів у стані спокою тиск О2 становить ~ 40 мм рт.ст. і більша частина кисню повертається назад у легені в складі оксигемоглобіну. При фізичному навантаженні тиск О2 у капілярах м’язів падає до 10 – 20 мм рт.ст., тому саме в цій ділянці ( від 10 до 40 мм рт.ст.) розташовується «опукла частина» S-подібної кривої, де найбільшою мірою виражена кооперативна робота протомерів.
Завдяки своїй унікальній структурі міоглобін здатний приєднувати вивільнений гемоглобіном О2, накопичувати в клітинах і віддавати при потребі. Він має високу спорідненість до кисню, тому навіть при парціальному тиску 1 – 2 мм рт.ст. міоглобін залишається зв’язаним з киснем на 50 %.
На відміну від міоглобіну, гемоглобін має значну нижчу спорідненість з киснем, ступінь його оксигенації (утворення НbО2) залежить від низки чинників: парціального тиску кисню; значення рН; концентрації діоксиду вуглецю; концентрації 2,3-дифосфогліцерату.
Зазначимо також, що вивільненню кисню з оксигемоглобіну в периферичних тканинах значною мірою сприяє градієнт його парціального тиску в напрямку альвеоли (100 мм. рт. ст.) → артеріальна кров (90 мм.рт.ст.) → венозна кров (40 мм.рт.ст.) → мітохондрії клітин (0-5 мм.рт.ст.). Використання кисню в цитохромоксидазній реакції створює в мітохондріях "кисневий вакуум", завдяки якому в клітини дифундує кисень з еритроцитів.
12.2.4. Механізми транспорту діоксиду вуглецю від тканин до легенів. Крім транспорту молекул О2 від легенів до капілярів периферичних тканин, гемоглобін відіграє також суттєву роль у перенесенні від тканин до легенів СО2, який утворюється в клітинах у реакціях декарбоксилювання. У організмі людини, що не виконує фізичної роботи (стан спокою), від тканин до легенів кожну хвилину переноситься приблизно 180 мл вуглекислого газу. В організмі існує декілька механізмів перенесення СО2 від тканин до легенів. Частина його переноситься у розчиненому вигляді. Деяка кількість СО2 може переноситися у вигляді карбамінової форми. Виявилось, що СО2 може приєднуватися до гемоглобіну за допомогою карбамінового зв'язку, утворюючи карбгемоглобін або карбаміногемоглобін.
R – NH2 + CO2 → R – NHCOO- + H+
Гемоглобін Карбгемоглобін
Карбгемоглобін – дуже нестійка сполука, яка надзвичайно швидко дисоціює в легеневих капілярах з відщепленням СО2.
Кількість карбамінової форми невелика: у артеріальній крові становить 3 об %, у венозній - 3,8 об %. У вигляді карбамінової форми з тканини до легенів переноситься від 3 до 10 % всього вуглекислого газу, що поступає з тканин в кров. Основна кількість СО2 транспортується з кров'ю до легенів у формі бікарбонату (понад 80 % від всієї кількості вуглекислого газу), при цьому найважливішу роль відіграє гемоглобін еритроцитів.
Діоксид вуглецю, що надходить у кров, транспортується в еритроцити. Там під впливом карбоангідрази відбувається утворення карбонатної кислоти (Н2СО3), яка може дисоціювати на Н+ та НСО3-. надлишок водневих іонів зв'язується з гемоглобіном, що віддав кисень, а аніони НСО3 виходять з еритроцита в плазму:
КНb + Н2СО3 → К+ + НСО3- + ННb
В обмін на ці іони в еритроцит поступають аніони хлору, тоді як натрій - інший складовий елемент хлориду натрію, що міститься в крові, залишається в плазмі. У результаті в плазмі крові підвищується вміст бікарбонату натрію. Цей процес сприяє відновленню лужного резерву крові, тобто бікарбонатна буферна система знаходиться в досить тісних функціональних зв'язках з буферною системою еритроцитів.
Приєднання трьох пар протонів до гемоглобіну зменшує його спорідненість до кисню та посилює транспорт О2 у тканини, які його потребують. Збільшення вивільнення О2 гемоглобіном у залежності від концентрації Н+ називають ефектом Бора (Х.Бор – фізіолог, який відкрив це явище). У капілярах легенів високий парціальний тиск О2 спричинює оксигенацію гемоглобіну та видалення 6 протонів. Отже збільшення концентрації протонів у середовищі знижує спорідненість О2 до гемоглобіну і посилює його транспорт у тканини. Приєднання СО2 до гемоглобіну теж знижує його спорідненість до О2.
12.2.5. Деякі форми молекулярної патології гемоглобінів. Аномалії гемоглобінів (гемоглобінози) поділяють на гемоглобінопатії, в основі яких лежать спадкові зміни структури гемоглобіну і таласемії, що зумовлені порушенням синтезу одного з ланцюгів молекули гемоглобіну.
Гемоглобінопатії - це спадкові аномалії, пов’язані з порушенням глобіну за нормальної структури гему. Аномальні гемоглобіни різняться за своїми фізико-хімічними властивостями (електрофоретичною рухливістю, стійкістю до дії основ, розчинністю, ізоелектричною точкою).
Появу аномальних гемоглобінів пояснюють мутаційною теорією, а передавання нащадкам аномального гена здійснюється за законами спадковості. Встановлено понад 200 аномальних гемоглобінів: В (S), С, В, Е, К, L, М, N, О, Р, Q тощо, а також можливі їх комбінації (SС, SD тощо)
Гемоглобінопатії у гетерозиготній і гомозиготній формі поширені в Екваторіальній Африці, країнах Середземномор’я, на Аравійському півострові, у Південній Індії, на острові Шрі-Ланка, у Південному Китаї, південних районах США. Причину появи аномальних гемоглобінів пояснюють за допомогою малярійної гіпотези, згідно з якою мутації в гені, що контролює утворення гемоглобіну, виникли в країнах зі значним поширенням тропічної малярії. Було встановлено, що наявність аномального гена в гетерозиготній формі підвищує стійкість людей до захворювання, створює імунітет до малярії, оскільки зміни молекули гемоглобіну запобігають використанню його малярійним плазмодієм.
При гемоглобінопатіях молекулярний дефект полягає у змінах первинної структури поліпептидних ланцюгів, які формують а- або β-субодиниці молекул гемоглобіну (амінокислотні заміни, делеції або вставки) з утворенням аномальних форм гемоглобінів. Такі аномальні гемоглобіни позначають великими літерами латинського алфавіту, або за місцем, де був вперше виявлений даний дефект.
НbS — мутантний гемоглобін, відкритий в 1949 році Полінгом і Утано, відрізняється від нормального гемоглобіну А тим, що в шостому положенні двох β-ланцюгів місце глутамінової кислоти займає валін. Внаслідок таких відносно невеликих змін редукована форма гемоглобіну S слабкіше і повільніше зазнає оксигенації і гірше (майже в 25 разів) розчиняється, ніж НbА.
У капілярах під час віддавання кисню гемоглобін S випадає в осад у формі веретеноподібних кристалоїдів (тактоїдів). Це породжує осмотичну нестійкість еритроцитів, зміну їх форми з двоввігнутої в серпоподібну. Серпоподібні еритроцити легко гемолізуються вже в судинному руслі. Клінічні прояви цієї хвороби змінються від ледь помітних (гетерозиготна форма серпоподібноклітинної анемії) до тих, що спричинюють летальний кінець в ранньому віці (гомозиготні форми).
НbС — аномальний гемоглобін, у молекулі якого існує заміна залишку глутамінової кислоти в 6-му положенні β-ланцюга на лізин. Еритроцити, що містять такий аномальний гемоглобін, здатні до гемолізу, що також супроводжується розвитком анемії. Наявність гена С в гомозиготному стані призводить до розвитку вираженої спленомегалії, помірної мікроцитарної анемії. За наявності комбінації гемоглобінів С і S анемія вияляється в тяжчій формі.
НbМ — існує група гемоглобінів М, в поліпептидних ланцюгах яких залишок гістидину, який бере участь у зв'язуванні гему з залізом, заміщений на іншу амінокислоту.
У гемоглобінах, які містять такий молекулярний дефект, залізо (Fe3+) не може відновлюватися метгемоглобінредуктазою до Fe2+, у зв'язку з цим в еритроцитах накопичується метгемоглобін, який не здатний до нормального транспорту кисню. Така метгемоглобінемія найбільш виражена в гомозиготному стані, внаслідок чого хворі гинуть в умовах тяжкої гіпоксії.
НbА1C — глікозильований гемоглобін, який з'являється в еритроцитах за умов некомпенсованого цукрового діабету. Цей гемоглобін — стабільний комплекс глюкози з мінорною А1C фракцією гемоглобіну, який утворюється між аміногрупою валіну - N-кінцевою амінокислотою β-глобіну і карбоксильною групою вуглеводу:
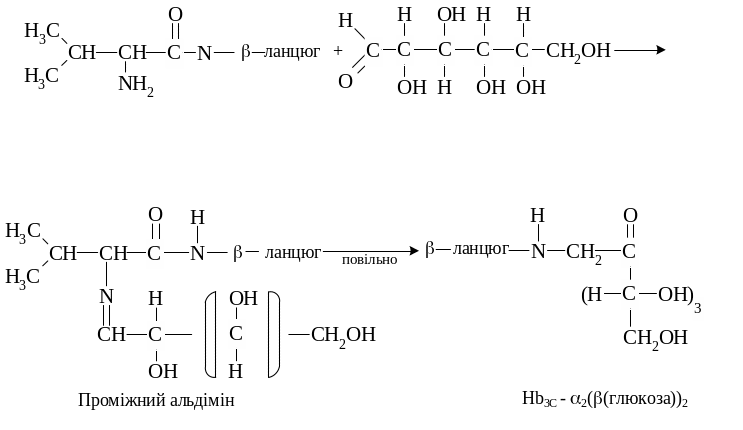
У нормі концентрація глікозильованого гемоглобіну становить 5 - 7 % від загальної кількості, тобто 8 - 10 г/л. Гіперглікемія впродовж 10 - 12 годин сприяє збільшенню кількості глікозильованого гемоглобіну. Глікозилювання гемоглобіну підвищує його спорідненність до кисню в тканинах, крім цього, утруднює приєднання 2,3 -дифосфогліцерату. У клініці показник рівня глікозильованого гемоглобіну використовують для діагностики цукрового діабету та інших порушень вуглеводного обміну.
HbD спричинює мікроцитоз, слабкий анізо - та пойкілоцитоз і зміну еритроцитів.
HbЕ зумовлює мікроцитоз, який компенсується розвитком еритроцитозу (до7-8∙1012/л).
Інші гемоглобінози поширені значно менше, а їх клінічні прояви слабко виражені. У разі тяжких форм гемоглобінопатій морфологічні зміни в печінці, що виникають унаслідок гемохроматозу, можуть істотно впливати на кровоплин і супроводжуватися порушенням механізмів регуляції гемостазу.
Таласемія - спадкове захворювання, спричинене порушенням синтезу одного з ланцюгів гемоглобіну.
Якщо пригнічено синтез α-ланцюгів, то спостерігається α-таласемія, при генетичному дефекті синтезу β-ланцюгів - β-таласемія. При всіх видах таласемій порушується продукування еритроцитів кістковим мозком і насичення гемоглобіну киснем.
В основі α-таласемії лежать порушення синтезу α -ланцюга, що призводять до порушення утворення всіх фізіологічних видів гемоглобіну. Ланцюги β і γ, які з’являються в надлишку, не можуть взаємодіяти з α -ланцюгами, внаслідок виникає два види гемоглобінів — Нbβ4 (НbН) і Нbγ4 (Нb Бартса). Ці дві форми нестабільні й мають низьку спорідненість до кисню. У гомозигот гемоглобін представлений здебільшого Нb Бартса (загибель настає вже в період внутрішньоутробного розвитку). У гетерозигот наявна суміш Нb Бартса — НbН (прояви захворювання зводяться до незначного гемолізу без істотних наслідків для загального стану).
β-Таласемія зумовлюється порушенням синтезу β-ланцюгів, що призводить до відносного надлишку α-ланцюгів і посиленого утворення НbF (α2γ2) і HbA2 (α2δ2).
σ-Таласемія пов’язана з гальмуванням синтезу β- і σ-ланцюгів і підвищеним утворенням НbF.
Часто зустрічаються комбіновані форми гемоглобінозів, які можуть поєднуватися з дефіцитом глюкозо-6-фосфатдегідрогенази в еритроцитах, що ще більше посилює розвиток захворювання (анемії).
