
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •2. Основные стехиометрические законы.
- •3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •4. Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали.
- •5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов.
- •6. Связь периодического закона со строением электронных оболочек атомов. Правило Клечковского. Энергетические ячейки. Правило Гунда.
- •7. Периодический закон д.И.Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер.
- •8. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •9. Образование химической связи. Энергия связи и длина связи.
- •10. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
- •11. Направленность ковалентной связи. Сигма и п-связи. Гибридизация атомных орбиталей.
- •12. Ионная (электронная) связь.
- •13. Полярная связь. Полярность молекул и их дипольный момент.
- •14. Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •15. Межмолекулярное взаимодействие. Водородная связь.
- •16. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •17. Первое начало термодинамики. Закон Гесса как следствие 1-го начала термодинамики.
- •18. Стандартная энтальпия образования. Следствие из закона Гесса. Термохимические расчеты.
- •19. Зависимость теплового эффекта реакции от температуры.
- •20. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии.
- •21. Объединенная формула 1 и 2 начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •22. Условия самопроизвольного протекания химических реакций.
- •23. Константа химического равновесия. Расчет Кр и Кс. Изотерма химической реакции.
- •24. Принцип подвижного равновесия (принцип Ле-Шателье).
- •25. Скорость химической реакции. Закон действующих масс. Константа скорости.
- •26. Молекулярность и порядок реакции.
- •28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
- •29. Энергия активации химической реакции. Аналитический и графический метод расчета.
- •30. Скорость гетерогенной химической реакции.
- •31. Катализ. Сущность гомогенного и гетерогенного катализа.
- •32. Растворы (разбавленные, концентрированные, насыщенные, перенасыщенные).
- •33. Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях.
- •34. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •35. Законы Рауля.
- •36. Электролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •37. Константы диссоциации. Закон разведения.
- •38. Сильные электролиты. Понятие активности и коэффициента активности.
- •39. Электролитическая диссоциация воды. Ионные произведения воды. Водородный показатель. Понятие об индикаторах.
- •40. Гидролиз солей.
- •41. Окислительно-восстановительные реакции. Ионно-электронный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •42. Возникновение скачка потенциала на границе раздела «металл-раствор». Равновесный электродный потенциал.
- •43. Медно-цинковый гальванический элемент. Процессы на электродах. Эдс.
- •44. Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •45. Стандартный водородный электрод. Формула Нернста. Стандартный потенциал. Ряд напряжения.
- •46. Типы электродов и цепей. Окислительно-восстановительные электроды и цепи.
- •47. Электролиз. Последовательность разряда ионов на катоде и аноде.
- •48. Законы Фарадея. Выход по току.
- •49. Химическая и концентрационная поляризация при электролизе. Перенапряжение.
- •50. Классификация химических источников тока.
- •51. Коррозия металлов. Химическая и электрохимическая коррозия.
- •52. Основные методы борьбы с коррозией.
- •53. Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •54. Сущность физико-химического анализа. Правило фаз. Диаграмма состояния воды.
- •55. Основные принципы построения диаграммы плавкости бинарных систем. Термографический анализ.
- •60. Произведение растворимости. Условия выпадения осадка.
25. Скорость химической реакции. Закон действующих масс. Константа скорости.
Количественно скорость реакции принято характеризовать изменением концентрации реагирующих веществ в единицу времени. Различают истинную и среднюю скорость.

Гомогенные реакции проходят сразу по всему объему, гетерогенные – на границе раздела фаз.
Закон действующих масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
 ,
где k-константа скорости реакции.
Выполняется для идеальных газов или
бесконечно разбавленных растворов.
,
где k-константа скорости реакции.
Выполняется для идеальных газов или
бесконечно разбавленных растворов.
Константа скорости численно равна скорости, когда концентрации равны единице.
26. Молекулярность и порядок реакции.
С точки зрения числа частиц, участвующих в реакции, последние классифицируют по признаку молекулярности или порядка.
Молекулярность реакции определяется по числу молекул, одновременное соударение которых приводит к химическому взаимодействию. Различают одно-, двух- и трехмолекулярные реакции.
Одномолекулярная реакция:
 ,
,

Двухмолекулярная реакция:


Трехмолекулярная реакция:


Порядок реакции равен сумме показателей степеней у концентраций в уравнении, выражающем зависимость скорости реакций от концентраций реагирующих веществ.
Например реакция
 формально
является трехмолекулярной, но идет в
две стадии
формально
является трехмолекулярной, но идет в
две стадии
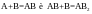 ,
одна из которых медленная и по сути
определяет скорость реакции.
,
одна из которых медленная и по сути
определяет скорость реакции.
Реакция
 протекает в 2 стадии и является реакцией
2 порядка.
протекает в 2 стадии и является реакцией
2 порядка.
28. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.
Согласно эмпирическому
правилу Вант-Гоффа, повышение температуры
на каждые
 приводит
к увеличению скорости реакции в 2-4 раза.
приводит
к увеличению скорости реакции в 2-4 раза.
 -
температурный коэффициент скорости
реакции
-
температурный коэффициент скорости
реакции

Увеличение скорости нельзя объяснить увеличением скорости молекул, т.к. при увеличении температуры на 100 градусов скорость молекул увеличивается на 20%, а скорость реакции десятки тысяч раз.
Уравнение Аррениуса:
 или
или

Допущения Аррениуса:

Для реакции, протекающей
при

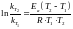
Для реакций, протекающих
при одной Т, но с разными Еа и kT

29. Энергия активации химической реакции. Аналитический и графический метод расчета.
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации.
Графический метод: по
опытным данным строят график зависимости
 от
от
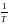 ,
если всё верно, получается прямая
(типа\), тангенс угла наклона
,
если всё верно, получается прямая
(типа\), тангенс угла наклона

Аналитический метод: положим, что в небольшом интервале Т энергия активации постоянна.


30. Скорость гетерогенной химической реакции.
Скорость гетерогенных процессов зависит от состояния и размера границы раздела фаз. Гетерогенные процессы многостадийны, помимо самой реакции идет ещё подвод-отвод веществ, скорость определяется наиболее медленной стадией.
Если определяющей стадией является сама реакция, то скорость описывается химической кинетикой, если (как чаще и бывает), определяющей является стадия подвода-отвода, то процесс описывается законами диффузии.
Температура влияет сильнее на кинетическую область, увеличение температуры на 10С увеличивает скорость в диффузионной области на 20%. При низких Т реакции идут в кинетической области, при высоких – в диффузионной.
1 закон диффузии:
 ,
,
 -градиент
концентрации.
-градиент
концентрации.
Скорость диффузии
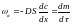 ,
,
 ,
где Е- энергия активации диффузионного
процесса (5-20 кДж/моль). Энергия активации
кинетической области 50-200 кДж/моль
,
где Е- энергия активации диффузионного
процесса (5-20 кДж/моль). Энергия активации
кинетической области 50-200 кДж/моль
2 закон диффузии выражает зависимость изменения концентрации в объеме одной из соприкасающихся фаз от времени

Если диффузия стационарна
(меняется только с координатой), то

При
 ,
где δ – толщина диффузионного слоя (эфф
путь диффузии)
,
где δ – толщина диффузионного слоя (эфф
путь диффузии)
Уравнение стационарной
диффузии
 ,
где
,
где
 -
коэфф массопередачи.
-
коэфф массопередачи.
