
- •1.1.Физико-химические основы процесса электролиза раствора хлорида натрия.
- •1.2.Производство каустической соды, хлора и водорода диафрагменным методом.
- •1.3.Электролиз растворов хлоридов в ваннах с жидким катодом.
- •1.4.Производство щелочи методом мембранного электролиза
- •2.1. Цели нанесения хромовых покрытий. Электролитическое хромирование применяется для внешней отделки изделий, повышения износостойкости, для защиты от коррозии и в ряде других случаев.
- •2.2.Цели нанесения цинковых покрытий.
- •2.3.Применение медно-никелевых покрытий.
- •3.Состав электролитов.
- •3.1.Электролиты меднения
- •3.2.Электролиты никелирования.
- •3.3.Электролиты цинкования
- •3.4.Электролиты хромирования
- •4.Задачи.
Содержание.
1.Электролиз раствора хлорида натрия.
1.1.Физико-химические основы процесса электролиза хлорида натрия.
1.2. Производство каустической соды, хлора и водорода диафрагменным методом.
1.3.Электролиз с жидким катодом.
1.4.Производство щелочи мембранным способом.
2.Цели нанесения металлических покрытий.
2.1. Цели нанесения хромовых покрытий.
2.2.Цели нанесения цинковых покрытий.
2.3.Применение медно-никелевых покрытий.
3.Состав электролитов.
3.1.Электролиты меднения.
3.2.Электролиты никелирования.
3.3.Электролиты цинкования.
3.4.Электролиты хромирования.
4.Задачи.
1.1.Физико-химические основы процесса электролиза раствора хлорида натрия.
Сырьем для производства Cl2, NaOH, H2 служат растворы поваренной соли. Под действием электрического тока на электродах может протекать ряд реакций.
Реакции на катоде:
Na+ + e- = Na, (E0=-2.736 B) (1)
H2O + 2 e- = H2↑+2OH-, (E0=-0.828 B) (2)
Реакции на аноде:
2Cl- - 2 e- = Cl2, (E0= 1.359 B) (3)
2H2O - 4 e- = O2 + 4H+, (E0= 1.226 B) (4)
В электролите продукты электролиза вступают во вторичные химические реакции. Хлор в растворе взаимодействует с водой:
Cl2 + H2O ↔ HClO + HCl (5)
Хлорноватистая кислота (HClO) является слабодиссоциированным соединением. Равновесие в реакции хлора с водой устанавливается быстро, практически не изменяет ионный состав электролита и не влияет на процессы электролиза. При попадании в раствор гидроксил-ионов происходит нейтрализация образуется хорошо диссоциируемое соединение – гипохлорит натрия NaCIO:
HClO + NaOH ↔ Na+ +ClO- + H2O (6)
В этом случае равновесие реакции (5) сдвигается вправо и способствует растворению новых порций хлора. Таким образом, электролиз может протекать не с выделением хлора, а с образованием гипохлорита.
Ионы ClO- разряжаются на аноде раньше, чем Cl-. Поэтому на аноде происходит разряд ионов ClO- с образованием хлорат-ионов ClO3-. Возможно и химическое образование хлоратов:
2 HClO + NaClO = NaClO3- + 2H+ + 2Cl- (7)
или при растворении хлора в горячей щелочи
З Cl2 + 6NaOH = NaClO3 + 5NaCl + ЗH2O (8)
Таким образом, электролиз растворов NaCl - сложный процесс. На его селективность влияет ряд технологических параметров: величина электродного потенциала E, плотность тока I, состав электролита, температура.
1.2.Производство каустической соды, хлора и водорода диафрагменным методом.
Производство каустической соды диафрагменным методом включает в себя следующие стадии: приготовление и очистку рассола;
электролиз;
охлаждение и осушку хлора;
охлаждение и перекачку водорода;
выпарку электролитической щелочи.
Сырьем для производства целевых продуктов служит поваренная соль В значительно меньших масштабах применяют хлорид калия. Около половины добычи составляет озерная соль (озеро Баскунчак), примерно 40% - каменная соль (залежи Артемовское. Сибирское, Новомосковское, Волгоградское). Из поваренной соли методом растворения получают рассолы. Возможно применение также подземных рассолов. Рассол должен удовлетворять следующим требованиям:
Вещество |
Концентрация в рассоле, г/л. |
NaCl |
310 |
Ca2+ |
Не более 5,0 |
Mg2+ |
Не более 1,0 |
SO42- |
Не более 4,0 |
Na2CO3 |
0,3-0,4 |
NaOH |
0,05-0,1 |
Несоответствие рассолов указанным требованиям затрудняет работу электролизеров и способствует разрушению диафрагм. Поэтому технический рассол подвергают очистке. Чаще всего применяют содово-каустический метод при температуре 40-70 °С.
Для очистки используют вторичный, или обратный, рассол, который образуется в цехе выпарки щелочи. Этот рассол содержит хлорид натрия и 2-2,5 г/л NaOH. При смешении сырого и обратного рассолов проходят реакции образования гидроксида магния:
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCI
MgSO4 + 2NaOH → Mg(OH)2↓ + Na3SO4
Растворимость гидроксида магния в воде и рассоле мала (0,9 г/л при 18·С) и он выпадает в осадок. Для очистки от ионов кальция в рассол вводят раствор кальцинированной соды;
СаСl2 + Na2CO3 → CaCO3↓ + 2NaCl.
Растворимость карбоната кальция уменьшается при повышении температуры и вследствие избытка соды в растворе. Для получения требуемой чистоты рассола избыток соды в растворе поддерживают в интервале 0,3-0,4 г/л, а процесс очистки проводят при 40-50 °С.
Карбонат кальция имеет крупнокристаллическую структуру и легко осаждается. Гидроксид магния, напротив, образует легкие аморфные хлопья, которые очень медленно осаждаются и легко разрушаются при перемешивании. При совместном осаждении и отстаивании частицы кристаллического СаСОз увлекают за собой хлопья Mg(OH)2, способствуя более быстрому отстаиванию. Для ускорения осаждения осадков применяют коагулянты и флокулянты.
Коагулянты - химические соединения, образующие в растворе крупные хлопья, которые легко осаждаются и увлекают с собой в осадок другие взвешенные частицы.
Флокулянты - вещества, способствующие агрегации взвешенных частиц в растворе и значительно ускоряющие процесс отстаивания. Наиболее часто в качестве флокулянта применяют полиакриламид - полимер линейного строения с электрически заряженными активными группами. Он образует в коллоидном растворе переходные мостики между отдельными взвешенными частицами и скрепляет их в крупные агрегаты. Применение флокулянтов сокращает продолжительность отстаивания с 18-24 до 6-8 ч и повышает производительность в 1,5-1,7 раза.
В цехе электролиза получают Сl2, Н2 и электролитические щелока, содержащие 110-140 г/л NaOH и 170-190 г/л NaCl. На технологические показатели процесса электролиза с твердым катодом влияют материал анода, состав и температура электролита, наличие и материал диафрагмы. Далее электролитические щелока подают на выпарку и очистку от NaCl в цех выпарки.
Хлор при растворении в электролите вступает в реакцию с Н2О, в результате образуются дье кислоты: НСl и НСlО. В присутствии щелочи образуется гипохлорит натрия NaClO. сдвигающий равновесие реакции (5) вправо.
С повышением температуры уменьшается перенапряжение реакции выделения хлора, увеличивается электропроводность электролита, что способствует уменьшению напряжения на электролизере. При высокой температуре снижается растворимость хлора в рассоле, и равновесие реакции гидролиза сдвигается влево. Вследствие этого сокращаются побочные реакции. Поэтому в промышленных условиях электролиз проводят при 85-95 °С.
Если гидроксил-ионы из катодного пространства поступают в анодное, то происходит реакция образования гипохлорита:
Cl2(р-р) + OH- → HClO + Cl-
HClO + OH- → ClO- + H2O
Гипохлорит-ионы разряжаются на аноде:
6ClO- + ЗH2O - 6e- → 2ClO3- + 4Cl- + 1.5O2 + 6 H+
При повышенных температурах протекает и химическая реакция
3ClO- ↔ ClO3- + 2Cl-
Кислород взаимодействует с графитом анода, разрушая его, и загрязняет хлоргаз диоксидом углерода:
O2 + С → СО2
Ионы ClO- и ClO3- остаются в растворе и загрязняют щелочь. Частично эти ионы восстанавливаются на катоде:
ClO3- + 6H+ + 6e- → Cl- + ЗH2O
ClO- + 2H+ + 2e- → Cl- + 2H2O
Таким образом, все химические превращения при электролизе хлоридов приводят к загрязнению и потерям основных продуктов - хлоргаза, едкого натра и водорода, а также к дополнительному расходу электроэнергии. Для уменьшения миграции ионов ОН- в анодное пространство под действием электролитических сил используют принцип противотока. При электролизе раствор движется из анодного пространства в катодное.
Встречный поток тормозит движение ионов ОН- к аноду под действием электростатических сил. Таким образом, можно снизить или полностью устранить миграцию гидроксильных ионов.
Степень конверсии (разложения) поваренной соли составляет 45-55%. Принцип действия электролизной ванны изображен на рис. 1. Ванна имеет перфорированный железный катод, к которому плотно прилегает фильтрующая осажденная диафрагма из асбестового картона. Асбест устойчив в среде католита и анолита, имеет небольшое электрическое сопротивление, анод выполнен из графита или материала ОРТА. Раствор хлорида натрия подают в анодное пространство, за счет гидростатического давления он фильтруется через диафрагму и достигает катода. Хлор удаляется из анодного пространства, водород и щелок - из катодного.
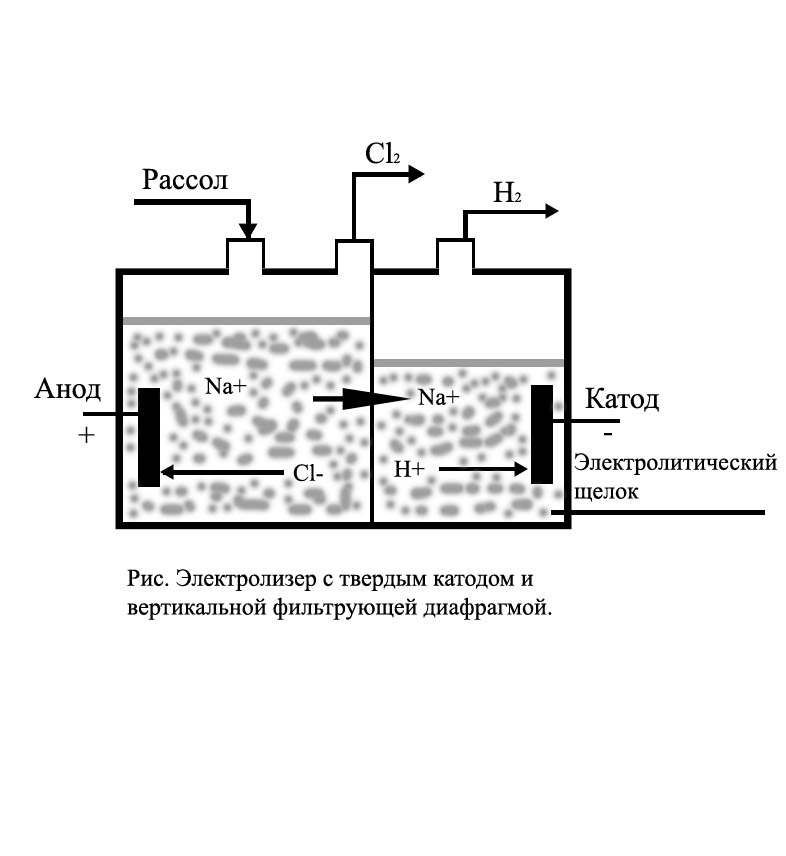
Диафрагменные ванны соединяют последовательно в серии, состоящие из 120-150 ванн. Срок работы одной ванны - 6-5 мес.
Хлор, отводимый из электролизера, имеет температуру 95 °С и содержит влагу в количестве 0,9-1,5 кг на 1 м3. Влажный хлор вызывает сильную коррозию аппаратуры, поэтому его всегда подвергают сушке серной кислотой последовательно в трех абсорберах, где концентрация H2SO4 меняется от 76 до 98%. В высушенном хлоре содержание влаги не превышает 0,04%, затем хлор компримируют и направляют потребителю.
Водород не агрессивен с точки зрения коррозионного разрушения. После электролизера его осушают, компримируют и направляют потребителю. Электролитические щелока поступают в цех на выпарку, которую проводят в четырех или пяти последовательно соединенных выпарных аппаратах.
По мере повышения концентрации NaOH растворимость NaCl падает, и он выпадает в осадок. После третьего выпарного аппарата шелока выводят из цикла, поваренную соль удаляют, а щелочь доупаривают. Качество щелочи определяется степенью очистки исходного рассола поваренной соли и условиями проведения электролиза.
