
- •1) Розрізняють три можливих механізми утворення пеш:
- •Теорія будови пеш
- •Модель пеш Гуї-Чепмена
- •1. Електроосмос
- •2. Електрофорез
- •3.Потенціал перебігу
- •4.Потенціал седиментації
- •Види стійкості дисперсних систем
- •Фактори стійкості дисперсних систем
- •Швидкість коагуляції
- •Гетерокоагуляція. Взаємна коагуляція колоїдів
- •3.Основи хімічної термодинаміки
- •Процеси є:
- •3.2 Закон Кіргофа
- •3.3 Основні принципи ( початки) термоденаміки.
- •3.3.2. II Початок термоденаміки.
- •3.3.4. Ііі Початок термодинаміки.
- •3.4. Термодинамічні потенціали
- •3.5. Критерії перебігу довільних процесів
- •3.6. Хімічний потенціал
- •4. Фізико-хмія поверхневих явищ
- •4.3 Адсорбція
- •4.3.1. Поверхнево-активні речовини.
- •4.3.4. Рівння адсорбції Гіббса
- •4.7.Когезія та адгезія
- •5.3.2. Диспергаційні методи одержання колоїдних систем.
- •5.3.2.1. Механісне диспергування
- •5.3.2.2. Ефект ребіндера.
4.3.1. Поверхнево-активні речовини.
Стосовно води усі речовини поділяють на поверхнево- активні (ПАР) та поверхнево-інактивні (П-інАР). Такий поділ речовин є умовній, бо велика кількість речовин, які є ПАР у водних розчинах, в інших розчинниках є П-інАР. Для інших розчинників, крім води,ют кож підібрати ПАР.
ПАР-це
речовини , щор адсорбуються на поверхні
поділу фаз ( )
та знижують між фазову вульну поверхневу
енергію (поверхневий натяг) (
)
та знижують між фазову вульну поверхневу
енергію (поверхневий натяг) ( ).
ПАР поділяють на йонні та нейонні, айонні
, катіонні а також амфолітні.
).
ПАР поділяють на йонні та нейонні, айонні
, катіонні а також амфолітні.
Здатність ПАР адсорбуватись на поверзневі води визначається особливістю їхньої будови. Схематично молекули ПАР можна зобразити у вигляді кульки з довгим хвостом (рис.4.2)
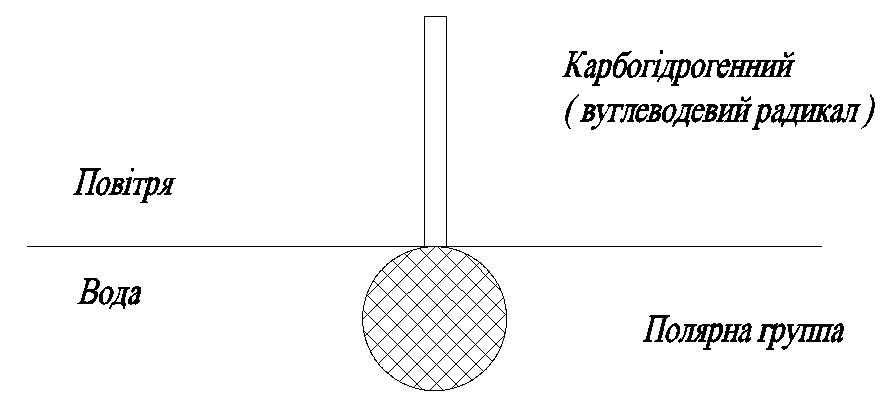
Молекула ПАР складається з неполярної групи ( карбогідрогенного радикалу) та полярної функціональної групи . Перша є гідрофобна ( відштовхує воду), а друга –гідрофільна ( притягує воду, взаємодіє з нею). Молекули ПАР такої будови називають дифільними, тобто мають два(ді) вподобання ( філ).
Найвигіднішим енергетичним станом дифільних молекул є їх розташування на межі поділу фаз.
4.3.2 Насичений і ненасичений мономолекулярний поверхневий шар. «Двовимірний газ».
Моношар- це поверхнева пліка з одного шару молекул ПАР, що утворюється на межі водним розчиом ПАР і повітрям , органічною рідиною або твердою поверхню.В залежності від концентрації ПАР на поверхні принциповао можливі принаймні 3 випадки орієнтації ( рис 4.3.)
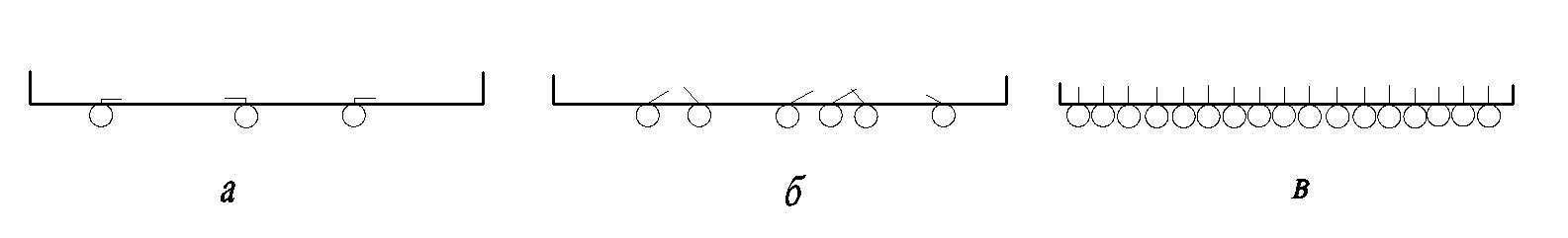
Рис.4.3. Зміна орієнтації молекул ПАР при збільшенні концентрації ( від (а) до(в))
При низькій концентрації ПАР її молекули вільно переміщаються по поверхні у двох вимірах . Тому такий стан називають двовимірним газом ( сильнорозріджена плівка ПАР).
Дійсно, між поверхневим тиском (П) ,який створюють гідрлфобні кінці молекул ПАР і загальною площею (С) , яку займають (н) молей ПАР існує співвідношення
πS = nRT (4-2)
Воно дійсно є аналогією рівнянню Клаперона-Мендєлєєва для тривимірного ідеального газу
PV = nRT (1-1),(1-6)
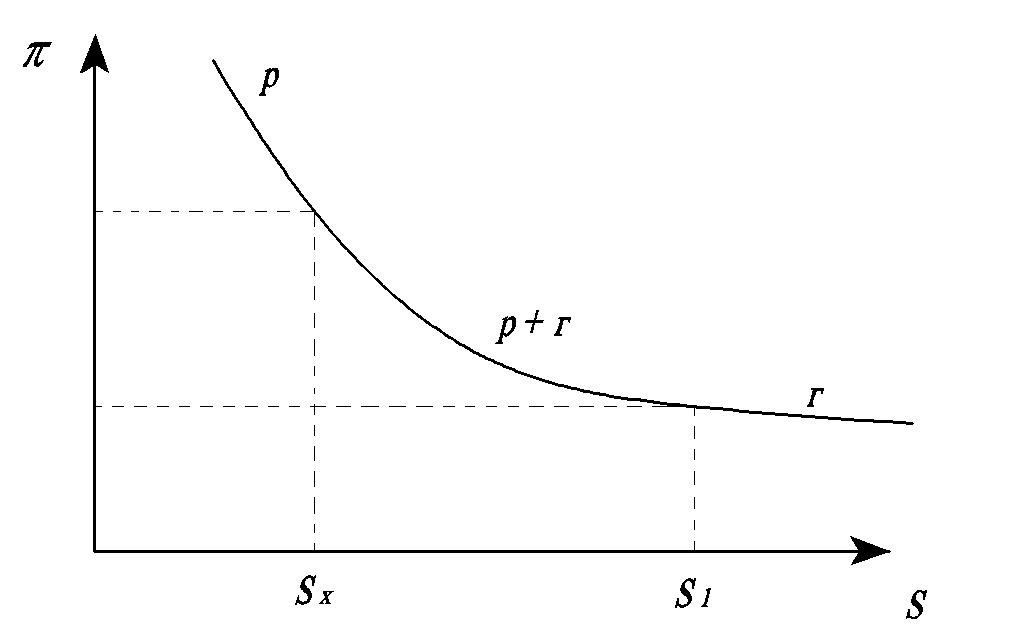
Основна храктеристика нерозчинних у воді моношарів ПАР є ізотерма поверхневий тиск-поверхня (π-S) (Рис.4.4.)
 Літерами
р і г позначені стани: газоподібний
(г), рідкий (р), та одночасно існування
рідкого (р) та газоподібного (г) станів
(р+г)
Літерами
р і г позначені стани: газоподібний
(г), рідкий (р), та одночасно існування
рідкого (р) та газоподібного (г) станів
(р+г)
Рис.4.4. Залежність поверхневого тиску від велечини поверхні для розчину ПАР (стану мономолекулярного шару).
Ця ізотерма дуже подібна до кривих ( ізотерм) конденсації звичайних газів згідно з рівнянням Ван-дер-Ваальса (Р-V) (Рис 1.2.) Ці аналогії ( рівняння та ізотерми )приводять до висновку, що ці явища подібні.
Розглянемо ізотерму стану мономолекулярного шару.
Якщо двовимірний газ розрідженний ( стан г ) , то відстань між молекулами велика, і вони вільно рухаються. Зменшення площі їхнього розміщення зумовлює підвищення поверхневого тиску (π) молекул ПАР.
Для низьколетких ПАР при (S=S1 (р-г) у двовимірному газі починається двовимірна конденсація. Вона відбувається через зростання сил міжмолекулярної взаємодії, які прагнуть об’єднати молекули.
Кондесація триває при постійному тискові (π ) , досягаючи такого стану,
Коли (S=Sx) і весь двовімірний газ переходить у двовимірну рідину (стан р )
Коли (S˂Sx), моношар є практично не стислим і протидіє деформаціям різким збільшенням поверхневого тиску (π) (стан рідини).
Якщо
знати (Sx)
, то можна розрахувати площу (S0),
яку займе одна молекула ПАР у моношарі
двовимірної рідіни:
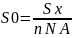 ;
;
n-кількість молей розчиненої речовини;
NA
-стала Авогадро ( Число Авогадро* NA
6,022·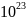
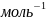 ,
,
N NA - кількість молекул на поверхні (Sx)
Розрахунки
показують, що площа , яку займає одна
молекула, дорівнює площі Полярної групи
ПАР . У гомологічному рядку жирних кислот
площа , яку займають різні кислоти,
виявляються однаковою для всіх кислот:
S
=0,205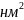 .
.
Це підтверджує, що в моношарі гідрофобні хвости орієнтовані вертикально.
Одноланцюгові ланцюгові амфіфільні молекули прагнуть до утворення у водному середовищі глобулярних міцел (рис.4.5). Міцела – це структурна колоїдна частинка дисперсної фази. Про це йтиметься далі.
У випадку дволанцюгових амфіфільних молекул спостерігається тенденція до формування подвійних шарів у водних дисперсіях – пластинчатих структур
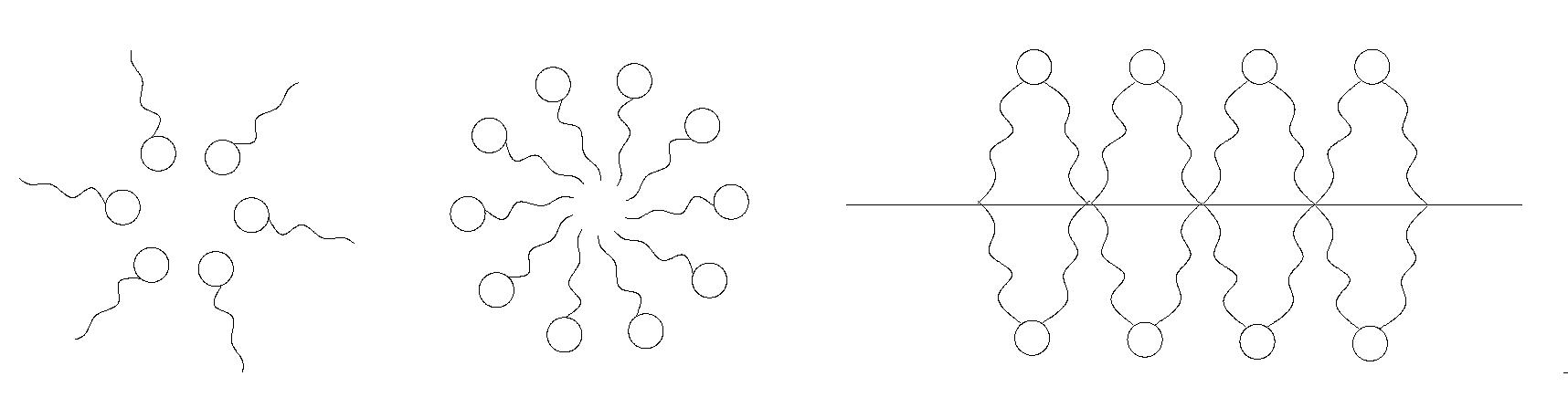
( рис.4.5,5)
Таким шляхом утворюється, наприклад, біологічні мембрани.
Можна припустити, що у разі дволанцюгових ПАР ( а такі компоненти можуть бути у складі зв’язуючих друкарсь фарб) можливі утворення подвійних шарів як і моношарів у процесі зволоженення ( змащення) елементів друкарської форми. Подумаємо, які наслідки можуть бути? У крайніх випадках гідрофізілізації замащенних елементів і гідрофобізації пробільних елементів ми маємо очікувати інверсію друкувальних і пробілних елементів.
