
- •1) Розрізняють три можливих механізми утворення пеш:
- •Теорія будови пеш
- •Модель пеш Гуї-Чепмена
- •1. Електроосмос
- •2. Електрофорез
- •3.Потенціал перебігу
- •4.Потенціал седиментації
- •Види стійкості дисперсних систем
- •Фактори стійкості дисперсних систем
- •Швидкість коагуляції
- •Гетерокоагуляція. Взаємна коагуляція колоїдів
- •3.Основи хімічної термодинаміки
- •Процеси є:
- •3.2 Закон Кіргофа
- •3.3 Основні принципи ( початки) термоденаміки.
- •3.3.2. II Початок термоденаміки.
- •3.3.4. Ііі Початок термодинаміки.
- •3.4. Термодинамічні потенціали
- •3.5. Критерії перебігу довільних процесів
- •3.6. Хімічний потенціал
- •4. Фізико-хмія поверхневих явищ
- •4.3 Адсорбція
- •4.3.1. Поверхнево-активні речовини.
- •4.3.4. Рівння адсорбції Гіббса
- •4.7.Когезія та адгезія
- •5.3.2. Диспергаційні методи одержання колоїдних систем.
- •5.3.2.1. Механісне диспергування
- •5.3.2.2. Ефект ребіндера.
4. Фізико-хмія поверхневих явищ
Гетерогенні процеси ( каталітичні т некаталітичні) проходять наповерхні або за участю поверхні.
Поверхні явища проявляються в процессах, що відбуваються на межі поділу фаз- рухомих Р-Г та нерухомих Т-Г Р-Р Т-Р Т-Т ,де
Т- тверде тіло, Г-газ, Р – рідина.
4.1.Поверхневий натяг рідини
Тверді
тіла і рідини мають поверхні поділу із
сусідніми фазами. Стан молекул речовин
в об’ємі
фази і у поверхневому шарі із сусідніми
фазами. Основна різниця полягає в тому,
що поверхневий шар молекул твердого
тіла або рідини має надлишкову енергію
Гіббса у порівнянні з молекулами об’ємної
фази.

Поверхнева енергія Гіббаса зумовлена неповною скомнсованістю міжмолекулярних сил тяжіння (пригягання) молекул поверхневого шару через слабку взаємодію з граничною фазою (див.позділ 1-2 ).
4.2 Спонтанні (довільні) процеси на межі поділу фаз багатокомпонентних систем.
Нескомпенсованість молекулярних сил ( рис.4.1) не залишаються без наслідків. На межі поділу фаз перебігають процеси, які зумовлюють довільне зменшення поверхневої енергії.
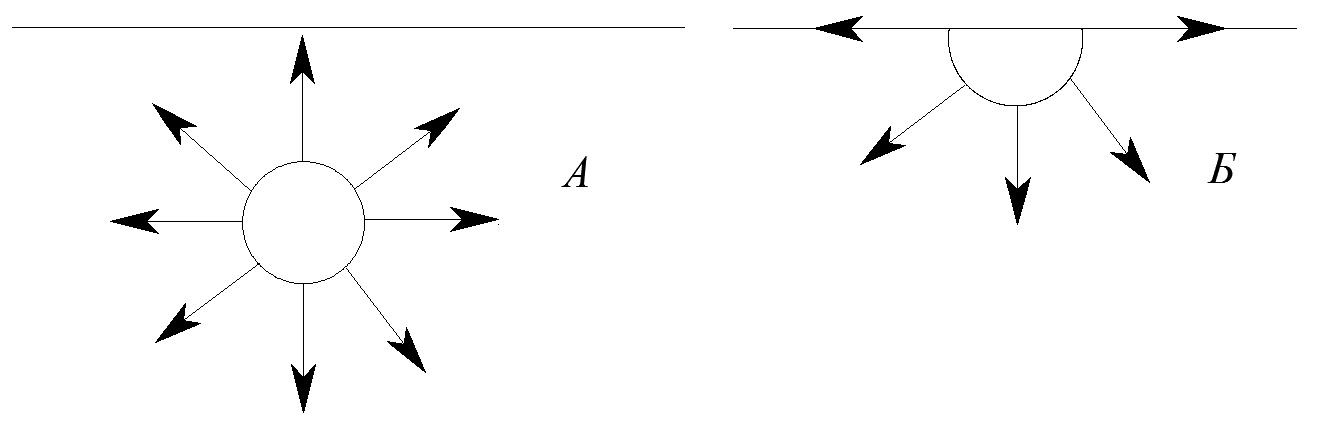 Рис.
4.1. Міжмолекулярні сили взаємодії в
об’ємі
(А) та на поверхні (Б).
Рис.
4.1. Міжмолекулярні сили взаємодії в
об’ємі
(А) та на поверхні (Б).
Можливість
проходження довільного процессу
визнрачення довільного процессу
визначення за зміною вільної поверхневої
енергії
 (енергії Гіббса):
(енергії Гіббса):
Де
( )
–поверхневий натяг та його зміна;
)
–поверхневий натяг та його зміна;
(s,
 ) –поверхня поділу фаз і її зміна.
) –поверхня поділу фаз і її зміна.
Знак = -для оборотного рівноважного процессу.
˂ - для довільного оборотного процессу.
Отже поверхнева енергія системи залежить від поверхневого натягу та поверхні поділу фаз ( величини площі цієї поверхні).
Поверхневі явища при загальному розгляді можна поділити на дві групи: ( табл.4.1)
Класифікацація поверхневих явищ за зміною енергії Гіббса
Таблиця 4.1.
I група |
II група |
|||
Зменшення |
Зменшення
|
|||
Утворення сферичної гладкої поверхні рідини |
Укрупнення частинок дисперсної фази (адгезія,коагуляція, коалесценція) |
Фізико – хімічні явища (адсорбція) |
Електричні явища
|
Теплові явища
|
1 |
2 |
3 |
4 |
5 |
4.3 Адсорбція
Довільне
зменьшення
 відбувається при абсорбції. Адсорбція
– довільна зміна концентрації компонентів
у поверхневому шарі
відбувається при абсорбції. Адсорбція
– довільна зміна концентрації компонентів
у поверхневому шарі
 у стані рівноваги порівнянно з концетрацією
в об’ємній фазі
у стані рівноваги порівнянно з концетрацією
в об’ємній фазі
 на межі поділу фаз розчин-газ;розчин-розчин.
Газ (розчин –тверде тіло ) . Можна сказати
. що це збільшення
у порівнянні з
у певному процесі або з плином часу.
на межі поділу фаз розчин-газ;розчин-розчин.
Газ (розчин –тверде тіло ) . Можна сказати
. що це збільшення
у порівнянні з
у певному процесі або з плином часу.
Адсорбція залежить від природи розчинника і розчинної, а сааме : від значення величини цих речовин. Наприклад, якщо поверхневий натяг розчинника більший за розчичненої речовини, то остання проявляє поверхневу активність. Зменшування поверхневій натяг розчину.

