
- •Углеводороды
- •1. Электронное строение молекулы метана сн4:
- •Молекула метана имеет тетраэдрическое строение
- •Чтобы лучше понять, что такое первичный, вторичный, третичный и четвертичный атом углерода рассмотрим следующий пример – вещество в котором присутствуют все четыре типа атомов.
- •2,2,4 Триметилпентан
- •3. Номенклатура алканов.
- •4. Изомерия алканов.
- •6. Физические свойства предельных углеводородов.
- •7.Основные способы получения алканов.
- •8.Основные химические свойства алканов.
- •9. Применение алканов.
- •Строение циклопарафинов.
- •Изомерия циклопарафинов.
- •4. Физические свойства циклопарафинов.
- •Способы получения циклопарафинов.
- •Химические свойства циклопарафинов.
- •Применение циклопарафинов.
- •Электронное строение молекулы этилена.
- •2. Гомологический ряд алкенов. Построение названий алкенов.
- •3. Изомерия алкенов.
- •Нахождение алкенов в природе и способы их получения.
- •Физические свойства алкенов.
- •Химические свойства алкенов.
- •Номенклатура и строение диеновых углеводородов.
- •2. Классификация диеновых углеводородов.
- •3. Основные способы получения диеновых углеводородов.
- •4. Основные физические свойства некоторых диеновых углеводородов.
- •5. Некоторые химические свойства диеновых углеводородов.
- •6. Применение диеновых углеводородов.
- •Электронное строение молекулы ацетилена - c2h2:
- •2. Гомологический ряд алкинов.
- •3. Номенклатура алкинов.
- •4. Изомерия алкинов.
- •5. Основные способы получения некоторых алкинов.
- •6. Физические свойства алкинов.
- •7. Основные химические свойства некоторых алкинов.
- •8. Применение алкинов.
- •Литература.
- •Автор разработки: Демидов Владимир Александрович,
Способы получения циклопарафинов.
А) Взаимодействие дигалогенпроизводных алканов с цинковой пылью в спиртовом растворе при нагревании.
CH2 – Cl Zn; 125oC CH2
H2C H2C + ZnCl2
CH2 – Cl спирт CH2
1,3-дихлопропан циклопропан
Б) Взаимодействие дигалогенпроизводных алканов с металлическим натрием.
 H2C
CH2
H2C
CH2
CH2 – CH2 – Cl
H2C + 2Na H2C CH2 + 2NaCl
CH2 – CH2 – Cl CH2
1,5-дихлорпентан циклопентан
В) Гидрирование бензола и его производных.
 СН3
СН3
СН3
СН3


 H2/Ni
H2/Ni
150oC; давл.
толуол метилциклогексан
Химические свойства циклопарафинов.
А) Гидрирование (на катализаторе при повышенной температуре происходит разрыв цикла с образованием соответствующего алкана).

 H2/Ni
H2/Ni
СH3 – CH2 – CH3
80oC
циклопропан пропан
 H2/Ni
H2/Ni
 СH3
– CH2
– CH2
– СH3
СH3
– CH2
– CH2
– СH3
120oC
циклобутан бутан
Б) Взаимодействие циклопарафинов с галогенводородами.

 +
НСl
CH3
– CH2
– CH2Cl
+
НСl
CH3
– CH2
– CH2Cl
циклопропан 1-хлорпропан
В) Взаимодействие с галогенами.
H Cl
CH2 tо C
H
 2C CH2 +
Cl2
H2C CH2
+ HCl
2C CH2 +
Cl2
H2C CH2
+ HCl
H2C CH2 H2C CH2
CH2 CH2
циклогексан монохлорциклогексан
H Cl

 CH2
tо
Cl C Cl
CH2
tо
Cl C Cl
H 2C CH2 + 6Cl2 С С + 6HCl
H H
H 2C CH2 Cl Cl
CH2 C C
 H
C H
H
C H
циклогексан
гексахлорциклогексан H Cl
Данное вещество – гексахлорциклогексан, образуется при избытке хлора вступившего в реакцию.
При взаимодействии циклопарафинов с тремя или четырьмя атомами углерода в цепи с галогенами происходит разрыв цикла, а атомы галогена присоединяются к кольцевым атомам углерода.
+ Cl2 Cl – CH2 – CH2 – CH2Cl
циклопропан 1,3 дихлорпропан
Г) Дегидрирование циклопарафинов.
 СН3
СН3
СН3
СН3
Mo2O3 Al2O3 + 3H2
560oC; 2МПа
метилциклогексан толуол
 CH2
СH
CH2
СH
H

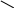 2C CH2
300оС,
Pt HC CH +
3H2
2C CH2
300оС,
Pt HC CH +
3H2
H 2C
CH2 HC CH
2C
CH2 HC CH
CH2 CH
циклогексан бензол
Д) Окисление циклопарафинов.
H 2C
– CH2
H2C
– CH2
2C
– CH2
H2C
– CH2
 CH2
+ Cl2
CH – Cl + HCl
CH2
+ Cl2
CH – Cl + HCl
H2C – CH2 H2C – CH2
Е) Взаимодействие с серной концентрированной кислотой.
+ H2SO4(конц.) CH3 – CH2 – CH2OSO3H
циклопропан пропилсерная кислота
Ж) Горение циклопарафинов.
C4H8 + 6O2 4CO2 + 4H2O
Применение циклопарафинов.
А) Производство искусственных волокон.
Б) Синтез красителей, медикаментов.
В) Производство ароматических углеводородов.
III. Алкены или олефины1 (углеводороды этиленового ряда) – сложные органические вещества с общей формулой CnH2n в молекулах которых между атомами углерода имеется одна двойная связь, способные присоединять к себе молекулы водорода, галогенов и других веществ в силу валентной не насыщенности атома углерода
