
- •Введение
- •ВВЕДЕНИЕ
- •1. ОБЩИЕ СВЕДЕНИЯ О ДИСПЕРСНЫХ СИСТЕМАХ
- •1.1. Основные понятия и определения
- •1.3. Специфические особенности высокодисперсных систем
- •1.4. Классификации дисперсных систем
- •1.5. Методы получения дисперсных систем
- •1.5.1. Диспергационные методы
- •1.5.2. Конденсационные методы
- •1.5.3. Метод пептизации
- •1.6. Методы очистки дисперсных систем
- •1.7.1. Поверхностное натяжение
- •1.8. Поверхностно-активные вещества
- •1.9. Смачивание
- •1.10. Флотация
- •1.11. Строение коллоидных мицелл
- •1.12. Устойчивость и коагуляция дисперсных систем
- •2. НЕФТЯНЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ
- •2.2. Строение и свойства дисперсионной среды
- •2.3. Способы описания механических свойств
- •2.4. Виды локальных образований в нефтяных системах. Строение сложных структурных единиц
- •2.5. Виды межмолекулярных взаимодействий
- •2.6. Влияние межмолекулярных взаимодействий на свойства молекулярных растворов и НДС
- •2.7. Факторы, влияющие на устойчивость дисперсных систем. Методы определения и способы регулирования устойчивости НДС
- •2.9. Способы получения и регулирования свойств НДС. Нефтяные эмульсии
- •2.9.1. Классификация эмульсий
- •2.9.2. Методы получения эмульсий
- •2.9.3. Механизм образования эмульсий
- •2.9.4. Факторы, влияющие на устойчивость эмульсий
- •3. ХАРАКТЕРИСТИКА ОСНОВНЫХ СОЕДИНЕНИЙ НЕФТИ
- •3.1. Алканы
- •3.1.1. СТРОЕНИЕ АЛКАНОВ
- •3.1.2. НОМЕНКЛАТУРА АЛКАНОВ. Правила построения названий алканов по номенклатуре ИЮПАК
- •3.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА
- •3.1.4. Содержание алканов в нефтях
- •3.1.5. Теплофизические свойства
- •3.1.6. Газообразные алканы
- •3.1.7. Применение газов
- •3.1.8. Жидкие алканы
- •3.1.8.1. Углеводороды лёгких фракций нефти
- •3.1.8.2. Углеводороды средних фракций нефти
- •3.1.8.3. Изопреноидные углеводороды нефти
- •3.1.9. Твёрдые алканы
- •3.1.10. ХИМИЧЕСКИЕ СВОЙСТВА
- •3.2.2. Физические свойства циклоалканов
- •3.2.3. Химические свойства
- •3.3.2. СТРОЕНИЕ БЕНЗОЛА
- •3.3.3. Физические свойства аренов
- •3.3.4. ХИМИЧЕСКИЕ СВОЙСТВА аренов
- •3.3.5. Правило ориентации и реакционная способность
- •ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
- •Дисперсные системы
- •Нефтяные Дисперсные системы
- •ОБЩАЯ ХАРАКТЕРИСТИКА НЕФТИ. СОСТАВ НЕФТИ. ПЕРЕРАБОТКА НЕФТИ И ГАЗА
- •ФИЗИЧЕСКИЕ СВОЙСТВА НЕФТИ
- •ВЫВОДЫ
vk.com/club152685050 | vk.com/id446425943
обогащается около 90% руд цветных металлов, уголь, сера и др. природные материалы.
Флотационное обогащение (разделение) основано на различной смачиваемости водой ценных минералов и пустой породы. В случае пенной флотации через водную суспензию измельченной руды (пульпу) барботируют воздух, к пузырькам которого прилипают гидрофобные частицы ценного минерала (чистые металлы или их сульфиды), всплывающие затем на поверхность воды, и с образовавшейся пеной снимаются механически для дальнейшей переработки. Пустая порода (кварц, алюмосиликаты) хорошо смачивается водой и оседает во флотационных машинах.
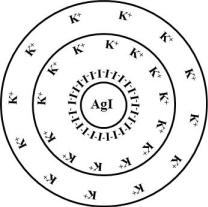
1.11. СТРОЕНИЕ КОЛЛОИДНЫХ МИЦЕЛЛ
Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой.
Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора –
потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса-Панета-Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые входят в состав агрегата; способны достраивать
37
vk.com/club152685050 | vk.com/id446425943
кристаллическую решетку агрегата; образуют малорастворимое соединение с ионами агрегата; изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда –
противоионы (ПИ) из раствора.
Рис.10. Схематическое строение мицеллы золя иодида серебра
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу (гранулу) окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно
38
vk.com/club152685050 | vk.com/id446425943
связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Рассмотрим строение мицеллы при образовании коллоидного раствора – золя иодида серебра методом химической конденсации при небольшом избытке нитрата
серебра. |
|
+ = ↓ + |
|
3(изб) |
3 |
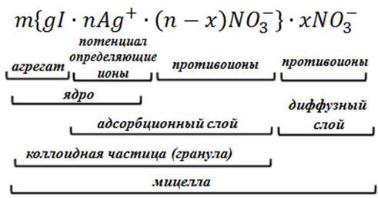
Формула{ мицеллы∙ запишется∙ ( − ): −} ∙ −
+ 3 3
где: m - количество молекул или атомов, образующих агрегат; n - число потенциалопределяющих ионов, адсорбированных наповерхности агрегата; (n-x) - число противоионов в плотной части двойного электрического слоя (адсорбционный слой); x - число противоионов в диффузной части двойного электрического слоя; x+ - заряд коллоидной частицы (гранулы).
При образовании золя иодида серебра при небольшом избытке иодида калия:
39
vk.com/club152685050 | vk.com/id446425943
3 + (изб) = ↓ + 3 Образуется{ мицелла∙ −следующего∙ ( − ) +состава} ∙ +:
Заряд коллоидной частицы в данной мицелле будет отрицательным.
Примеры мицелл гидрофобных золей в природе
В природе в коллоидном состоянии широко распространены сульфидные руды многих элементов (Ag, Zn, Hg, As, Fe, Sb, Ni).
H2S – важнейший стабилизатор коллоидных частиц |
|||||||
↔ |
|
+ |
|
↔ 2 |
|
+ |
|
сернистых минералов, может диссоциировать по двум стадиям: |
|||||||
2 |
+ |
|
− |
|
+ |
|
2− |
Показано, что устойчивость коллоидных растворов, стабилизированных H2S зависит от присутствия кислорода воздуха. Так, при хранении золя сульфида ртути без воздуха ее
устойчивость возрастает, что, по-видимому, объясняется изменением{ ∙состава∙мицеллы( − ): } ∙
− { + + ( ) }
→ ∙ 2− ∙ 2 − + ∙ 2 +
При этом потенциалопределяющими ионами являются в первом случае HS-, во втором – S2-.
Коллоидный карбонат кальция в природе не устойчив
и сравнительно быстро переходит в метаколлоидные формы.
Предположив, что2CaCO+ 32образуется3 → при3обменной+ 2 реакции:
40
vk.com/club152685050 | vk.com/id446425943
вероятное строение мицеллы можно представить следующим образом:
- |
{ |
|
∙ 2CO3∙: 2( − ) |
|
} ∙ 2 |
|
|
|
||||
при избытке CaCl : |
|
|
− |
|
− |
|
||||||
|
3 |
|
|
2+ |
|
|
|
|||||
- |
Золь{ |
∙ |
|
∙2( − ) |
|
} ∙ 2 |
|
|
||||
при избытке Na |
32− |
|
|
+ |
|
|
+ |
|
||||
|
3 |
|
|
|
|
|
|
|
||||
|
сульфата бария образуется в природе при |
|||||||||||
взаимодействии |
растворимых |
соединений |
бария |
с |
||||||||
растворимыми сульфатами. Заряд коллоидной частицы обычно |
|||||||||||||||
{ ∙ |
|
∙ 2( − ) |
|
|
} ∙2 |
|
|
||||||||
отрицателен: |
4 |
|
|
42− |
|
|
|
|
|
+ |
|
|
+ |
||
|
|
|
2 |
|
|
|
|
|
|||||||
Щелочные |
→ |
+ |
+ |
|
|
|
|
||||||||
стабилизатор: |
|
2 |
4 |
|
|
|
|
|
42− |
|
|
||||
образуют |
|
+ 2 = |
|
↓ |
+2 |
|
|
||||||||
2 |
метасиликаты |
|
при гидролизе |
|
|
||||||||||
3 |
|
|
2 |
|
2 |
|
3 |
|
|
|
|
|
|
||
устойчивые золи |
|
кремниевой |
кислоты, |
которые в |
|||||||||||
{ |
∙ |
|
|
∙ 2( |
|
− ) |
|
|
} ∙ 2 |
|
|||||
щелочных растворах имеют отрицательный заряд: |
|
+ |
|||||||||||||
2 |
3 |
|
|
32− |
|
|
|
|
|
+ |
|
|
|||
стабилизатор: |
2 3 → 2 + + 32− |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Возникновение двойного электрического слоя на поверхности ионностабилизированных частиц сообщает им электрический заряд. Последний может возникать также за счет диссоциации собственных частиц ионогенных групп.
Например, гидроксид алюминия, образующийся при обменных и гидролитических реакциях, легко пептизируется,
41
