
Брасиностероїди
Крім п'яти класичних фітогормонів (ауксини, цитокініни, гібереліни, АБК і етилен) у 1979 році було знайдено і виділено у чистому вигляді з пилку ріпака Brassica napus L новий тип фіторегуляторів, які описані в літературі під назвою брасиностероїди. На сьогодні відомо 12 представників брасиностероїдів, які мають стероїдну природу і відрізняються своїми радикалами (Хрипач В.А. та ш., 1995).
Основна властивість брасиностероїдів - дуже висока фізіологічна активність. Якщо класичні фітогормони діють у концентраціях 10-6 – 10-5 моля, то брасиностероїди - в дозах 10-8-10-11 моля, Після обробки брасиносте-роїдами виявлена сильнодіюча стимуляція росту зернобобових, овочевих. плодових культур. Японські вчені У.Такематцу, А.Такеучі (1989) при обробці пшениці у фазі цвітіння водним розчином одного з брасиностероїдів одержали збільшеення маси колоса і кількості зерна у колосі на 20-30%.
Встановлено, що брасиностероїди сприяють збільшенню розмірів бульб картоплі. Вивчається їх дія на тварин і людину (з хімічної точки зору вони споріднені з гормонами линьки комах - екдистероїдів). Сучасні експериментальні дослідження свідчать про перспективність використання брасиностероїдів у сільському господарстві (у них невелика токсичність та дуже низькі норми витрат).
С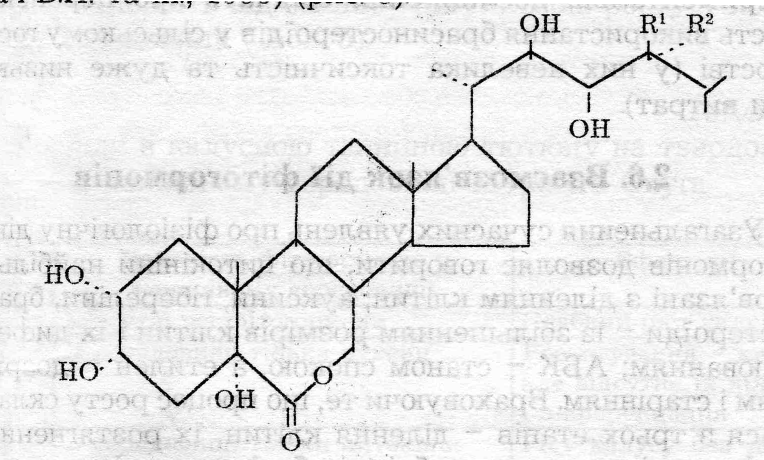 труктуреі
формули деяких брасиностероїдів:
труктуреі
формули деяких брасиностероїдів:
Брасинолід R1 = СН3, R2 = Н Норбрасинолід R1 = R 2 = Н Епібрасинолід R1= Н, R2 = СН3 Гомобрасинолід R1 = С2Н5, R 2 = Н ; Доліхолід R1 " R 2 = СН3
Гомодоліхолід R1 - R 2 = СНСН3
Лекція 3.
Тема: Мікроклональне розмноження рослин.
1. Способи регенерації рослин та етапи мікроклонального розмноження;
2. Експланти, їх походження і введення в культуру;
3. Активація розвитку пагонів та їх укорінення;
4. Перенесення рослин ін вітро в умови вільного існування;
5. Генетична стабільність при мікроклональному розмноженні та переваги і недоліки клонального мікророзмноження рослин.
1. Протягом багатьох сторіч у сільському господарстві широко застосовується людством вегетативне розмноження рослин (поділом куща, живцями, відводками, листками, вусами та ін.). Але це процес тривалий та трудомісткий. Завдяки біотехнології, на сьогодні розроблені принципово нові технології прискореного вегетативного розмноження майже для 2400 видів рослин, які одержали назву «мікроклональне розмноження рослин» (розмноження рослин ін вітро).
Основою мікроклонального розмноження – є регенераційна здатність тотипотентних рослинних клітин.
Термін «регенерація» (від лат. regeneratio – відновлення) – в біолгії означає відновлення організмом втрачених або пошкоджених тканин (органів), а також відновлення цілого організму.
З зоології відомо про природну регенерацію дощового черв’яка, гідри, планарії та ін. А у рослин висока регенераційна здатність притамана практично всім клітинам.
Регенерацію рослин у культурі ін вітро можна здійснити такими шляхами:
Органогенез – утворення пагонів, коренів або рослин-регенерантів безпосередньо з експланту (апекса бруньки, листка, калусної тканини та ін.);
Культура зародків (важливий засіб збереження нежиттєздатних зародків шляхом пророщування їх в умовах ін вітро, на штучному поживному середовищі);
Соматичний ембріоїдогенез – утворення зародкоподібних структу із соматичних клітин ррослин.
Класичним прикладом регенерації рослин шляхом прямого органогенезу є розмноження кімнатної рослини бегонії:
зрізають повністю сформований непошкодженний листок, перевертають його нижньою поверхнею догори і нарізають листові живці розміром 1-2 см;
листові живці розкладають зворотним боком листка або або висаджують вертикально у субстрат (пісок – торф 1:1), який попередньо стерилізують;
умови вирощування – 80-90% вологість, 18-21ºС – температура, обприскування фунгіцидом (фундазол, каптан);
через 5-6 тижнів біля зрізів великих жилок з’являються молоді рослини-регенеранти, які після короткого підрощування пересаджуються для адаптації.
Аналогічно розмножуються багато однодольних рослин: гелоніопсис, гіацинт, сансів’єра та ін.
Процес мікроклонального розмноження ін вітро може бути двох видів:
Активація розвитку вже існуючих в рослині меристем, які знаходяться у верхівках стебла, в пазухових (сплячих) бруньках.
Формування зародкоподібних структур заново (через калусну тканину).
На практиці найбільш поширений перший тип розмноження, який зводить до мінімуму появу генетично змінених форм рослин. Органогенез при мікроклональному розмноженні рослин відбувається за таким сценарієм: а) на штучне поживне середовище з певним балансом фітогормонів в контрольованих умовах температури і освітлення вміщують невеличку частину рослини (бруньку, верхівку 0,3-3 мм), яка пускає пагони,
б) пагони відділяютьі пересаджують на інше середовище для укорінення,
в) одержані рослини-регенеранти адаптують до природних умов.
Таким чином, мікроклональне розмноження (синонім – клональне мікророзмноження) – це масове нестатеве розмноження рослин у стерильних умовах, яке виключає появу генетично змінених форм.
Технологія мікроклонального розмноження рослин складається з таких основних етапів:
Підбір експлантів і введення їх в культуру.
Активація розвитку пагонів з експланту при підвищеній концентрації цитокінінів живильного середовища.
Укорінення пагонів при збільшенній концентрації ауксинів в поживному середовищі.
Переведення одержаних рослин із стерильних умов у грунт, їх адаптація (перенесення з умов ін вітро в умови ін віво).
2. Найбільш важливим моментом є вибір материнської рослини і експланту. Термін «експлант» застосовують для назви вихідного шматочка рослини, який вводять в культуру ін вітро. В якості експлантів використовують верхівки пагонів, бокові бруньки, частинки кореня або листка, черешок листка, суцвіття, пелюстки квітів, гіпокотиль проростаючого насіння та інші частини рослин.
Для успішного проведення робіт з регенерації рослин вибір експлантів відіграє першорядне значення. Краще всього використовувати матеріал вилучений з здорових, сильних рослин. Вибір експланта залежить від виду, стану рослини-донора, фази її розвитку, сезону року. Значення має навіть положення експланта на рослині. Так, верхівки пагонів, взяті з верхніх гілок дерева, мають більшу швидкість розмноження, ніж верхівки з нижніх гілок. Більшість експлантів добре вводяться в культуру у фазу активного росту донорської рослини. Проте є рослини, експланти з яких утворюють пагони лише в стані спокою. Незрілі, молоді органи завжди більш пластичні з точко зору здатності до морфогенезу ін вітро, ніж старіючі, зрілі тканини та органи. Більше того, при виборі експлантів слід віддавати перевагу меристематичним тканинам, оскільки вони легше виживають у культурі, мають більшу швидкість росту і тотипотентність. Розмір експланта теж визначає ступінь виживання ін вітро (крупніші за розміром верхівки пагона завжди краще виживають).
Донорські рослини, з яких збираються вилучити експланти, вирощують у якомога чистому середовищі, уникаючи надмірного поливання, забруднення пагонів і листків. Важливими компонентами успіху є очистка і стерилізація рослинного матеріалу перед введенням його в культуру ін вітро.
Таким чином, відібраний і простерилізований експлант вводиться в культуру на спеціальне поживне середовище.
3. Всі рослини ростуть завдяки активності їх верхівкових меристем. Такі меристематичні тканини знаходяться на кінчику основного пагона, в пазухових бруньках, зародку – класичних експлантах для мікроклонального розмноження рослин .
Брунька – це зачатковий, нерозвинений пагін з дуже вкороченими міжвузлями. Вона складається з меристематичної зачаткової осі, яка закінчується конусом наростання. Нижче конуса наростання закладаються зачатки листків, різні за віком і розміром. Листки розташовані в брунці один над одним. В пазухах зачасткових листків (примордіїв) утворюються горбочки – зачатки бічних (пазушних) бруньок. Отже вегетативні бруньки можуть бути верхівочними (апікальними) і пазушними, розташованими в пазухах листків або брунькових лусочок.
Поніття апекс і конус наростання не можна ототожнювати. Пояснюється це тим, що під конусом наростання розуміють лише верхню (часто конусоподібну) частину апекса, де немає листкових зачатків (вище примордіальної зони) апекса. Тобто, під апексом мається на увазі цілий комплекс меристематичних клітин з різними функціями. Апекс – це частина бруньки, ростовий центр пагона. Завдяки діяльності його клітин формуються первинні тканини всіх органів, тобто йому властиві як гістогенні, так і оганогенні процеси.
Таким чином, якщо наш експлант – верхівка пагона 0,25-0,30 мм у довжину, то в пазухах його зачаткових листочків знаходяться додаткові меристематичні тканини, які здатні формувати нові пагони. На другому етапі при підвищеній концентрації цитокінінів поживного середовища, долається ефект апікального домінування в умовах ін вітро і утворюється цілий пучок пагонів першого, другого, третього і т.д. порядку. Цей процес називається проліферацією пагонів ін вітро.
Утворені пагони знову пересаджуються на те саме поживне середовищедля подальшого одержання нових пагонів з його пазухових бруньок. Подібний процес можна продовжувати і одержувати величезні кількості пагонівза відносно короткий період часу.
Метод проліферації пазухових пагонів з апексів або бруньок є найбільш поширеним у практиці мікроклонального розмноження різних видів рослин. При утворені пагонів, поживне середовище повинно містити цитокінінів більше ніж ауксинів. Це «золоте правило пагоноутворення» має винятки для деяких видів рослин. В культурі ін вітро використовують такі цитокініни: кінетин, зеатин, БАП; ауксини: ІОК, ІМК, НОК, 2,4-Д. Співвідношення цитокінін/ауксин підбирається для кожної культури експерементально.
Важливе значення для активації формування пагонів мають умови освітлення і температури. Світло необхідне для морфогенезу і утворення хлорофілу. Використовують, як правило, люменесцентні лампи з інтенсивністю світла 1000-1500 люкс. Оптимальним періодом освітленості для більшості рослин вважають проміжок часу 16 годин, температура
20-25 ºС.
Існує метод одержання пагонів з калусної тканини, який теж відноситься до мікроклонального розмноження, але мало застосовується, тому що може приводити до генетичних змін у новостворених рослин-регенерантів.
4. Після того, як утворилось багато пагонів, їх необхідно укорінити і одержати повноцінні рослини. Основні індуктори коренеутворення (ризогенезу) – ауксини. Для формування коренів пагони відділяють і висаджують на поживне середовище, яке містить ауксинів більше, ніж цитокінінів. Це основне правило коренеутворення ін вітро, яке має свої винятки. Під впливом ауксинів стимулюється поділ клітин паренхіми пагона, що приводить до диференціації кореневих зачатків в його базальній частині. Утворення адвентивних коренів може також спонтанно проходити при перенесенні пагонів на середовище без цитокінінів (особливо у однодольних рослин). Деякі дослідники вважають, що для індукції ризогенезу доцільно спочатку використовувати середовище без фітогормонів. Це пояснюється тим, що ефективність ауксинів при укоріненні зменшується під впливом цитокінінів попереднього етапу розмноження.
Ріст пагонів і їх подальше укорінення приводить до утворення невеличких рослин з 5-6 листочками. Стебло можна розрізати на 5-6 мікроживців, які у сприятливих умовах виростають до нормальних рослин. Процес дозволяє безперервно одержувати великі кількості рослин.
Укоріненість пагонів ін вітро залежить від кількості їх субкультивувань до укорінення: із збільшенням кількості пасажів укоріненість зростає і скорочуються строки появи коренів на пагонах.
Висновок: регенераційна здатність рослин залежить від таких чинників: виду рослини, місцеположення експланта на рослині, сезонності відбору експланта, складу поживного середовища, фізичних факторів (температури, освітленності, вологості), кількості субкультивувань і тривалості безпересадочного культивування.
5. Перенесення рослин з умов ін вітро в умови ін віво – важливий і найбільш трудомісткий заключний етап мікроклонального розмноження. Найкращим для пересадки є період, коли у рослини добре розростаються корені для поглинання мінеральних елементів грунту, а молоді листочки вже здатні до продуктивного фотосинтезу. Рослина стає повністю автотрофною для самостійног існування і її необхідно пересаджувати у природні умови.
Важливим аспектом роботи є вибір грунтового середовища у яке переноситься рослина, здебільшого це суміш торфу з піском, перлітом або вермикулітом. Наприклад для суниць, вишні, смородини використовують суміш – грунт : торф : пісок = 1:1:1. Перед висадкою у грунт корені рослин промивають у розчині фунгіциду (фундазол, каптан, бенолат). Висаджують не дуже загущено, щоб запобігти розвитку грибкових захворювань і сильному видовженню рослин у боротьбі за світло. У період вирощування щотижня рослини обприскують слабким розчином фунгіциду.
Фізіологічні особливості молодих листків (відсутність захисного воскового шару), а також кореневої системи (недостатньо закріплена у грунті, відсутність потужної зони кореневих волосків) не забезпечують нормального водного балансу рослин. Інтенсивна кутикулярна транспірація не компенсується надходженням води за допомогою тиску кореневої системи, що може призвести до прив’ядання і загибелі рослин. Саме тому високий рівень вологості (90-100%) повітря, у якому буде знаходитись рослина після пробірки – найважливіший фактор перших тижнів вирощування. Для цього використовують установки туманоутворення в теплицях, індивідуальне покривання рослин поліетеленовою плівкою або скляним посудом. Як правило, високий рівень вологості підтримують до утворення нового листка (два тижня і більше). Після цього рослини загартовують – готують до відкритого грунту: поступово знімають покриття з рослини і зменшують вологість до природньої. При загартуванні рослин, як останній фазі адаптації, необхідно приділяти увагу оптимальному живленню рослин. Надлишкове підживлення призводить до жирування рослин, вонистають надмірно рослими і погано приживаються після перенесення у відкритий грунт.
Якщо робота проводиться у великих промислових масштабах, то період адаптації рослин бажано спланувати і проводити з березня по вересень, що скоротить до мінімуму витрати. Рослини, одержані у зимовий період, зберігають у холоді (+5 º….+8 º) при освітленні, а весною проводять всі вищеназвані процедури із перенесенням в умовивільного існування.
6. Мікроклональне розмноження рослин – важливий метод масового вегетативного розмноження цінних з харчової, медичної, технічної або естетичної точки зору рослин. На сьогодні у світі широко клонують суницю, картоплю, орхідею, гвоздику, герберу, плодові ягідні, різні дерев’янисті і лікарські рослини. При масовому виробництві рослин важливе значення має генетична стабільність садивного матеріалу після всіх етапів мікророзмноження.
Для позначення рослин, одержаних безстатевим шляхом, у 1903 році К. Вебером був запропонований термін «клон» (від рецького klon – гілка, пагін, паросток) – ряд послідовних поколіньгенетично однорідних організмів, які утворюються в результаті вегетативного розмноження від одного загального предка. Наприклад, одержують лінію безвірусних мериклонів гвоздики – потомство однієї меристеми. Для мікроорганізмів клон – це сукупність нащадків однієї клітини-родоначальниці.
Сучасне уявлення про генетичний статус клонованих рослин, у відповідності із чіткою регенераційною здатністю тотипотентних клітин, передбачає одержання шляхом мітозу рослин, генетично ідентичних клітинам експланту материнської рослини. Практика виявила можливість появи змінених форм. Виділяють три основні категорії змін:
Генетичні, які пов'язані з плоїдністю, а також з хромосомними і генними мутаціями.
Фенотипічні – пов'язані з морфологічними і анотомічними характеристиками рослин.
Онтогенетичні – результат дезорганізації тканинних шарів у химерних рослин, або спонтанного зміщення груп клітин у вигляді ініціації росту адвентивних органів з різних шарів тканини.
Частота виникнення відхилень коливається в залежності від вищеназваної категорії, а також від виду рослини (від 0,03 до 15%). Генетична стабільність рослинного матеріалу ін вітро залежить від моделі розмноження. Найменша вірогідність генетичних змін спостерігається при масовому клонуванні рослин з нормальних меристем материнських рослин. Такі рослини називають «мериклонами» - клонами, які одержані з меристем рослини-донора.
Бажано уникати розмноження рослин через калусну тканину. Тривале переседжування калусу приведе до винекнення у клітинах різних явищ: зміна плоїдності, структурні перебудови хромосом, накопичення генних мутацій, зменшення або втрата морфогенетичного потенціалу. Саме тому регенерація рослин з калусної тканини часто призводить до виникнення організмів зміненої морфології (низькорослі, неправильне жилкування і розташування листків), зниженої життєздатності. Крім того, у системі калус-пагін організована структура пагона може відіграти своєрідну роль «органу-няньки» і впливати на процес органогенезу, стимулюючи меристематизацію калусних клітин, які в свою чергу, можуть давати початок органам із зміненими властивостями. Такий підхід використовується для одержання сомаклональних варіантів рослин.
Аналіз сучасних досліджень дозволяє зробити висновок, що для зниження частоти появи змінених форм у процесі мікророзмноження рослин необхідно:
розмноження проводити на основі проліферації пазухових меристем;
у процесі культивування вилучати всі бруньки калусного походження;
вести розмноження по окремих мериклонах, щоб полегшити контроль за походженням рослин;
регулярно перевіряти агробіологічні характеристики вибіркових екземплярівмериклонів.
Таким чином, навіть один цінний селекційний екземпляр можна зберегти і одержати велику кількість генетично ідентичних йому клоніврослин шляхом мікророзмноження.
7. Переваги мікроклонального розмноження:
Високий коефіцієнт розмноження. Метод клонального мікророзмноження дозволяє одержати до 1 млн. одиниць садивного матеріалу за один рік, що вже зроблено для суниці, гербери, хризантеми та ін. Рослин
Можливість розмноження протягом року незалежно від погодних умов. Наявність лабораторії і теплиці дозволяє це зробити.
Створення «банку» неінфікованого цінного селекційного матеріалу. У холодній кімнаті, при температурі +3º…+5ºС і освітленні, пробірочні рослини можуть зберігатися протягом декількох місяців без пересадки. Холодильник об’ємом 0,28 м3 вміщує до 2 тис. культуральних рослин. У відкритому грунті така ж кількість рослин займає від 5 до 6 га ( для плодових культур в залежності від схеми посадки).
Можливість широкого обміну рослинним матеріалом між регіонами і країнами. Зменшуються об’єми перевезення матеріалу, легше вирішуються карантинні питання.
Одержання безвірусного садивного матеріалу.
Щодо проблем, то для промислового впровадження мікророзмноження необхідно розробляти і вдосконалювати механізацію і автоматизацію основних етапів роботи. На сьогодні більшість процесів виконується вручну.
Вузьким місцем технології мікророзмноження деяких культур залишається пересадка пагонів безпосередньо у нестерильні умови для укорінення і одержання повноцінних рослин. Велике значення при цьому відіграють субстрат, пересадка рослин, умови оточуючого середовища.
В Україні створюються лабораторії мікроклонального розмноження, виходячи з потреб селекції і насінництва. У той же час могли б мати велике значення і комерційні фірми-лабораторії. Для їх організації повинно мати місце прогнозування рентабельності та виробництва виду продукції, риночна ціна, місткість ринку, сезонність постачання.
Лекція 4.
Тема: Біотехнологічні методи одержання безвірусного садивного матеріалу.
Віруси рослин: структура, циркуляція у природі;
Одержання безвірусних рослин ін вітро;
Поєднанння методу верхівочних меристем із термотерапією;
Хіміотерапія при оздоровленні рослин від вірусів
Діагностика рослин на наявність вірусів.
1. Віруси – неклітинні форми життя, які мають власний геном (молекулу ДНК або РНК) і здатні до відтворення лише в живих клітинах хазяїна (рослини, тварини, бактерії), тобто є паразитами на генетичному рівні.
Залежно від виду нуклеїнової кислоти розрізняють ДНК- і РНК-вмісні віруси, які зверху оточені білковою оболонкою – капсидом. Переважна більшість фітовірусів РНК-вмісні.
Віруси позбавлені багатьох ознак, притаманих всім живим істотам: у них відсутні спеціальні пристосування для самостійної циркуляції в природі, вони не можуть репродукуватись в ізольованому вигляді і у них відсутні енергетичні системи.
У 1966 році на Міжнародному мікробіологічному конгресі було вирішено виділити віруси в окреме самостійне царство – Vira. Віруси діляться на 30 таксономічних груп. Поза клітиною-хазяїна вірус перебуває в нереплікованому стані (стані віріону). Діаметр віріонів становить 20-300 нм, що значно менше за найменших прокаріот.
Віруси потрапляють у клітину найчастіше за допомогою комах або в результаті механічного пошкодження тканин рослини. Нуклеїнова кислота вірусу залишає білкову оболонку і стає активною: реплікується і транслюється у вірусні нуклеїнові кислоти і білки, з яких самозбираються нові віруси. Дочірні віруси виходять з клітини-хазяїна, яка гине. У природі їх розповсюдження забезпечується різними способами: через насіння, корені, бульби, цибулини, пилок, через грунт, рештки хворих рослин, воду, комах-перенощиків або зооспор деяких нижчих грибів. Найчастіше саме людина сприяє розповсюдженню вірусів при щепленні, підрізуванні, пасинкуванні або пікіровці рослин.
Відмічається, що найбільше вірусів міститься у нестиглому насінні, а у стиглому вони поступово інактивуються, що пояснюється переходом насіння до стану спокою і накопичення інгібіторів, які пригнічуютьактивність вірусу (Московець С.М. 1971). Ураження відбувається шляхом повільного транспорту вірусів по рослині. Саме факт повільного переміщення вірусів забезпечує їх відсутність у новостворених меристематичних тканинах, які вилучається і використовуються у практиці для мікроклонального розмноження рослин.
Вірусні захворення різко знижують кількість і якість урожаю різних сільськогосподарських рослин. Наприклад, збитки від вірусу жовтої карликовості складають до 40% урожаю ячменю. Вірусна хвороба цукрового буряка (ризоманія) знижує вдвічі урожай і на 5-6% - цукристість солодких коренів.
На сьогодні відомо понад 400 фітовірусів і ще більше вірусних захворювань у різних рослин. Класифікують захворювання на дві великі групи: мозаїки і жовтухи. Основна симптоматика мозаїк – нерівномірне (мозаїчне) забарвлення листків, яке обумовлене порушеннями пластидного апарату клітин; листки часто бувають зморшкуватими. Характерні ознаки жовтух – загальний хлороз листків, які мають жовтуватий відтінок і скручуються. Листя надзвичайно насичується вуглеводами, що приводить до їх підвищеної жорсткості і крихкості.
На практиці основними засобами з вірусними захворюваннями є: виведення стійких та імунних сортівс.г. культур, знищення комах, бур’янів, хворих рослин, регулювання строків посіву та збирання с.г. рослин,фізичні та хімічні засоби обробки насіннєвого та садивного матеріалу, вакцинація та ін.
2. Особливі перспективи для оздоровлення рослинного матеріалу від вірусних захворювань відкриває метод культивування верхівочних меристем ін вітро у поєднанні з методами термо- і хіміотерапії.
Перші дослідники, які працювали з культурою ізольованих тканин і органів рослин, проводили експеременти чисто фізіологічного напрямку. У 1934 році один із засновників цього методу П.Уайт (США) повідомив, що віруси відсутні у кінцівках коренів рослин, уражених вірусом тютюнової мозаїки. Подібні результати були одержані у 1949 році в дослідах М.Корнюа і П.Лімансе. Відсутність вірусів в апексах розміром 0,1 мм складає основу методу одержання оздоровлених (безвірусних) рослин з меристем ін вітро, який запропонували Ж.Морель і К.Мартен. У 1952 році вони одержали безвірусні жоржини від уражених рослин.
Чому віруси відсутні у верхівочних меристемах?
Найбільш сприятливими органами для репродукції вірусів є тканини листків. У вірусів відсутні більш будь-які спеціальні пристосування для самостійного (автономного) пересування по рослині, тому можна передбачити симпластичний або апопластичний шлях їх міграції по сформованих тканинах і органах. Відомо, що обмін речовин і органічний зв’язок між клітинами здійснюється крізь пори, які мають власні, дуже маленькі отвори, крізь які проходять тяжі цитоплазми – плазмодесми. Завдяки плазмодесмам з’єднуються в єдине ціле цитоплазмиусіх живих клітин і утворюється так званий симпласт.
Мікроскопічні дослідження свідчать, що клітини верхівкової меристеми у період активного поділу дрібні, з тонкою целюлозною оболонкою ізодіаметричної форми. Вони щільно зімкнені між собою, не мають міжклітинників.
Отже існують такі спостереження:
Віруси повільно розповсюджуються по рослині;
Клітини меристем швидко діляться;
Серед клітин верхівочних меристем відсутні міжклітинники, недостатньо налагоджена система плазмодесм, що ускладнює апопластний і симпластний шлях переміщення вірусу.
Таким чином, є всі підстави зробити припущення, що анатомо-фізіологічні особливості верхівочних меристематичних клітин роблять неможливим надходження до них вірусів. Вірус не встигає за швидким утворенням перших груп меристематичних клітин у верхівці розміром близько 0,075-0,1 мм. Розмір меристем визначає поріг концентрації вірусних частинок.
Як правило, для ефективного звільнення від вірусів використовують шматочки меристем розміром 0,10-0,15 мм. Проте чим меншаза розміром меристема, тим складніше вона приживається на поживному середовищі і регенерується у цілу рослину. Метод мікроклонального оздоровлення стає більш надійним і ефективним при додатковій термообробці і хіміотерапії рослин.
3. Окремі фізичні і хімічні фактори мають стимулюючу або пригнічуючу дію на віруси, а також на рослини, у яких вони репродукуються. До цих факторів належать температура, різні види випромінювання, постійне магнітне поле, рН середовища, деякі хімічні речовини.
Термотерапія рослин (дія високих температур) – один із ефективних методів профілактики і лікування вірусних захворювань. Піонером застосування термотерапії для лікування рослин вважають П.Кобуса, який у 1889 році використовував гарячу воду проти вірусного захворювання цукрової тростини. Новий етап у розвитку термотерапії почався у 1935 році, коли американець Л.Кункель застосував гаряче повітря для лікування персика від жовтухи, дрібноплодності і розеточні.
Різні методики оздоровлення рослин від вірусів методом термотерапії передбачають інактивацію вірусної інфекції – температурами 30-50ºC, які протягом певного періоду експозиції не завдають шкоди фізіології самої рослини. Цей метод дозволяє брати для оздоровлення більші за розміром меристеми, які набагато краще виживають на поживних середовищах ін вітро (0,3-0,8 мм). Застосування методу особливо ефективне при отриманні безвірусних рослин, які вегетативно розмножуються (картоплі, яблуні, кісточкових, винограду, хмелю, суниці, малини, квітів та ін.)
Широке впровадження в сільськогосподарську практику безвірусного садивного матеріалу картоплі стало можливем саме завдяки поєднанню методів верхівочних меристем і термотерапії. Ця технологія складається з таких етапів:
Термічна обробка матеріалу (бульб або укорінених верхівок)
Виділення верхівочних меристем і регенерація з них рослин
Індукція столоно- і бульбоутворення. Одержання мікробульб картоплі ін вітро.
Детальна технологія та схема одержання безвірусного матеріалу рослин картоплі розглядається на лабораторному занятті. Застосування цього методу дозволяє за 3-4 місяці одержати 2-3 тис. рослин придатних для висадки у грунт, тобто близько 20 тис. мікробульб за 9-10 місяців з однієї рослини. Це має велике значення для елітного насінництва. В Інституті картоплярства УААН цим методом оздоровлено понад 70 сортів картоплі. Одержаний таким чином матеріал розмножують протягом двох років у польових умовах, що дає можливість на третій рік мати достатню кількість елітного насінного матеріалу. На експерементальній базі Ігституту картоплярства одночасно розмножують 30 тис. рослин ін вітро і одержують три вррожаї на рік ( це становить близько 100 тис. мікробульб). Розроблений метод скорочує строки розмноження картоплі з 10 до 3-х років.
4. Метод хіміотерапії базується на обробці рослин речовинами –ігібіторами вірусів або на їх додаванні до поживного середовища ін вітро. Вчені вишукують антивірусні препарати, які виробляються самими рослинами. Позитивні результати одержані в цьому напрямку при використані екстрактів лаванди, ромашки, шавлії та ін. лікарських рослин.
Відома антивірусна дія антибіотиків. Іманін – антибіотик, вилучений із звіробою , сприяє підвищенню стійкості томатів до деяких вірусних захворювань. Комплексне передсадивне застосування тіосечовини і гіберелінів для обробки бульб картоплі сприяє зниженню продукції Х і Y- вірусів у рослин.
Велике значення має рН середовище при самореплікації вірусу. У дослідах на картоплі встановлено, що при значеннях рН близько 10 відбувається дезагрегація вірусів і втрата їх активності.
Метод верхівочних меристем і хіміотерапія успішно доповнюють один одного при використанні панкреотичної РНК-ази, яку додають до поживного середовища. Відсоток здорових рослин-регенерантів на середовищі з РНК-азою у 1,5-2 рази вищий, ніж без неї. Щоб збільшити частку безвірусних меристемних рослин, до поживного середовища часто додають препарат «вірозол» (синтетичний рибоварин).
Існують інші методи одержання безвірусного рослинного матеріалу. Наприклад, метод мікрощеплення, який застосовують при умові, що насіння цитрусових, персика і багатьох плодових культур не передає віруси і залишається здоровим. Рослини, які виросли у пробірці ін вітро з насіння, готують під бінокулярним мікроскопом для мікрощеплення – рослину зрізують, а на кінці залишка стебла рроблять надріз, із яким щеплюють необхідний меристематичний експлант.
5. Найважливіша перевага мікророзмноження – одержання величезної кількості ррослин – може перетворитись у дуже небезпечний недолік, якщо матеріал не буде перевірений на чистосортність і відсутність вірусів.
Незбалансованого живлення або надмірної кількості мінеральних добрив, тощо. Крім того вірус може знаходитись у рослині в прихованому (латентному) стані і зовнішні ознаки не виявляються.
Фізичні і біологічні особливості вірусівпотребують специфічних методів їх діагностики. Сучасний стан досліджень передбачає використання таких методів діагностики на наявність у них вірусів:
Метод електронної мікроскопії;
Індикаторний (біологічний) метод;
Метод імунодіагностики (імуноферментний аналіз).
Більш детально ці питання розглядаються призахисті модуля та підготовки студентами рефератів.
Лекція 5.
Тема: Регенерація рослин шляхом соматичного ембріогенезу
Явище соматичного ембріоїдогенезу та його види;
Загальні принципи одержання калусної тканини;
Технологія вирощування рослин-регенерантів шляхом соматичного ембріоїдогенезу;
Природа сомаклональної мінливості;
Методи ідентифікації сомаклонів та практичне використання і перспективи сомаклональної мінливості.
1. Явище соматичного ембріоїдогенезу характеризується утворенням зарадкоподібних структур (ембріоїдів) нестатевим шляхом із соматичних клітин рослин. Розрізняють прямий і непрямий шляхи соматичного ембріоїдогенезу.
Прямий соматичний ембріоїдогенез – це процес формування вегетативного зародка з тканин експланта без проміжної стадії утворення калусної тканини. Такі зародки в природних умовах розвиваються за рахунок клітин нуцелуса, а інколи й покривів (без будь-якого зв’язку із зародковим мішком) і носять характер додаткової (адвентивної) ембріонії. Такий вид апоміксису (аспорія) зустрічається у мандарина, лимона, апельсина і зумовлює багаттозачатковість (поліембріонію), внаслідок чого утворюється до 20 зародків, але нормально розвивається 1-4, решта – відмирають. Це явище використовується в умовах ін вітро: нуцелус незрілих плодів лимонузвільняють від інтегументів і висаджують халазною частиною на агаризоване поживне середовище. Соматичні зародки утворюються безпосередньо з клітин нуцелуса, що культивуються.
Методи ефективного одержання зарадкоподібних структур шляхом прямого соматичного ембріоїдогенезу знаходяться у стані пошуку.
Непрямий соматичний ембріоїдогенез передбачає утворення ембріоїдів з клітин калусної тканини і складається з таких етапів:
введення експланта в культуру ін вітро;
стимуляція росту калуса і формування презародків;
індукція формування біполярних зародків з презародків.
Індукція соматичних ембріоїдів вже одержана в культурах клітин і тканин близько 140 видів рослин.
2. Калус («калюс»), від лат. calus – мозоль – це особливий тип тканини рослин, яка утворюється на місці поранення і сприяє заживанню. Тканина закриває місце поранення і накопичує поживні речовини, необхідні для регенерації спеціального захисного шару. В калусній тканині можуть утворюватисьзачатки органів, що доповнюють або відновлюють цілісність організму.
Калусні клітини – це дедиференційовані клітини, в які перетворюються спеціалізовані і меристематичні клітини при їх культивуванні на специфічних поживних середовищах ін вітро. Калусна тканина має вигляд аморфної маси тонкостінних паренхимних клітин без визначеної анатомічної структури. Клітини калусу мають велике ядро, високий вміст ДНК і РНК; деякі клітини здатні накопичувати крохмаль і речовини вторинного метаболізму. Колір тканин може бути білим, жовтим, зеленкуватим, червонуватим, що залежить від виду рослини, типу експланта, умов культивування.
Калусні клітини можна невизначено довго вирощувати ін вітро. Для цього необхідні періодичні пересадки (пасажі) невеликої частини утворених клітин на свіже поживне середовище через кожні 3-4 тижні. Найбільш «старим» вважають штам клітин, одержаний з коренеплоду моркви Роже Готре ще у 1938 році і який по сьогоднішній день вирощують у багатьох лабораторіях світу.
Для індукції калусоутворення стерильні експланти (листки, черешки, сегменти стебел, корінців тощо) нарізують і поміщують на поживне середовище з високим значенням співвідношення ауксин/цитокінін: ауксину в середовищі повинно бути у 5-10 разів більше, ніж цитокініну. Наприклад, концентрація 2.4 Д (1-3 мг/л), а БАП (0,1-0,5 мг/л). Експлант трохи вдавлюють в агар для забезпечення надійного контакту. Кінчики коренів легко утворюютть калус при їх горизонтальному розміщенні в агарі, тоді як сегменти листка – при вертикальному. Пробірки, склянки або чашки Петрі витримують у темноті при 25ºC (інколи вирощують на світлі). У перші 4-5 днівспостерігається розтягування клітин і збільшення розмірів експланта, а потім, за рахунок інтенсивних мітотичних ділень, починає утворюватись калусна тканина.
Перехід спеціалізованих клітин у стан неорганізованого росту пов’язаний із синтезом білка в клітинах, збільшенням вмісту РНК, зникненням хлоропластів і хромопластів. При оптимально підібраному середовищі сегменти утворюють калус через 3-8 тижнів.
3. Тотипотентність дедиференційованих калусних клітин обумовлює їх здатність в певних умовах повертатись до ембріонального стану і давати початок рослинам-регенерантам. Таке перетворення відбувається після перенесення невеличких частин калусних тканин на середовище з рівним співвідношенням ауксин/цитокінін, а потім - на середовище без фітогормонів. Відпрацювання методики одержання ембріогенного калусу та індукції ембріоїдів обов’зково передбачає підбір середовища і вибір експланта для конкретного виду або сорту рослин. Крім того, перші пасажі калусних культур мають більш високий морфогенетичний потенціал, який поступово втрачається при тривалому культивуванні.
Електронномікроскопічні спостереження за процесом формування ембріоїдоподібних структур на калусній масі свідчать, що спершу з’являються бугорчасті утворення, подібні до апексів. Як правило, ембріоїди проходять три стадії розвитку: глобулярну, серцевидну і торпедовидну.
Соматичні ембріоїди легко відокремлюються від калусної маси і пересаджуються на інше поживне середовище для одержання з них рослин-регенерантів. Ембріоїди виникають з поверхневих клітин і мають одноклітинне походження. Ембріогенні клітини відрізняються більш щільною цитоплазмою, відносно великим ядром і значною кількістю рибосом. Відмічають також, що перетворення калусної клітини в ембріогенну супроводжується перерозподілом у неї мікротрубочок: хаотичне розміщення мікротрубочок змінюється на їх лінійну орієнтацію паралельно вісі клітини.
Таким чином, походження зарадкоподібних структур серед клітин калусної тканини не пов’язане з мейозом та подвійним заплідненням.
4. Рослини-регенеранти, які одержані шляхом соматичного ембріоїдогенезу, називають сомаклонами (синонім – сомаклональними варіантами). У 1981 році Р.Чалеф запропонував символ R для рослин-регенерантів, одержаних з культур клітин або тканин. Самозапилені нащадки рослини R0 позначаються R1; наступні покоління від самозапилення – R2, R3 і т.д. Це пояснюється необхідністю прийняття універсальної номенклатури для регенерантів і проведення генетичного аналізу їх нащадків. Поява сомаклонів, що мають генетичні відмінності від материнської рослини, обумовленна існуванням сомаклональної мінливості. Це явище було відкрите на початку 80-х років і вважається одним із перспективних напрямків індукції мінливості в культурі ін вітро. Невизначеність генотипів ембріоїдів, з яких утворюються сомаклональні варіанти, обумовлює їх потенційну цінність для поліпшення існуючих сортів рослин.
Природа виникнення сомаклональної мінливості пояснюється двома основними причинами:
генетична гетерогенність соматичних клітин експланта вихідної рослини;
генетична і епігенетична мінливість, що індукується умовами культивування.
Перша причина пов’язана генетичним різноманіттям соматичних клітин у природі (різний рівень плоїдності, химеризм). В клітинах меристемних тканин рослин на різних етапах онтогенезу може відбуватися ендореплікація хромосом і формування тканин з різним рівним плоїдності. Міксоплоїдія і химеризм особливо часто зустрічаються в апоміктичних і вегетативно розмножених рослин. Химерні тканини складаються з генетично неоднорідних клітин, які можуть різнитися ядерними генами, числом хромосом. Генами пластид або мітохондрій.
Існує класифікація типів химерних тканин рослин:
Мозаїчні (гіперхемерні) – генетично різні тканини утворюють мозаїчну структуру.
Секторіальні – різнорідні тканини розташовані окремими великими ділянками.
Периклинальні – танини, розташовані одна над одною.
Мериклинальні – суміш сектроріальних і периклинальних ділянок тканин.
Прикладами химеризму можуть служити характер забарвлення, строкатолистість пеларгонії і хлорофітуму, що обумовлено різним числом шарів меристем точки росту, які приймають участь в утворенні листка.
Химеризм, міксоплоїдія, спонтанні поліплоїди виникають в результаті природних або штучних мутацій, а вегетативне розмноження зберігає набуті зміни в рослинах-регенерантах. Хромосомні перебудови спостерігаються також при зміні умов вирощування (підвищенні або пониженні температури, високі дози мінеральних добрив, засолення, поранення, пестициди та ін.), які приводять до фізіологічних порушень і аномальних мітозів.
Багато клонів винограду, які створені прородою шляхом брунькових мутацій з одного сорта-засновника, відібрані і виділені людиною в окремі високоякісні сорти (наприклад, Шасла біла, Шасла мускатна, Шасла рожева та ін.). У картоплі теж може відбуватися накопичення соматичних мутацій, а індукція ін віво або ін вітро адвентивних пагонів дозволяє одержати нові форми рослин.
Висновок: 1. таким чином генетична гетерогенність соматичних клітин експланту материнської рослиниє однією з причин сомаклональної мінливості і обгрунтовує ймовірність виникнення нових генотипів сомаклонів. Вирішальну роль у регуляції цих процесів в умовах ін вітро відіграють фітогормони поживного середовища.
2. Порушення фітогормонального балансу (ауксин/цитокінін) впливає на тип морфогенезу, змінює мітотичний процес і призводить до змін у хромосомах ядра, виникнення сомаклональних варіантів ін вітро підтверджують фізіологічну гіпотезу мутаційного процесу, яка ще у 1946 році була запропонована М.Лобашевим, а сьогодні символізує сучасний період вивчення природи мутацій. Різні фізичні і хімічні фактори (температура. Випромінювання, дисбаланс регуляторів росту, хімічні агенти, тощо) спочатку викликають фізіологічні зміни в клітинах (порушення мітозу, мейозу, типу морфогенезу), що приводить клітини до передмутаційного стану.
Частота виникнення сомаклональних варіантів не перебільшує 4-6%. З метою збільшення частоти і розширення спектру сомаклональної мінливості використовують мутагени (нітрозометилсечовину, 1,4-біс-діазоацетилбутан та ін.).
5. Актуальність впроводження об’єктивних методів ідентифікації сомаклонів обумовлена широким спектором фенотипових і генетичних змін у рослин-регенерантів багатьох видів рослин. В практиці найбільш поширені такі методи ідентифікації: морфологічний, цитогенетичний, метод білкових маркерів і вивчення фрагментів ДНК.
Морфологічний метод базується на ідентифікації сомаклонів за зовнішніми (морфологічними) ознаками: висота рослини, розмір, форма і колір листків, квітів, плодів, насіння, фертильність, урожайність, стійкість до хвороб та ін.
Цитологічний аналіз передбачає вивчення числа і морфології хромосом сомаклонів, що дозволяє одержати найбільш переконливі і предметні докази поліплоїдності або міксоплоїдності рослин-регенерантів. Для цитогенетичних досліджень використовують тиснуті препарати з молодих корінчиків рослин або пророслого насіння довжиною 1-2 см. При цьому слід врахувати періодичність мітозів і проводити фіксацію матеріалу з певними інтервалами, щоб «вловити» пік мітотичного ділення. Аналізують також калусні тканини в період їх активного поділу, клітини суспензійної культури, протопласти.
Методи білкових маркерів базуються на генетичній обумовленності синтезу білків (ферментів), що дозволяє використовувати їх як специфічні індикатори генотипу.
Електроферетичні варіанти білків та ізоферменти – це маркери, за якими тестують належність рослин до виду, біотипу, сорту; встановлюють ступінь спорідненості рослин; виявляють генетичну гетерогенність морфологічно однорідних популяцій. У деяких випадках з допомогою ізоферментів вдається виявляти деякі мутації на молекулярному рівні.
Аналіз ДНК шляхом рестрикції і гібридизації широко використовують для виявлення і вивчення організації послідовностей ДНК після їх електрофоретичного розділення. Аналіз специфічних нуклеотидних послідовностей, їх консервативних повторів, які гомологічні певному ДНК-зонду, допомагає «ловити» генетичні перебудови у сомаклонів.
За деякими характеристиками (велике число копій на геном, тандемна організація, видоспецифічність спейсерних послідовностей) гени рибосомальної РНК є найбільш зручними маркерамигеномів. Клонування таких послідовностей найчастіше застосовується як ДНК-зонди.
Сомаклональна мінливість - це джерело формоутворення і сортополіпшення важливих сільськогосподарських, декоративних, лікарських і технічних культур. На початку 70-х років нашого століття вперше із культури клітин цукрової тростиниодержані сомаклони, які різнились за морфологічними ознаками, цитологічними характеристиками та ізоферментними спектрами. На сьогодні важко назвати сільськогосподарську культуру, від якої ще не одержані сомаклональні варіанти або не проводяться роботи в цьому напрямку.
Таким чином, перспектива використання сомаклонів оптимістична, тому що вони у ряді випадків переважають вихідний сорт за цінними господарчими ознаками. Наприклад, у культурі солодкої картоплі був знайдений клон із однією новою комерційною ознакою – бульби мале більш темне і стабільне забарвлення. Рослини-регенеранти з цього клону дали початок новому сорту картоплі Скарлет.
Одержання рослин шляхом соматичного ембріоїдогенезу є складним циклічним процесом формування і культивування ембріоїдів на штучних поживних середовищах з наступною адаптацією рослин у грунті. Для захисту біологічного матеріалу і полегшення маніпуляції при роботі з ним вчені констроюють так зване штучне насіння – капсульовані соматичні ембріоїди. Вже розроблені перші методики одержання штучного насіння для моркви, люцерни, селери та інших культур.
Методика складається з таких етапів:
Індукція і одержання соматичних ембріоїдів.
Капсулювання соматичних ембріоїдів у гідрогелеві кульки альгінату кальцію.
Кожна капсула містить 2-3 ембріоїда, а також поживні і біологічно активні речовини. Спроби одержання рослин із капсульованих соматичних ембріоїдів у грунті потребують розробки поверхневих плівок, які утримують воду і забезпечують стерильність всередині капсули. Проводяться дослідження на додавання до капсули симбіотичних мікроорганізмів для азотфіксації. Найбільш перспективні такі напрямки вивчення сомаклональної мінливості: спрямована селекція сомаклонів, індукований мутагенез ін вітро, трансформація і перенос окремих генів.
Лекція 6.
Тема: Одержання та культивування протопластів рослин.
Виділення і культивування протопластів;
Гібридизація соматичних клітин шляхом злиття ізольованих протопластів (соматична гібридизація рослин);
Методи злиття протопластів;
Аналіз соматичних гібридів
1. Структуру рослинної клітини можна умовно розділити і розглядати як дві важливі складові частинивміст і оболонка. Перша – протопласт включає ядро і цитоплазму, в якій знаходяться органели. Друга – оболонка (клітинна стінка), хімічну основу якої визначають полісахариди (целюлоза, геміцелюлоза і пектинові речовини).
Протопласти (від грецьк. protos – перший, plastos – утворений, виліплений) – клітини, які позбавлені своєї клітинної оболонки. Їх можна характеризувати як відокремлені мембраною ядро і цитоплазматичні утворення з власною структурною цілісністю і здатністю здійснювати активний метаболізм, біосинтез і трансформацію енергії.
В експерементальній цитології і фізіології рослин протопласт виявляється як морфологічно відокремлене утворення при плазмолізі: протопласт у гіпертонічному розчині віддає воду, зменшується в об’ємі і відокремлюється від клітинних стінок (згортається у клубок). Такого роду методи ізоляції протопластів називають механічними. Наприклад, якщо смужку епідермісу цибулі витримати у 0,5М розчині сахарози до явного плазмолізу, а потім розрізати його тонким лезом, то можна спостерігати вихід протопластів у середовище. Механічний метод виділення протопластів має незручності і недоліки, серед яких необхідно відмітити такі:
Виділяється невелика кількість протопластів;
Використовуються тільки ті тканини, в яких відбувається екстенсивний плазмоліз;
Важко одержати протопласти з меристемних тканин;
Протопласти зазнають сильного осмотичного шоку;
Меттод довготривалий і трудомісткий.
Інший спосіб був запропонований англійським вченим Е.Кокінгом, який у 1969 році за допомогою спеціальних ферментів руйнував целюлозно-пектинову оболонку і одержував «голі» клітини – протопласти. Після вдалих робіт І. Такебе (1971) ензиматичний метод знайшов широке застосування при виділенні протопластів у багатьох лабораторіях світу. Переваги методу переконливі:
Одночасно можна виділяти і працювати з великою кількістюпротопластів (106 – 109);
Протопласти не зазнають сильного осматичного ущільнення, вони більш інтактні і непошкоджені;
Метод відносно швидкий.
Для ізолювання протопластів використовують суміші різних ферментів, дія яких спрямована на гідролітичне розщеплення полісахаридних компонентів клітинних стінок. Ці ферменти мають відповідні назви – целюлази, геміцелюлази, пектинази.
Успішне виділення протопластів залежить від багатьох факторів: типу тканини (листок, корінь, калус, пилкові зерна, пелюстки тощо), виду і фізіологічного станурослини, складу фементів і їх концентрації, часу обробки тканин ферментами, вибору осматичного стабілізатора (глюкоза, сахароза, маніт, сорбіт), рН середовища і температури. Середовище повинно бути кислим (рН 5,4-6,2), а головне – трохи гіпертонічним (0,3-0,8 моль/л), щоб протопласти знаходились у невеликому стані плазмолізу (при таких умовах гальмується метаболізм і не відбувається швидка регенерація клітинної стінки). Крім того, таке середовище стримує тургор і не дозволяє клітинам лопатись. Використовують молоді листки рослин, ттому що в їх міжклітинній речовині переважно міститься пектин.
2. Протопласти – «голі» клітини – можуть зливатися і утворювати гібридний протопласт, який поступово «одягається» (будує свою клітинну стінку), ділиться і спроможний стати гібридною рослиною шляхом ембріоїдогенезу або органогенезу.
Соматична гібридизація (синонім – парасексуальна гібридизація) – гібридизація соматичних клітин шляхом злиття їх ізольованих протопластів (англ. Fusion of protoplasts).
Застосування методології злиття протопластів дозволяє соматично схрещувати філогенетично віддалені види рослин, а також створювати додаткові резерви спадкової мінливості. У нинішній час селекціонер мало зацікавлений у тому, щоб зробити дикі форми культурними. Для нього набагато важливіше передати від «дикуна» до культурної форми окремі гени, які можуть надати стійкості культурним рослинам до біотичних і абіотичних факторів довкілля.
Р.Г. Бутенко і А.А. Кучко (1977) одержали фертильний соматичний гібрид між диким і культурним видами Solanum chacoence та S. Tuberosum, який характеризується стійкістю до вірусу У. Цей гібрид застосовується у подальших селекційних схрещуваннях.
Для декоративного садівництва викликають інтерес соматичні гібриди Дж. Пауера між видами Petunia parodi і P. parvifolia, які статевим шляхом не схрещуються. Цим способом до селекції залучено нову ознаку «розгалужений пагін, що стелеться». Х. Шенх одержав соматичний гібрид між капустою і турнепсом (перко). Аналогічних прикладів можна навести дуже багато.
Методами парасексуальної гібридизації створені міжродові та міжтрибні гібриди. Особливий науковий інтерес викликають міжцарственні клітинні гібриди, які одержують шляхом злиття протопластів рослиннтх і тваринних клітин; наприклад , протопластів еретроцитівщура і дріжджових клітин, протопластів моркви і людини та ін. Одержати рослинно-тваринні «монстри» не вдається тому, що еволюційно закріплений консерватизм передачі спадкової інформації усуває негомологічні хромосоми у метафазі першого мейозу і подальше ділення неможливе.
Соматичні цибриди. Спадкова інформація рослинної кліттини зберігається в геномі (хромосомах ядра) і цитоплазмоні (ДНК хлоропластів і мітохондрій). Існують методи вилучення або інактивації ядра, що приводить до одержання протопластів без ядра – цитопластів. При злитті протопласті і цитопласта утворюється соматичний цибрид. Таким чином, генетична основа соматичного цибрида може складатися з елементів двох цитоплазмонів і одного із ядер батьківських протопластів. Саме тому метод соматичної гібридизації дозволяє одержувати такі форми рослин, що відрізняються сукупністю генів від статевих гібридів, а також створювати нові унікальні комбінації генів (цитоплазматичні гетерозиготи).
Наприклад, при злиттті протопластів мезофілу томатів і картоплі були одержані соматичні гібриди, які диференціювали за білковими маркерами на два типи: «помати» (з пластидами від картоплі) і «топати» (з пластидами від томатів).
Спеціалісти вважають, що у гібридів, які об’єднують елементи цитоплазми обох батьків і мають ядро одного з них, перспективне майбутнє. При злитті цитоплазмонів можуть відбуватися рекомбінації мітохондріальних або хлоропластних ДНК, які приводять до створення нових генотипів.
Після одержання соматичних гібридів або цибридів необхідно проводити біохімічний і цитологічний аналіз батьківських форм і гібридів першого покоління за спеціальними методиками (питання 4.).
3. Методи злиття протопластів.
Протопласти несуть негативний поверхневий заряд, що призводить до їх взаємного відштовхування. Тому для об’єднання проттопластів необхідно це відштовхування подолати або усунути.
Розроблені і практично виколристовуються два основних методи злиття – хімічний і електричний.
Хімічний метод передбачає обробку протопластів поліетеленгліколем (ПЕГ), а потім – буферним розчином з високим вмістом Са2+, рН 10,5. В інституті клітинної біології та генетичної інженерії НАН України методику індукції злиття протопластів так і називають: «ПЕГ – високий рН – високий Са2+ (Момот В.П., Кучук М.В., Пастернак Т.П., 1988). Додавання ПЕГ до батьківських протопластів приводить до їх злипання в результаті дегідратації.
Поглинання вільної води призводить до утворення отворів по всій поверхні плазмалеми і відбувається перетікання внутрішньоклітинного матеріалу.
На початку 80-х років був розроблений метод електрозлиття протопластів (Ватс Д, Кинг Дж., 1984; Хан-Хагердал В., Борнман Х., 1986). Протопласти суспензують між двома електродами. При дії змінного струму проходить діелектрофорез і протопласти шикуються у ряд таким чином, що приєднуються своїми полярними поверхнями один до одного. Потім накладають сильний імпульс постійного струму (600в/см 10-20 мкс), який обумовлює утворення отворівв ущільнених мембранах. У місцях контактів протопластів утворюються містки, по яких відбувається перетікання цитоплазм у вигляді міжпротопластного обміну. Успіх культивування продуктів злиття протопластів залежить від їх здатності синьезувати нову оболонку, ділитися і давати початок регенерантам.
Природа злитття протопластів остаточно не з’ясована і активно вивчається.
4. Для підтвердження гібридної природи отриманих у результаті злиття клітинних агрегетівррослин-регенерантів необхідне проведення цитологічного, біохімічного і молекулярногенетичного аналізів.
Цитологічний аналіз.
Гібриди часто аналізують методами, тобто досліджують кількість і морфологію хромосом. Цей метод достовірний, особливо для міжтрибних, міжродинних гібридів, для батьків яких властива докорінна морфологічна відмінність хрромосом. Причини генетичної нестабільності соматичних гібридів цілком не з’ясовані. З одного боку вони можуть бути наслідком філогенетичної віддаленості вихідних видів, з іншого – вцей процес можуть бути включені й інші чинники. Тривалість індукції і пасажування калюсу соматичних гібридів, склад живильних середовищ також впливає на цитологічну нестабільність.
Біохімічний аналіз.
Біохімічні методи широко застосовують для агналізу міжвидових гібридів. Вивчають їх за допомогою електрофорезу в поліакриламідному гелі з наступним фарбуванням білків із визначеною ферментативною активністю – це є найпростішим і найефективнішим засобом біохімічного аналізу парасексуальних гібридів. Одним із найдостовірніших та найдоступніших методів біохімічного дослідження соматичних гібридів є аналіз РубісКО. Це найпоширеніший і найбільш вивчений білок рослин, що є ключовим ферментом циклу Кальвіна і складається з великих і малих субодиниць. Поліпептиди великих субодиниць кодуються хлоропластною ДНК, малих – ядерною ДНК. Вивчення поліпептидного складу субодиниць за допомогою ізоелектрофокусування в поліакриламідному гелі дає змогу виявити розходження в будові поліпептидних білків різних видів рослин.
Молекулярно-генетичний аналіз.
Використання рестрикційного аналізу ДНК для дослідження хлоропластів і мітохондрій соматичних гібридів має переваги – можливість виявлення перебудови ДНК, цілого геному. На відміну від ДНК пластид аналіз ДНК мітохондрій за соматичної гібридизації показує, що у вищих рослин можлива рекомбінація між геномами мітохондрій.
Лекція 7.
Тема: Мутагенез та клітинна селекція.
Процес одержання мутантних форм шляхом селекції на клітинному рівні;
Вихідні матеріали для клітинної селекції;
Мутагенез та відбір клітин за ознаками;
Науково-практичне значення робіт з клітинної селекції;
Кріозбереження рослинного матеріалу.
1. Селекція (від лат. selectio – вибір, відбір) – наука, яка досліджує і застосовує на практиці принципи і методи поліпшення існуючих та виведення нових сртів і гібридних форм рослин, необхідних для задоволення харчових, лікарських, естетичних та інших потреб людини.
Успіх у селекції рослин визначається наявністю стійкої генетичної мінливості у первинній або вихідній популяції. Якщо розглядати кожну клітину суспензійної популяції як індивідуальний організм, то перехід на клітинний рівень дозволяє селекціонеру мати справу з величезною кількістю особин. Дослідник в одному експеременті в умовах ін вітро використовує мільйони клітин (у порівнянні з сотнями-тисячами рослин при роботі селекціонера у полі).
Клітинна селекція – сукупність методів відбору клітинних ліній з новими успадкованими знаками в умовах ін вітро.
Щоб одержати клітинний штам, стійкий до певного фактора, суспензію клітин піддають мутагенній дії, а потім висівають на середовище з цим фактором, але у концентраціях, які пригнічують ріст нормальних клітин (клітин дикого типу). Можливо, що після мутагенезу на мільйон клітин зустрінеться одна з генетичними відхиленнями, які дозволять їй вижити у жорстких селективних умовах. Клітина формує калус, який, у свою чергу, дає початок рослині-регенеранту.
Таким чином, користуючись способом селекції мікроорганізмів, в умовах ін вітро на селективних середовищахвідбирають клітини з мутантними генотипами, а потім одержують з них рослини, що стійкі до конкретного селективного фактора. Такий шлях селекції дозволяє відносно швидко одержувати нові форми рослин.
Оснвні етапи одержання мутантних форм шляхом селекції на клітинному рівні:
Відбір об’єкту для мутагенезу – калусні, суспензійні культури, ізольовані протопласти;
Обробка об’єкту мутагеном (фізичні фактори – температура, опромінювання, хімічні речовини та ін.;
Інкубація клітин на рідкому поживному середовищі у неселективних умовах;
Перенесення суспензії у селектиивні умови (засолення, токсини, гербіциди, понижені або високі температури, метали та ін.);
Виділення життєздатних колоній, які вижили в жорстких селективних умовах;
Відбір змінених, стійких до селективного фактора клонів;
Індукція органогенезу або ембріоїдогенезу;
Одержання змінених рослин-регенерантів, які відрізняються в порівняні з материнськими рослинами;
Висадка рослин у грунт, вивчення генетичної природи стійкості, тестування на стійкість.
2. Об’єктом для мутагенезу і селекції можуть бути калусні, суспензійні культури або ізольовані протопласти. Вибір об’єкту залежить від наявності розробленої технології стосовно до конкретної культури, а також від кінцевої мети дослідження.
Калусна тканина – доступний матеріал, який відносно легко одержують у лабораторних умовах. Використовують свіжовиділену калусну тканину, що не втратила регенераційної здатності (тема: «регенерація рослин шляхом соматичного ембріоїдогенезу»). Відбір мутантів за допомогою калусних тканин часто використовують при селекції ліній, (стійких до фітозахворювань) і стресових факторів (Левенко Б.О., 1991).
Клітинна суспензія – це поодинокі клітини або клітинні агрегати, які вирощують на рідкому поживному середовищі в умовах постійної аерації. Аерація об’єктів забезпечується такими способами:
Культурою клітин, які занурені у рідке поживне на качалках ротаційного або шейкерного типу (накопичувальне культивування);
Вирощуванням шматків калусуна містках-підтримках з фільтрувального паперу.
Більшість суспензійних культур одержують шляхом перенесення шматочків пухкої калусної тканини на рідке поживне середовище, яке постійно перемішується. Швидкість обертання кругової качалки повинна бути у межах 30-150 об/хв з амплітудою обертання 2-4 см. Через певний проміжок часу процес зупиняють; системі дають відстоятись і піпеткою (шприцем) відбираютьверхній шар суспензійної культури клітин. Для вилучення великих за розміром агрегатів клітин існує спосіб фільтрування культури крізь найлонове сито. В процесі субкультивування клітини проходять наступні послідовні фази:
– латентну або лаг-фазу;
– експотенціальну (логарифмічну) фазу;
– лінійну фазу;
– стаціонарну фазу;
– фазу загибелі клітини.
Накопичувальні суспензії, як правило, культивують до стаціонарної фази росту, що у більшості випадків складає тривалість пасажу 21-28 днів. Після нанесеня суспензії на сітку Горяєва або Фукса-Розенталя клітини підраховують.
Широкі можливості для клітинної селекції відкривають технології ізольованих протопластів (тема: «одержання та культивування протопластів»). У великих однорідних популяціях гаплоїдних або диплоїдних протопластів проводять кількісні дослідження мутагенезу соматичних клітин, аналізують експресію індукованих фенотипових змін на клітинному і організменому рівні.
Основними вимогами, що ставляться до модельних об’єктів у клітинній селекції є:
швидкий ріст у культурі ін вітро,
збереження регенераційної здатності,
невелика кількість хромосом,
наявність високоефективної методики виділення і культивування протопластів, клітин,
існування справжніх гаплоїдів,
короткий життєвий цикл рослин (Сидоров В.А.,1990).
3. Спадкова передача ознак від батьківських клітин своїм нащадкам – процес консервативний, але ця консервативність не є абсолютною. У деяких випадках мають місце помилки, в результаті чого структура хромосом або послідовність нуклеотидів ДНК дочірних клітин стає іншою. Ці раптові зміни спадкового матеріалу називають мутаціями. Клітини або організми, які є носіями змінених генів і відрізняються від вихідного (дикого) типу, називають мутантами. Мутації можуть стосуватись як ядерних генів, так і їх цитоплазматичних структур, що несуть у собі ДНК (мітохондрії, хлоропласти).
Розрізняють такі типи мутацій:
Генні, або точкові, мутації – спадкові зміни гена, які найчастіше відбуваються в одному з двох алельних локусів пари гомологічних хромосом. Мутантні гени є переважно рецесивними.
Хромосомні мутації – одна або декілька хромосом виявляють структурні зміни, що викликано розривами та перебудовами хромосомного матеріалу.
Геномні мутації обумовлені змінами числа хромосом в хромосомних наборах (геномах) або ж змінамикількості хромосомних наборів у мутованих клітинах. Геномні мутації, як правило, викликають явище поліплоїдії (кратне збільшення числа хромосом).
Плазмонні мутації виникають внаслідок можливих мутацій позахромосомних спадкових структур клітини, окрім локалізованих у пластидах.
Пластидні мутації характеризуються змінами пластид хлорофільних зерен (білоплямистість, строкатолистість у зелених рослин)
Мутагенез – процес виникнення мутацій під впливом ріхних фізичних і хімічних мутагенних факторів.
Серед хімічних супермутагенів ін вітро використовують два класи речовин: клас НАК (нітрозоалкілсечовин) і ДАК (діазокетонів). Найбільш поширені супермутагени:
етилметансульфонат (ЕМС);
диметилсульфонат (ДМС);
метилметансульфонат (ММС);
етиленмін (ЕМ) та ін.
Розчини мутагенів готують, як правило, на середовищі для культивування і додають до суспензії клітин. Через певний час клітини промивають середовищем від мутагенів і ресуспензують у свіжому середовищі. Після 4-7 днів інкубаційного росту клітини знову промивають і ресуспензують до необхідної щільності. Спектр дії хімічних супермутагенів дуже широкий – від генних мутацій до різноманітних хромосомних перебудов.
Поряд з хімічними мутагенами в експерементах з культурами клітин широко використовують іонізуюче (рентгенівське, гама-промені) і ультрафіолетове випромінювання. Найбільш широкий спектр мутацій спостерігається при використанні іонізуючого випромінювання. При рентгенівському опроміненні клітин вченими одержані пігментдефектні лінії дурману і петунії, хлорстійкі лінії тютюну.
Загальна методологія відбору мутантів ін вітро складається з таких етапів:
Селекція необхідних фенотипових варіантів на клітинному рівні.
Регенерація з клітин рослин.
Експресія мутаційних змін на рівні цілих рослин-регенерантів.
Вибір часу для проведення селекції залежить від кількості клітин у вихідних колоніях, типу мутацій, стадії клітинного циклу, числа поділів мутантних клітин до початку селекції.
Способи відбору необхідних фенотипових варіантів на клітинному рівні можна класифікувати так:
Пряма (позитивна) селекція, при якій виживає лише певний мутантний тип клітин;
Непряма (негативна) селекція. Грунтується на вибірковій загибелі клітин дикого типу та виживанні метаболічно неактивних клітин, які потребують додаткової ідентифікації у них мутаційних змін;
Візуальна селекція та неселективний відбір, коли ідентифікація лінії серед всієї популяції клітин відбувається візуально або за допомогою біохімічних методів;
Тотальна селекція, яка передбачає індивідуальне тестування всіх клітинних клонів.
Пряма селекція – є найбільш поширений метод виділення мутантів стійких до антибіотиків, гербіцидів, токсинів та ін. антиметаболітів.
4. Клітинна селекція – процес зростаючого домінування в культурі клітин певного типу, який цікавить дослідника. Це відкриває широкі можливості клітинної селекції при вирішенні багатьох теоретичних і практичних питань біологічної і сільськогосподарської науки. Наприклад, якщо шляхом мутагенезу і селекції відібрати клітину, стійку до засолення або гербіциду, то і одержана з неї рослина-регенерант також повина бути стійка до цього фактора.
За допомогою методів клітинної селекції вже одержано багато біологічних об’єктів, серед яких:
Картопля, яка стійка до кільцевої гнилі;
Стійкі до механічного збирання томати;
Цукрова тростина із стійкістю до склероспоріозу, борошнистої роси та підвищеним вмістом цукру;
Калус пшениці, який витримує температуру - 40ºC (перспективний напрямок робіт з зимостійкості злакових).
На сьогодні більшість експерементів проводяться на модельних об’єктах. Проте саме їх використання дозволяє розрробити тонкі методи селекції різних різних мутантів, визначити можливості клітинної селекції при створенні нових біотехнологій у таких напрямках:
одержання та вивчення хлорофілдефектних мутантів;
маркірування сільськогосподарських культур і використання їх у подальших генетично-селекційних дослідженнях;
одержання більш збалансованого амінокислотного складу білка зернових культур;
регуляція метаболічних шляхів РНК і ДНК в клітинах;
використання спецефічних інгібіторів процесів фотодихання і біосинтезу поліамінів як селективних факторів при клітинній селекції;
селекція мутантів, стійких до дії гербіцидів, засолення, посухи, радіації, екстремальних температур і патотоксинів;
Підводячи деякі підсумки, можна стверджувати, що одержання нових генотипів шляхом клітинної селекції – реальність, яка потребує подальшого вивчення і більш широкого застосування на практиці.
5. Кріобіологія (від грецьк. kryos – холод, мороз, лід) – розділ біології, який вивчає дію на живі системи низьких та наднизьких температур (від 0 ºC до абсолютного нуля). Кріостійкість клітин, тканин і органів рослин, їх природний та штучний захист від кріопошкоджень стає актуальною проблемою з теоретичної і практичної точки зору. Це пов’язано з необхідністю збереження генофонду елітних, рідкісних і зникаючих рослин, а також клітинних штамів-продуцентів, які складають основу біотехнологічних виробництв лікарських, харчових та біологічно активних речовин.
Термін «кріозбереження» (анг. cryopreservation) застосовується для позначення складного багатоетапного процесу, метою якого є обмежено тривале зберігання життєздатних клітин, меристем або органів рослин в стані холодового анабіозу. Єдиним надійним засобом для вирішення цієї проблеми є глибокий холод (нижче - 140ºС), який забезпечує використання рідкого азоту (- 196 ºС) або його парів (- 150ºС). Позитивність глибокого заморожування полягає в тому, що при температурах, близьких до - 196 ºС, фактично повністю зупиняються процеси метаболізму клітин і тим самим зберігається їх генетична і епігенетична характеристика. Це дозволяє зберігати і потенційно використати навіть через сотні роківнеобхідний генотип, який буде знаходитись у кріогенному банку рослин.
Кріозбереження як система єдиного екстремального процесу (заморожування –зберігання – розморожування) складається з таких етапів:
підготовка об’єкту,
додавання кріопротектора,
заморожування в певному режимі,
зберігання в рідкому азоті,
розморожування,
видалення кріопротекторів (відмивка),
рекультивація (для клітин),
регенерація цілих рослин.
Найбільш відповідальним етапом кріозбереження вважається процедура заморожування. Цей процес відносно простий для об’єктів здуже низьким вмістом води (пилок, насіння), які можна безпосередньо занурювати у рідкий азот і проводити розморожування на повітрі у звичайних умовах. Труднощі виникають при заморожуванні тканин або органів рослин великого розміру. Збереження життєздатності об’єктів за рахунок зниження фази рідкої води забезпечується програмним заморожуванням у присутності кріопротекторів з постійною малою швидкістю (0,3 – 1 град/хв) до - 40 ºС. Присутність кріопротекторів дозволяє вільній воді вийти з клітин і кристалізуватись вже на поверхні у розчині.
Кріопротектори – це речовини, які зв’язують вільну воду як в міжклітинниках, так і в клітинах; ускладнюють її кристалізацію за рахунок утворення з нею водневих зв’язків; зменшують ущільнення протопластів клітин при заморожуванні. Використовують різноманітні речовини-кріопротектори: диметилсульфоксид(ДМСО), поліетиленгліколь(ПЕГ), поліетиленоксид, етеленгліколь, гліцерин, сахарозу, сорбіт, маніт, лактозу та ін.
На сьогодні успішне кріозбереження клітинних і тканинних культур ін вітро здійснено майже для 70 видів рослин, половина з яких – меристеми. Вченими вже одержані рослини-регенеранти картоплі, моркви, гороху, суниць, томатів з меристем, які зберігались при наднизьких температурах. Активно проводяться дослідження з кріозбереження клітинних штамів-продуцентів економічно важливих речовин. Таким чином, захист і збереження рослинних ресурсів являє собою гідну задачу для біотехнології.
Лекція 8.
Тема: Генна іеженерія рослин.
Історія становлення та сутність генної інженерії;
Інструменти генної інженерії та їх використання;
Методи переносу чужорідних генів в рослини;
Проблеми, досягнення і перспективи генної інженерії.
1. Генну інженерію можна визначити як систему штучного конструювання рекомбінантних (гібридних) ДНК і введення їх в живий організм з метою одержання спадкових змін. Іншими словами, сутність генної інженерії складає цілеспрямоване переміщення окремих генів з одного генетичного оточення в інше. У результаті спадкова інформація організму змінюється, йому надаються нові генетичні і, відповідно, біохімічні та фізіологічні властивості, корисні для людини. Одержаний в результаті таких маніпуляцій організм позначається як трансгенний.
У науковій літературі використовуються два терміни — генна інженерія і генетична інженерія, які вважаються синонімами. історія становлення цього напрямку пов'язана із кінцем 60-х - початком 70-х років, коли Дж.Беквіс з колегами виділили "чистий" ген - галактозидази Е.соli, а в лабораторії Г.Корани був синтезований хімічним шляхом ген аланінової т-РНК дріжджів. У дослідників з'явилась можливість маніпуляції з генами (введення їх або замша на інші).
Формально народженням генної інженерії як самостійної дисципліни можна вважати грудень 1972 р., коли Поль Берг із співробітниками (США, Стендфорський університет) сповістили про створення першої рекомбінантної молекули ДНК. Ця молекула складалася з фрагментів ДНК вірусу SV-40, бактеріофагу А, і генів E.соli. Перші експерименти по перенесенню чужорідних генів у рослину датуються 1980 роком.
Деякі дослідники висловлюють побоювання щодо використання генної інженерії. Засновник молекулярної генетики Дж.Уотсон виступив із проханням заборонити роботи з генної інженерії, аналогічно, як у свій час
Роберт Оппенгеймер, батько атомної бомби, виступав проти створення цієї страшної зброї. У 1974 році було накладено добровільний мораторій на деякі види досліджень з генної інженерії, проте у 1975 році на міжнародній Асилморській конференції у США мораторій було відмінено, бо очікувані прибутки від генної інженерії перевищують можливу шкоду.
Чим викликані побоювання дослідників?
Генна інженерія має можливість долати генетичні бар'єри між організмами, які до цього не вступали у генетичний контакт. Людина починає створювати нові генетичні системи, властивості яких неможливо передбачити. Ступінь ризику обумовлений тим, що основний об'єкт досліджень - мікроорганізми, які мають широку природну розповсюдженість, — швидко розмножуються і легко обмінюються генетичною інформацією. Гіпотетично існує можливість синтезувати форми з новими генетичними якостями, що раніше не зустрічались в природі і проти яких людина виявиться безсилою, Наприклад, введення у кишкову паличку Е.соli генів стійкості до антибіотиків або утворення токсинів. Жах-ливий прогноз наукових фантастів відносно можливості введення генів ботулінічної палички у плазміди Е.соli, що призведе до створення страшної бактеріологічної зброї. Неприємні думки викликають роботи з включенням у плазміди генів злоякісного переродження клітин (онкогени).
Навіть проста недбайливість експериментатора або його некомпетентність можуть привести до непередбачених наслідків. Крім того, не виключена можливість спрямованої селекції шкідливих для людства генних рекомбінацій (своєрідної біологічної ядерної зброї). Виробництво бактеріологічної зброї, на відміну від атомної або водневої бомби, не потребує великих капіталовкладень, енергетичних витрат і може бути замасковане будь-якою фірмою, що виготовляє вакцини або гормони.
Деякі вчені розглядають генну інженерію більш оптимістично, тому що вважають неможливим виникнення глобальних потрясінь (клітини і віруси еволюційно існують вже мільярди років разом). Кишечник людини вже багато тисячоліть є чудовим хемостатом з ідеальними умовами співіснування мікроорганізмів з різними фрагментами ДНК. Дискусія вже закінчилась, але науку неможливо зупинити. Генна інженерія являє собою центральний шлях розвитку теоретичних і практичних проблем генетики і селекції мікроорганізмів, рослин і тварин. Не заперечуючи присутності еле-ментів ризику, вчені вимушені визнати необхідність генетичного конструювання організмів при дотриманні суворих заходів обережності.
2. Для того, щоб штучним шляхом надати будь-якому організму нові властивості, необхідно ввести у нього новий ген або трупу генів, які будуть там працювати синтезувати свої білки.
Гени одержують одним із трьох способів: безпосереднім виділенням з природного матеріалу, шляхом хімічного синтезу або копіюванням інформаційних РНК для одержання комплементарних ДНК (ензиматичний метод). Ген, тобто певну ділянку ДНК, "впізнають" і "вирізають" з цілої молекули ДНК за допомогою спеціальних рестрикційних ендонуклеаз (рестриктаз). У нинішній час відомо понад 500 рестриктаз, що ферментативно розривають дволанцюгову ДНК лише у тому унікальному сайті (місці) нуклеотидної послідовності, який специфічний тільки для конкретної рестриктази.
Наприклад, якщо сайт впізнавання - ААТ (і комплементарний йому - ТТА), то такий розрив відбувається у ланцюгах ДНК з обох протилежних кінців цих послідовностей.
Два розриви в однакових позиціях комплементарних ланцюгів утворюють на кінцях фрагменту так звані "липкі" кінці. Взаємно комплементарні одноланцюгові фрагменти таких кінців можуть знову з'єднуватись і відновлювати двоспіральну структуру за рахунок міжланцюгових водневих зв'язків. Процес з'єднання в єдину структуру фрагментів, що розрізані рестриктазами, здійснюють інші ферменти – лігази.
Таким чином, якщо користуватись генноінженерним жаргоном, то молекулярними "ножицями" -рестриктазами - вирізають гени, а "голками " - лігазами -їх зшивають (з'єднують). Ці ферменти не мають видової специфічності і тому фрагменти ДНК різного походження можна об'єднувати у будь-які послідовності. Рестриктази однаково "ріжуть" ДНК бактерій, вірусів, рослин, тварин або людини.
Головне правило - рестриктаза повинна впізнати специфічну для неї ділянку в молекулі ДНК. В природі рестрикційні ендонуклеази захищають клітину від сторонньої дії ДНК, яку вони відрізняють від своєї і розщеплюють на фрагменти, тобто обмежують дію чужорідної генетичної інформації (анг. restriction - обмежуdати, закінчувати).
Як виділеному гену потрапити в клітину і почати гам працювати?
Для цього використовують вектори - плазміди або віруси (бактеріофаги), які здатні переносити в клітину вмонтований в їх ДНК чужий ген, забезпечуючи там його реплікацію та синтез білкових продуктів. Вектор - це молекулярний прилад для доставки чужорідних генів у різні організми; фактично - це "віз" для генів.
Більшість експериментів з генетичної інженерії проводяться на ДНК плазмід бактерій, тому розглянемо це питання більш детально.
-Плазміди - це невеликі кільцеві молекули ДНК, які присутні у більшості бактерій разом із хромосомною ДНК. Вони здатні до автономної реплікації, тобто несуть гени, що відтворюють власну ДНК, а також мають гени стійкості до антибіотиків, гени патогенності (здатності бактерій викликати захворювання людей, тварин і рослин). Не випадково, що про плазміди першими голосно заговорили медики, коли випадково у 1959 році була доведена неефективність деяких антибіотиків при лікуванні інфекційних та інших захворювань. Це явище обумовлюється присутністю генів стійкості до антибіотиків в плазмідах патогенних бактерій. ДНК кільцевих плазмід легко переходить від однієї бактерії до іншої, що робить їх генетично несприятливими до ліків. Наприклад, деякі плазміди можуть виробляти фермент пеніцилазу, яка руйнує пеніцилін і патогенні бактерії залишаються життєздатними. Тому кращим засобом лікування можна вважати два шляхи: без антибіотиків (по можливості) або із використанням все нових антибіотичних речовин, проти яких у патогенної мікрофлори немає генів стійкості.
Сучасні дослідники працюють із штучними плазмідами рВК 322, 324, 325 та ін., які мають невеликі розміри (3-9 тис. нуклеотидних пар). Вони несуть два-три маркерних гени стійкості до антибіотиків, в яких обов'язково міститься сайт рестрикції до певної рестриктази.
3. Пошуки шляхів введення чужорідних генів в клітини вищих рослин, що інтенсивно проводяться вченими останні 20-25 років, привели до певних теоретичних узагальнень і конкретних практичних результатів.
Сучасні методи переносу нових генів в рослину можна згрупувати таким чином: першу групу експериментальних підходів складають методи введення генів за допомогою природних векторів ( на основі Ті-плазмід Agrobacterium tumifaciens, Rі-плазмід А.rhizogenes, транспозованих елементів, вірусів і віроїдів), другу - прямі методи введення чужорідної ДНК в геном вищих рослин (пряма трансформація протопластів, мікроін’єкції, електропорація, упакування в ліпосоми, біолістика та ін.)(Пизурян Е.С., 1086; Пастернак Т.П., 1991).
Особлива увага дослідників при розробці трансформуючих векторів зосереджена на використанні їх природних аналогів — онкогенних плазмід агробактерій.
Введення чужорідних генів в рослину
за допомогою Ті-плазмід
Agrobacterium tumitaciens
Злоякісні пухлини рослин, які описував ще Аристотель під назвою "корончатий гал", широко спостерігаються в природі у вигляді грубих наростів на прикореневих і надземних частинах стебла, підземних коренях, у місцях з'єднання прищепи і підщепи. Хвороба уражує понад 600 видів рослин, головним чином — дводольних ( виноград, плодові, лісові та декоративні породи дерев і кущів, цитрусові, томати, бобові, гвоздика та ін.). Рослини, на яких утворились гали, починають відставати в рості, часто підсихають і стають чутливими до несприятливих умов середовища. Втрати врожаю хворих рослин можуть складати до 50-70%. і
На початку XX ст. Е.Сміт і К.Таудсенд (і907) показали, що збудником цього захворювання є бактерія Agrobacterium tumifaciens (буквальний переклад "польова бактерія, що викликає пухлини"). Відомі також інші вірулентні штами агробактерій: А. rhizogenes (викликає захворювання "бородатий корінь" – hairy root) та А. rubi ("стебловий гал" – cane gall). У 40-х роках американський дослідник Армін Браун виявив, що клітини рослинних пухлин інтенсивно ростуть на штучних поживних середовищах ін вітро без фітогормонів, на відміну від нормальних клітин. Подальші дослідження пояснили причину такої "самостійності" пухлинних клітин - вони самі виробляють великі кількості цих фітогормонів.
У 1974 році Джозеф Шелл і Марк ван Монтеню зробили відкриття - встановили пряму залежність фітопатогенності окремих штамів агробактерій від присутності в них кільцевих плазмід великого розміру, позначених як Ті-плазміди (tumor inducing – індукуючи пухлини), або скорочено — рТі. Відкриття Ті-плазмід мало фундаментальне значення — встановлена можливість генів прокаріот-бактерій контролювати деякі ознаки аукаріот-рослин.
Сучасне уявлення про структуру Ті-плазмід базується на майже 20-річному вивченні їх пухлиноутворюючої дії, рестриктному аналізі і молекулярному клонуванні фрагментів плазмідної ДНК ( Пирузян Е.С., 1986, 1988; Чернин Л.С, Зос Н.Н., 1986; Чернин Л.С.,1990; Армитидж Ф. та ін., 1991).
Ті-плазміди - кільцеві молекули ДНК розміром 50-80 мкм, молекулярною масою близько 1,3.106Д і довжиною до 200 тис. пар нуклеотидів, що дозволяє їм кодувати близько 150-200 білків. Генетична карта рТі повністю не розшифрована. З'ясовано тільки 4 ділянки: дві онкогенні (Т-ділянка, vir-гени) і дві ділянки (ОR1. СОN), які визначають морфологію пухлин, забезпечують реплікацію плазмід та їх кон'югацію (здатність переноситись від однієї бактерії до іншої).
4. Масштаб досягнень в генній інженерії рослин на сьогодні скромний у порівнянні з іншими біотехнологічними напрямками (мікроклональним розмноженням, соматичною гібридизацією та ін.). Але генетична інженерія відкриває перед селекцією рослин нові перспективи, пов’язані з можливістю перенесення в них генів від бактерій, грибів, екзотичних рослин та навіть людини і тварини і таким чином відкриває можливості, недосяжні методами експерементального мутагенезу і традиційної селекції.
Останнім часом виникла потреба створення більш продуктивних форм рослин, які могли б поєднувати не лише якісні та кількісні ознаки, а й стійкість проти біотичних та абіотичних факторів навколишнього середовища. Ці дослідження передбачають роботу зі значною кількістю генів. Наприклад для поліпшення смакових властивостей рослинної продукції (надання солдодшого смаку) використовують гени синтезу монеліну або тауматину – білків, які в 100000 разів солодші, ніж цукор, в розрахунку на молекулярну масу. Ці білки виділені з плодів африканських рослин. Ген синтезу монеліну введено в рослини томатів і цибулі-латуку. Трансгенні рослини накопичують цей білок у значній кількості в плодах і листках.
Отримані трансгенні рослини сої і кукурудзи з поліпшеними якостями жирів, з дуже низьким вмістом поліненасичених жирних кислот і високим рівним мононенасичених кислот. Деякі з цих модифікованих жирів застосовують в промисловості як мастильні матеріали. Клоновано гени запасних білків сої, гороху, квасолі, кукурудзи, картоплі та багато ін. Одним з шляхів створення більш повноцінного білка у зернобобових культур є використання гена 2S-білка бразильського горіха, що містиь велику кількість метіоніну. В такий спосіб отримано трансгенні форми бобів. Створенно трансгенні рослини конюшини, що містять ген синтезу білка соняшнику з підвищеним вмістом сірковмісних амінокислот.
Отримано насіння трансгенних кормових культур, які містять набір ферментів для підвищення засвоєння кормів, антибіотики, вітаміни та ін корисні складові. Методами генної інженерії змінюють вміст і склад вуглеводів в бульбах картоплі, томатів, цукрових буряків.
Істотним недоліком плодів протягом зберігання є їх розм’якшення після дозрівання , яке обумовлюється ферментом полігалактуроназою. Для усунення цього недоліку перспективним виявився генно-інженерний метод з синтезом цього ферменту, який у трансгенних томатів визиває лежкість, тобто можливість тривалішого зберігання без гниття.
Для збільшення термінів зберігання був використаний ген арабідопсиса, який кодує мутантний рецептор етилену, що забезпечує знижену чутливість до етилену як фіттогормону. У трансгенних рослин томатів і петунії значно зріс термін дозрівання плодів, а також термін цвітіння і обпадання квіток. Використання цього методу може призвести до суттєвих змін у декоративному садівництві: відкриваються можливості значно довше зберігати зрізані квіти без зміни їхніх властивостей.
Отримані трансгенні рослини цвітної капусти, що характеризуються затримкою старіння.
Сучасне сільське виробництво неможливе без застосування гербіцидів. Однак вони пригнічують ріст як бур’янів, так і культурних рослин. Серед генів, що визначають стійкість проти гербіцидів, клоновані гени стійкості таких гербіцидів, як Раундап (гліфосат), Баста та ін. Із використанням цих генів отримано трансгенні рослини кукурудзи, сої, бавовнику, картоплі, цукрових буряків, гречки, тютюну та ін.
Для створення стійких проти вірусної інфекції рослин використовують антисенсорні конструкції, де копія вірусної РНК вбудовується під промотр, що зумовлює стійкість рослин до віруса (тютюн, картопля, цибулеві декоративні рослини).
Вивчена можливість отримання трансгенних рослин картоплі, рису, сої, квасолі, пшениці, ячменю, які стійкі проти шкідників за рахунок введення генів рослин з інсектицидною активністю.
На сьогодні велика увага приділяється створенню трансгенних рослин зі зміненим забарвленням квіток. Зокрема, отримані рослини петунії зі зміненим забарвленням квіток від пурпурового до темно-червоного методом введення генів дегідрофлавонол-4-редуктази з кукурудзи або гербери. Зі зміненою пігментацією квіток отримані рослини гербери, хризантеми, троянди, гвоздики та ін. Аналогічні підходи використовують для створення квіток зі зміненим забарвленням, а також для зміни пігментації плодів і деревини.
