
- •Конспект 9-11. Хімічна кінетика. Вплив природи і концентації реагуючих речовин на швидкість реакцій.
- •Класифікація хімічних реакцій
- •І. Прості
- •Іі. Складні
- •Хімічна кінетика. Вплив температури та каталізаторів на швидкість шімічних Основні поняття, визначення, формули.
- •Каталітичні процеси.
- •Біологічні каталізатори – ферменти
Класифікація хімічних реакцій
Усі хімічні реакції можна класифікувати наступним чином:
І. Прості
1. Одномолекулярні: A → B; A → B + C
2. Двомолекулярні: A + B → C; 2A → B
3. Тримолекулярні: A + 2B → C; 3A → B
4. Псевдомономолекулярні
Іі. Складні
Паралельні C ← A → B
Оборотні A ↔B
Спряжені A + B → F, A + C → D
Послідовні A → B → C
Ланцюгові
Фотохімічні
Хімічна кінетика. Вплив температури та каталізаторів на швидкість шімічних Основні поняття, визначення, формули.
Вплив температури на швидкість хімічних реакцій визначається емпіричним правилом Вант-Гоффа: при збільшені температури на 10°С швидкість хімічної реакції зростає в два-чотири рази.
![]() - температурний коефіцієнт реакції
- температурний коефіцієнт реакції
Зауважимо, що правило Вант-Гоффа справедливе для відносно невеликого інтервалу температур (273-373 К).
Для біохімічних реакцій = 1,6—3. Більшість ферментів виявляє каталітичну активність в інтервалі температур 10 - 60°С.
Якщо при захворюванні температура тіла людини підвищилась, наприклад, від 36,5 до 39,5°С, то це свідчить про збільшення швидкості біохімічних процесів у 1,13-1,39 рази. Ще більше підвищення температури (40-42°С) призводить до швидкого зниження біохімічного процесу у зв’язку з денатурацією та інактивацією ферментів.
Ферментативні процеси характеризуються більш високими температурними коефіцієнтами (7-10). У цьому випадку інтервал в 100C надто широкий. Тому потрібно брати більш вузький інтервал температур (2, 3, 50С), крім того, при різних інтервалах температур коефіцієнт не є постійним.
Взагалі, швидкість хімічної реакції при підвищенні температури визначається формулою:
![]()
Зростання швидкості хімічних реакцій з підвищенням температури пояснюється тим, що в реакцію вступають тільки ті частинки, які мають достатню для цього енергію - енергію активації (Еа). З збільшенням температури число таких частинок зростає, тому і збільшується швидкість хімічних реакцій. Енергію активації можна надати частинками хвильовим способом (звук, проміння) або наданням системі тепла (підвищенням температури). Енергія активації витрачається на розрив зв’язків у вихідних речовинах і на достатнє для проходження реакції зближення частинок.
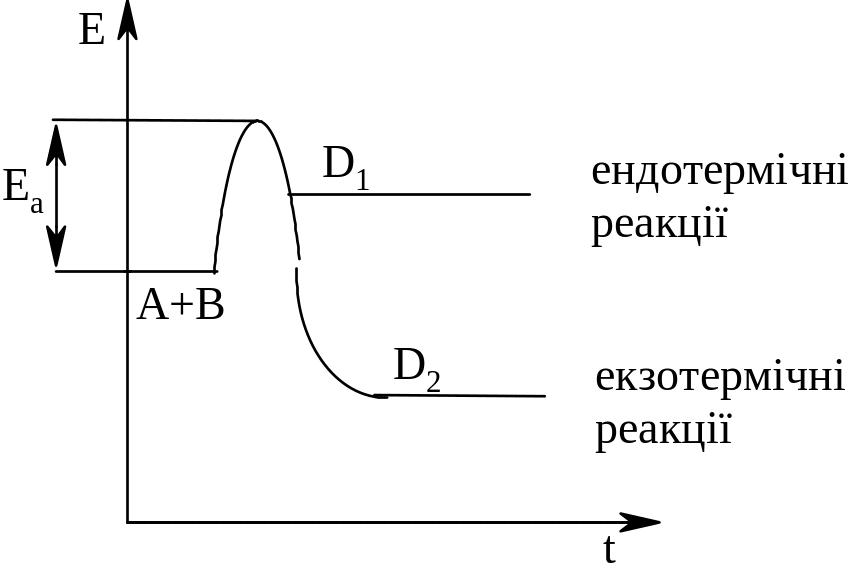
Для перебігу реакції молекули реагентів повинні набути критичного (порогового) значення енергії, що перевищує середню енергію молекул. Це означає, що на шляху кожної хімічної реакції стоїть енергетичний бар’єр, подолати який може тільки незначна частина реагуючих молекул, які при даній температурі мають для цього достатню енергію.
Енергія активації дорівнює різниці між мінімальним надлишком енергії, необхідним для хімічної взаємодії і середнім запасом енергії молекул.
У 1889 році С.Арреніус запропонував рівняння для визначення енергії активації
![]()
де,
К - константа швидкості хімічної реакції;
А - передекспоненційний множник (враховує просторову будову реагуючих частинок, їх можливі розміщення під час зіткнень;
е - основа натуральних логарифмів;
Еа - енергія активації;
R - універсальна газова постійна;
Т - абсолютна температура.
Розмірність Еа
= ![]()
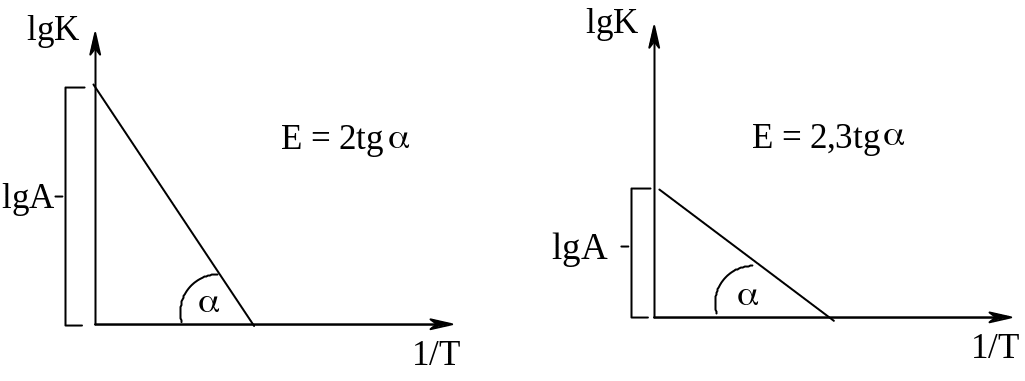
Логарифмуємо рівняння Арреніуса і одержимо:
![]()
Визначаємо К при різних температурах і знаходимо А.
![]()
Енергія активації для більшості процесів змінюється у межах від 40 до 250 кДж/моль.
Коли Еа < 20 кДж/моль. то реакції проходять при температурі до 500С; коли Еа > 120 кДж/моль - 250°С.
Залежність швидкості хімічної реакції від концентрації та темперватури пояснюють дві теорії: активних зіткнень і перехідного стану. Перша використовує основні положення молекулярно-кінетичної теорії та припущення про існування енергетичного бар’єру. Для розрахунку швидкості реакції необхідно знати кількість зіткнень молекул за одиницю часу в одиниці об’єму і частку зіткнень, які призводить до взаємодії реагентів. Добуток цих двох величин становить кількість молекул, що прореагували ва одиницю часу в одиниці об’єму, тобто швидкість хімічної реакції.
Однак швидкість реакції, розрахована теоретично, не завжди співпадає зі швидкістю, визначеною експериментально. Виявляється що для перебігу реакції молекулам потрібна не тільки енергія (Еа), а й певна просторова орієнтація під час зіткнення. Цей стеричний фактор не може розрахувати теорія активних зіткнень.
Теорія перехідного стану складається з двох положень.
1. Кожна хімічна реакція відбувається через утворення активованого комплексу, який потім розпадається на продукти даної реакції.
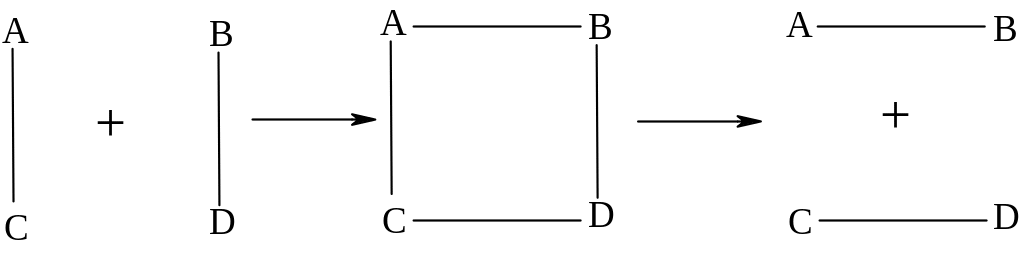
Перехідний стан - комплекс, в якому одночасно відбувається розрив старих і утворення нових хімічних зв’язків. Для його утворення необхідна енергія. Додаткову енергію, яка необхідна для переходу системи в вихідного стану в активований комплекс, називають енергією активації.
2. Другим положенням теорії перехідного стану є рівновага активованого комплексу з вихідними речовинами.
