
- •2 Зависимость температуры кипения некоторых монозамещённых метана от молекулярной массы
- •3 Энергия связей в метаноле
- •4 Сравнение температур кипения и плотностей некоторых высших алканов и соответствующих алканолов
- •5 Значения констант кислотности и энергии диссоциации некоторых гидроксильных соединений
- •7 Некоторые физические константы для алифатических предельных спиртов
- •8 Некоторые физические константы для ряда алициклических, ароматических и непредельных спиртов
- •9 Основные современные процессы, используемые для промышленного получения спиртов
- •10 Основные химические промышленные способы получения экономически наиболее важных спиртов
- •11 Получение спиртов биохимическими методами
- •12 Окисление первичных, вторичных и третичных спиртов до различных производных
- •13 Примеры неорганических реагентов, используемых для окисления спиртов
11 Получение спиртов биохимическими методами
Наименование спирта |
Исходное сырьё |
Краткое описание процесса |
Этанол |
целлюлозное сырьё: древесина, солома, багасса, отходы деревообрабатывающего и целлюлозного производства |
Кислотный или энзимный гидролиз растительного сырья с последующей анаэробной спиртовой ферментацией (сбраживанием) образующихся моно- и олигосахаридов дрожжевыми грибами (Saccharomyces) или некоторыми видами бактерий |
крахмал- и сахарсодержащее сырьё: сахарная свекла, картофель, маниок, злаковые культуры (рис, ячмень, пшеница, сорго, кукуруза, сахарный тростник и др.) |
||
Бутанол |
крахмалсодержащее сырьё: сахарная свекла, картофель, маниок, злаковые культуры (рис, ячмень, пшеница, сорго, кукуруза, сахарный тростник и др.) |
Аналогично производству биоэтанола, но с применением бутанольной ферментации бактериями Clostridium |
Глицерин |
сыворотка, сахарная меласса, пшеничный гидролизат |
Ферментация сахаросодержащего сырья дрожжевыми грибами (Saccharomyces cerevisiae или Kluyveromyces fragilis) в присутствии сульфита натрия |
Химические свойства спиртов
Физико-химические свойства спиртов определяются в основном строением углеводородной цепи и функциональной группы −OH, а также их взаимным влиянием:
1) чем больше заместитель, тем сильнее он влияет на функциональную группу, снижая полярность связи O—Н. Реакции, основанные на разрыве этой связи, протекают более медленно;
2) гидроксильная группа −ОН уменьшает электронную плотность вдоль прилегающих σ-связей углеродной цепи (отрицательный индуктивный эффект).
Все химические реакции спиртов можно разделить на три условных группы, связанных с определёнными реакционными центрами и химическими связями:
разрыв связи O−H (реакционный центр — водород);
разрыв или присоединение по связи С−OH (реакционный центр — кислород);
разрыв связи −СOH (реакционный центр — углерод).
Реакции с участием гидроксильной группы (связи С−O и О−H)
Кислотно-основные реакции спиртов
Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов
![]()
![]()
С сильными кислотами Льюиса спирты ведут себя подобно основаниям, образуя донорно-акцепторные комплексы
![]()
Превращение спиртов в галогеналканы
Одной из наиболее важных реакций с участием связи C−O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена несколькими способами:
взаимодействием с галогенводородами (HCl, HBr, HI);
реакцией с тионилхлоридом;
действием галогенидов фосфора (III) и (V);
реакцией с квазифосфониевыми солями;
превращением в алкилсульфонат с последующей реакцией замещения.
Взаимодействие спиртов с галогенводородами
Взаимодействие спиртов с галогенводородными кислотами приводит к замещению гидроксильной группы на галоген
![]()
В зависимости от строения субстрата возможны побочные процессы изомеризации и дегидратации. Из-за относительно жестких условий проведения данные реакции применимы только к соединениям, устойчивым к кислотам.
Бромоводородную и иодоводородную кислоты часто получают непосредственно в ходе реакции из соответствующих солей (KBr, KI и т.д.) действием серной или фосфорной кислот. Незамещенные первичные спирты превращаются в алкилбромиды с помощью горячей концентрированной бромоводородной кислоты
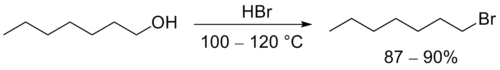
Попытки получить алкилиодид с помощью HI иногда могут приводить к восстановлению первоначального продукта до алкана. Помимо этого, свободный иодоводород способен реагировать с серной кислотой, приводя к образованию сернистой кислоты и иода. Если субстрат содержит двойные связи, последние также могут быть восстановлены
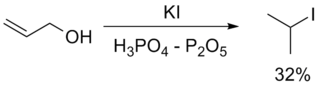
Вышеуказанные реакции можно использовать для получения первичных, вторичных и третичных галогеноалканов, хотя в случае изобутилового и неопентилового спиртов велики выходы продуктов перегруппировки
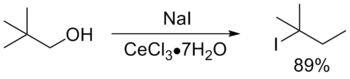
Реакции третичных спиртов с HCl протекают достаточно легко. При этом образуются соответствующие третичные алкилхлориды (совместно с продуктами побочных реакций). Первичные и вторичные спирты реагируют гораздо медленнее и требуют применения катализатора. Обычно используется так называемый реагент Лукаса, представляющий собой смесь HCl и ZnCl2

Хорошие выходы первичных алкилхлоридов были также получены при использовании HCl в HMPA (гексаметилфосфотриамид, биполярный апротонный растворитель).
Прямое взаимодействие спиртов с фтороводородом возможно только при использовании третичных, аллиловых и бензиловых спиртов. Так, например, реакция трет-бутилового спирта c 60 % водным раствором HF при нагревании приводит к образованию трет-бутилфторида
![]()
Вместо чистой HF для фторирования обычно используют 70 % раствор фтороводорода в пиридине, так называемый реактив Олаха. Первичные и вторичные спирты реагируют с галогенводородами по механизму SN2 (общая схема):
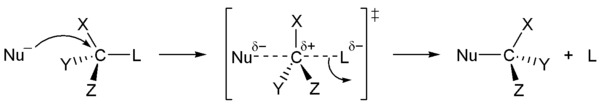
Для третичных спиртов характерен механизм SN1
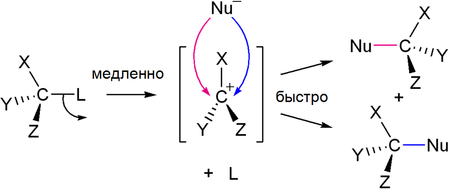
В ходе такого замещения образуется промежуточный карбокатион, поэтому SN1 реакции могут сопровождаться перегруппировками и элиминированием. Таким образом, практический интерес представляют только те третичные спирты, которые дают карбокатион, не способный к перегруппировкам.
Взаимодействие спиртов с галогенидами фосфора
Распространённым способом превращения спиртов в алкилгалогениды является их взаимодействие с галогенидами фосфора: РВr3, РСl5, РОСl3 или РI3 (образуется непосредственно в ходе реакции). Реакция протекает по нуклеофильному механизму с образованием галогенфосфита в качестве интермедиата
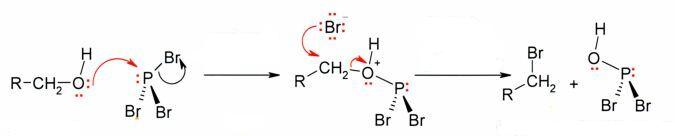
Для повышения выхода конечного продукта и уменьшения доли побочных реакций замещение ведут в присутствии пиридина.
В соответствии с особенностями механизма реакции (SN2), замещение гидроксильной группы на галоген происходит с обращением конфигурации у асимметрического атома углерода. При этом следует учитывать, что замещение часто осложняется изомеризацией и перегруппировками, поэтому подобная реакция, обычно, применяется для относительно спиртов простого строения.
Взаимодействие спиртов с тионилхлоридом
В зависимости от условий взаимодействие спиртов с SOCl2 протекает либо по механизму SNi, либо по механизму SN2. В обоих случаях спирт превращается в соответствующий алкилхлорид.
Если реакция проходит в отсутствие пиридина, продукт имеет такую же конфигурацию реакционного центра, что и исходный спирт (механизм SNi)
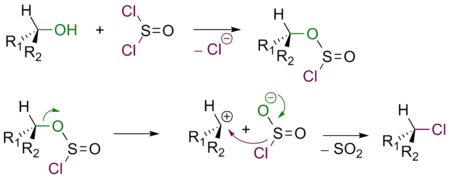
Добавление пиридина в реакционную смесь приводит к изменению стереохимического результата процесса. Полученный алкилхлорид имеет обращенную конфигурацию. Этот факт можно объяснить следующим механизмом SN2
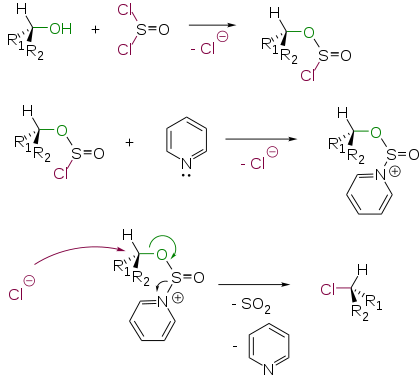
Взаимодействие спиртов с хлорангидридами сульфокислот и последующим замещением
Спирты способны реагировать с хлорангидридами сульфокислот в присутствии основания с образованием соответствующих сложных эфиров. Первичные спирты реагируют быстрее вторичных и значительно быстрее третичных. Возможно селективное образование первичного сложного эфира сульфокислоты в присутствии вторичных и третичных спиртовых групп. Наибольшее практическое значение имеет получение алкилтозилатов (R−O−SO2C6H4CH3), алкилмезилатов (R−O−SO2CH3) и алкилтрифлатов (R−O−SO2CF3). В роли основания чаще всего используется пиридин, который одновременно выступает и как нуклеофильный катализатор. Сульфонаты являются прекрасными уходящими группами и легко замещаются на атом галогена по механизму SN2
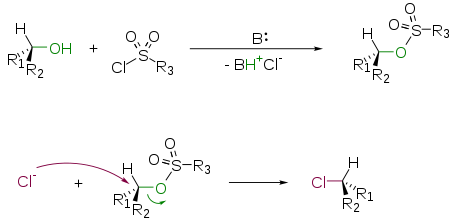
Источником галогенид-иона обычно является соответствующая неорганическая соль (NaBr, LiCl, CsF, KF] и т. д.) В качестве растворителя используются диполярные апротонные растворители: ДМСО, ДМФА, ацетонитрил. Замещение происходит, как правило, с обращением конфигурации.
Метод замещения гидроксила на высокореакционноспособную группу — мощный препаративный метод в органической химии, позволяющий получать из спиртов в две стадии, помимо галогенидов, самые различные соединения: простые эфиры, сложные эфиры карбоновых кислот, амиды.
Взаимодействие спиртов с квазифосфониевыми солями
Спирты могут быть превращены в алкилгалогениды реакцией с квазифосфониевыми солями — [R3PHal]+X−. Последние образуются при взаимодействии органофосфионов (R3P) с галогенами, тетрагалогенметанами (CCl4, CBr4) или N-галогенсукцинимидами (например, NBS). Данный метод применим к первичным и вторичным спиртам; в случае третичных спиртов возможно образование продуктов перегруппировки. R3PBr2 и R3PI2 (получаются из R3P и Br2/I2) дают хорошие выходы даже с третичными и неопентильными субстратами[96]. В общем виде реакция протекает по следующей схеме
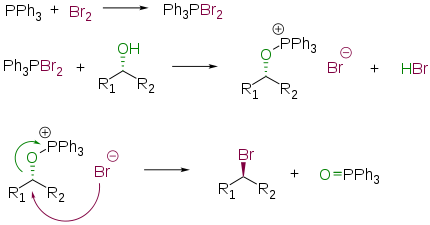
Превращение происходит с инверсией реакционного атома углерода.
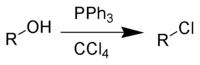
Частный случай взаимодействия — превращение спиртов в алкилхлориды под действием трифенилфосфина и тетрахлорметана — в заграничной литературе получил название реакции Аппеля (англ. Appel reaction)
Прочие методы замещения гидроксильной группы на галоген
Некоторые дополнительные агенты, позволяющие провести замещение гидроксильной группы на галоген.
Замещение OH− на F−. Одним из наиболее известных прямых фторирующих агентов для для первичных и вторичных спиртов является реагент Яровенко или N,N-диэтил(2-хлор-1,1,2-трифторэтил)-амин
![]()
Удобным фторирующим агентом для первичных и вторичных спиртов может служить тетрафторид серы SF4
![]()
По аналогии с SF4, можно использовать и тетрафторид селена SeF4
Среди современных фторирующих агентов для спиртов используют N,N-диэтиламиносеры трифторид (C2H5)2N-SF3 (англ. DAST), бис(2−метоксиэтил)аминосеры трифторид (CH3OC2H4)2N-SF3 (англ. Deoxofluor) и ряд других.
Удобным методом конверсии спиртов в алкилфториды с выходом, близким к количественному, является их синтез через фтороформиаты (реакция с COF2, образующимся in situ из бис-(трихлорметил)карбоната и KF) с последующим разложением образующихся полупродуктов при 120—125 °С в присутствии гексабутилгуанидин фторида (HBGF) как катализатора
![]()
Замещение OH− на Cl− и Br−:
Эффективным методом замещения гидроксильной группы на Cl− и Br− является реакция спиртов при комнатной температуре с цианурхлоридом (цианурбромидом) и N,N-диметилформамидом в среде метиленхлорида
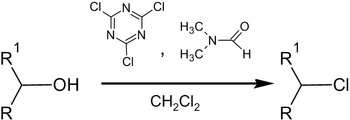
Другим вариантом замещения гидроксильной группы на галоген является использование в качестве нуклеофильных агентов триметилсилилгалогенидов. При этом возможно замещение на I, Br и Cl — для последнего в качестве катализатора используются небольшие количества диметилсульфоксида.
Замещение OH− на I−:
Удобным препаративным методом замещения гидроксильной группы практически всего диапазона спиртов (включая третичные, аллильные и бензиловые спирты) на иод, является использование в качестве регента соли трифенилфосфита с метилиодидом
![]()
Новым методом получения алкилиодидов из первичных и вторичных спиртов является использование в качестве иодирующего агента тиоиминиевой соли в присутствии имидазола
![]()
Превращение спиртов в эфиры неорганических кислот
Получение нитратов и нитритов
Этерификацией спиртов концентрированной азотной кислотой получают органические нитраты
![]()
Используя нитрозирующие агенты (NaNO2+H2SO4; NOCl; NOBF4 и пр.) по аналогии можно получить эфиры азотистой кислоты
![]()
Хорошим нитрозирующим агентом для спиртов также является раствор в ацетонитриле нитрита тетрабутиламмония (C4H9)4NNO2 в смеси с 2,3-дихлор-5,6-дицианобензохиноном и трифенилфосфином
Получение сульфитов и сульфатов
Серная кислота способна давать при взаимодействии со спиртами при низких температурах кислые и средние эфиры (алкилсульфаты):
![]()
![]()
В лаборатории данный способ можно использовать только для низших спиртов (метанол и этанол), так как в прочих случаях велика доля продуктов дегидратации: алкенов и простых эфиров. Помимо серной кислоты для синтеза алкилсульфатов используют оксид серы(VI), хлорсульфоновую или аминосульфоновую кислоту. Взаимодействием спиртов с тионилхлоридом или диоксидом серы (в присутствии иода или брома) в пиридине можно получить органические сульфиты
![]()
Получение гипогалогенитов
Стандартным способом получения органических гипохлоритов из спиртов является действие на последние раствора гипохлорита натрия при охлаждении и отсутствии прямого солнечного света
![]()
Похожим способом можно получить из первичных спиртов гипобромиты, при этом для этанола наблюдается очень высокий выход (92 %)
![]()
Отметим, что в этанол при взаимодействии с гипогалогенитами в других условиях окисляется с образованием хлороформа, бромоформа или иодоформа (галоформная реакция)
![]()
![]()
![]()
Получение прочих эфиров неорганических кислот
Реакцией спиртов с некоторыми неорганическими кислотами, их ангидридами или галогенангидридами можно получить различные эфиры:
фосфаты органические
![]()
фосфиты органические
![]()
бораты органические
![]()
тиоцианаты органические
![]()
Превращение спиртов в простые эфиры
Взаимодействие алкоголятов с алкилгалогенидами или алкилсульфонатами
(реакция Вильямсона)
В отличие от спиртов, являющихся слабыми нуклеофилами, алкоголяты, образующие алкоксид-ионы RO− — сильные нуклеофилы и легко реагируют с алкилгалогенидами по механизму SN2 с образованием простых эфиров
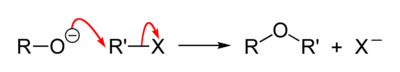
Вместо алкилгалогенидов можно использовать также алкилсульфонаты. Побочными продуктами реакции являются алкены, образующиеся в результате конкурирующего процесса элиминирования спирта
![]()
Метод является одним из старейших в лабораторной практике и используется, преимущественно, для синтеза несимметричных эфиров. Другим направлением использования реакции Вильямсона является синтез краун-эфиров (краун-соединения — макрогетероциклические соединения, содержащие в своих циклах более 11 атомов, из которых не менее четырёх — гетероатомы, которые связаны между собой этиленовыми мостиками).
Межмолекулярная и внутримолекулярная дегидратация спиртов
При осторожном нагревании в присутствии серной кислоты происходит межмолекулярная дегидратация спиртов с образованием простых эфиров
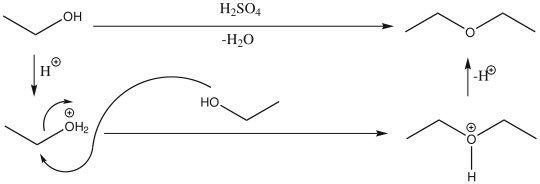
Если в реакцию с кислотой вступают двухатомные спирты, будет протекать реакция внутримолекулярной дегидратации с образованием гетероциклических соединений. Например, 1,4-бутандиол образует тетрагидрофуран
![]()
Так как реакция получения эфира обратима, для её смещения вправо обычно используют метод отгонки конечных продуктов (воды или эфира) из реакционной смеси.
Существуют и методы термокаталитической дегидратации спиртов. Например, первичные спирты в присутствии смешанного Ni−Al2O3−SiO2 катализатора и водорода при нагревании превращаются в простые эфиры
![]()
Метод межмолекулярной дегидратации — один из наиболее старых способов получения эфиров — используется весьма ограниченно и только для неразветвлённых первичных спиртов из-за высокой доли алкенов, образующихся в случае внутримолекулярной дегидратации при использовании вторичных и третичных спиртов. Вместе с тем, реакция применяется в промышленности для синтеза некоторых простых эфиров.
Прочие методы превращения спиртов в простые эфиры
Среди прочих методов превращения спиртов в простые эфиры:
взаимодействие спиртов с диазометаном в присутствии кислот Льюиса
![]()
присоединение алкенов к спиртам в присутствии неорганических кислот
![]()
Превращение спиртов в сложные эфиры
Кислотно-каталитическая реакция этерификации. Спирты способны образовывать сложные эфиры в реакциях с органическими кислотами при нагревании в присутствии кислотного катализатора (как правило, концентрированной H2SO4). Этот процесс получил название кислотно-каталитической реакции этерификации (также известен как реакция Фишера) - взаимодействие этанола с уксусной кислотой дает этилацетат
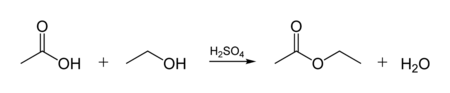
Механизм реакции
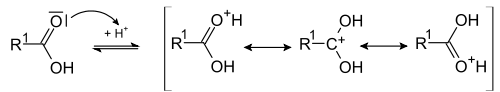
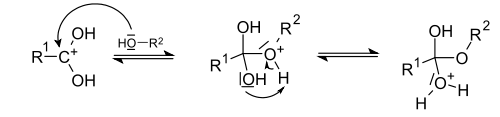
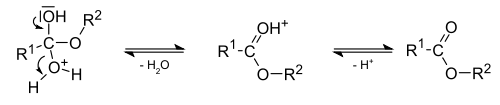
Кислотно-каталитическая реакция этерификации — простейший и наиболее удобный метод получения сложных эфиров для случая, когда ни кислота, ни спирт не содержат чувствительных функциональных групп. В качестве катализатора, помимо традиционно используемой серной кислоты, могут выступать кислота Льюиса или Бренстеда; растворителем, обычно, служит сам спирт или, если это невозможно — толуол или ксилол. Для увеличения выхода эфира используют отгонку или химическое связывание воды, а также специализированное лабораторное оборудование (аппарат Дина — Старка).
Для пространственно затруднённых и склонных к элиминированию под действием кислот реагентов, например — трет-бутанола, существует метод мягкой этерификации, носящий имя этерификации Стеглиха (англ. Steglich Esterification). Реакция между спиртом и кислотой происходит в присутствии дициклогексилкарбодиимида (ДЦК) и небольших количеств 4-N,N-диметиламинопирнидина. ДЦК и карбоновая кислота на первом этапе образует O-ацилизомочевинный интермедиат, который в дальнейшем вступает в реакцию со спиртом, образуя сложный эфир
![]()
![]()
Реакция переэтерификации. Реакция переэтерификации или алкоголиза сложных эфиров имеет следующий общий вид
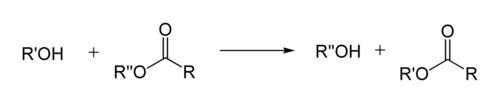
Для успешного осуществления переэтерификации используются различные методы: отгонка низкокипящих продуктов, использование специальных катализаторов, в том числе межфазного переноса и др. Механизм реакции переэтерификации аналогичен механизму гидролизау эфиров, поэтому в качестве побочного процесса возможно алкильное расщепление
![]()
Алкоголиз растительных жиров, представляющих собой сложные эфиры жирных кислот и глицерина, метиловым или этиловым спиртом — перспективная альтернатива производства биодизеля.
Взаимодействие спиртов с хлорангидридами, ангидридами кислот и нитрилами
С
хлорангидридами
карбоновых кислот спирты довольно
легко вступают в реакцию, образуя сложные
эфиры (реакция ацилирования)

Реакция спиртов с галогенангидридами — лучший общий способ получения сложных эфиров, так как позволяет использовать субстраты с самыми разными функциональными группами. В 1898 г. немецким химиком Айнхорном была предложена модификация этого метода: ацилирование проводится в избытке пиридина. Амин на первом этапе реагирует с хлорангидридом с образованием пиридиниевой соли, которая благодаря высокой ацилирующей способности под действием спирта легко трансформируется в эфир
![]()
Вместо ацилгалогенидов, для синтеза сложных эфиров может быть использована схожая реакция ангидридов карбоновых кислот со спиртами. В качестве катализаторов используют кислоты, кислоты и основания Льюиса, а также — пиридин и N-4,4-диметиламинопиридин
![]()
Другой путь получения эфиров: взаимодействие спиртов с нитрилами кислот в среде безводного хлороформа в присутствии газообразного хлороводорода приводит к иминоэфиру (реакция Пиннера), гидролизом которого можно получить сложный эфир
![]()
![]()
Этерификация Мукаямы
В 1975 г. Мукаяма с сотрудниками предложил для достижения высоких выходов в реакции этерификации использовать специальный реагент — 2-хлор-1-метилпиридиния иодид
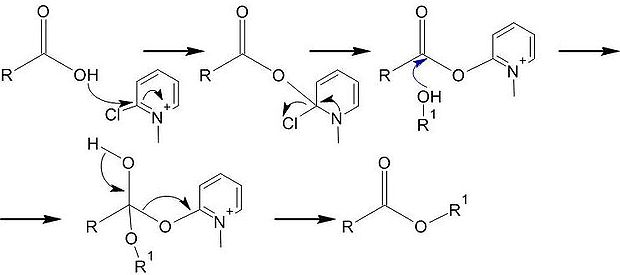
Метод Мукаямы в настоящий применяется для синтеза аминокислот и пептидов.
Реакция Мицунобу. При взаимодействии спиртов с карбоновыми кислотами в присутствии трифенилфосфина и диэтилазодикарбоксилата (англ. diethylazodicarboxylate, DEAD) образуется соответствующий сложный эфир. Данный процесс получил название реакции Мицунобу. Ключевой особенностью реакции является инверсия (обращение конфигурации) атома углерода при гидроксильной группе
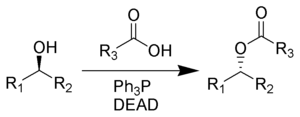
Механизм реакции Мицунобу
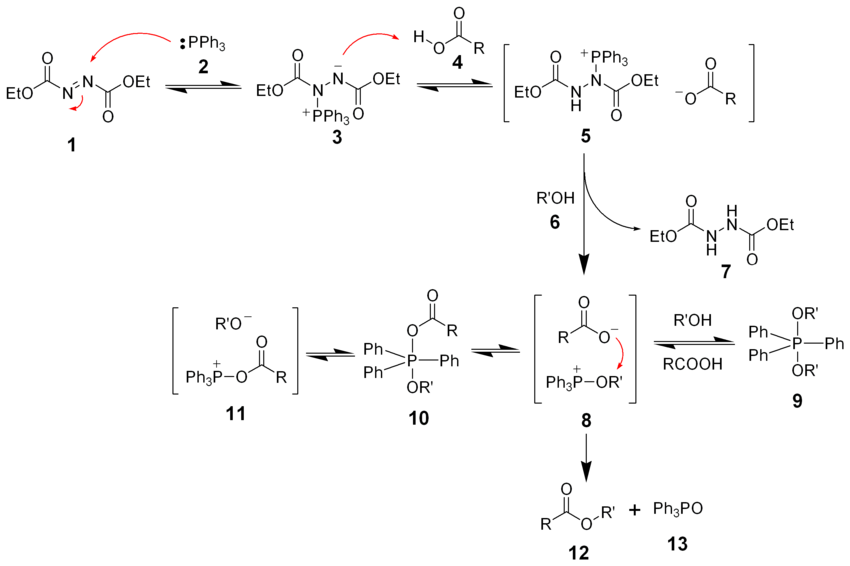
Прочие реакции замещения гидроксильной группы
Хлорокарбонилирование спиртов
Фосген COCl2 — источник хлоркарбонильной группы −C(O)Cl — способен реагировать с различными нуклеофильными агентами и, в частности, со спиртами в соответствии с механизмом SN1 или ацильным механизмом замещения (тетраэдрический переходный интермедиат)
![]()
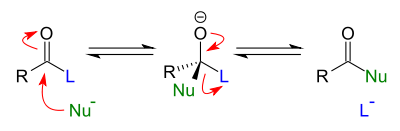
В случае рассматриваемой реакции: R=L=Cl, Nu=RO−.
Алифатические спирты легко вступают в реакцию с фосгеном при комнатной температуре, образуя хлорформиаты (ROC(O)Cl) с высоким выходом. Побочным продуктом реакции являются алкилхлориды, образующиеся при разложении хлорформиатов
![]()
Аналогично фосгену, в реакцию хлорокарбонилирования со спиртами вступают и его производные: дифосген, трифосген, оксалилхлорид.
Замещение гидроксильной группы на амидную
Нуклеофильное замещение гидроксильной группы на амидную возможно только в случае её модификации: перевода в оксониевую форму (−O+H2) под действием сильных кислот или предварительно получая диалкиловые эфиры серной кислоты (R−OSO2O−R), с последующим их замещением
![]()
Прямое каталитическое взаимодействие простейших спиртов с аммиаком имеет исключительно промышленное значение, так как в его результате образуется смесь продуктов
![]()
Например, взаимодействием амилового спирта с аммиаком в присутствии водорода и катализаторов (Ni+Cr2O3) при повышенной температуре и давлении получают смешанные амиламины.
Взаимодействие спиртов с аммиаком в присутствии катализаторов дегидрирования (медь, никель, кобальт на оксиде алюминия и пр.) осуществляется через механизм дегидрирования с последующим аминированием
![]()
Также в промышленности используют конденсацию некоторых аминов со спиртами. Например, анилин в жёстких условиях (170—280 °С, давление 10 МПа, катализаторы: минеральные кислоты, никель) реагирует со спиртами с образованием смеси моно- и дизамещённых производных
![]()
Третичные спирты, обладающие подвижной гидроксильной группой, реагируют с мочевиной, образуя N-алкилпроизводные
![]()
Замещение гидроксильной группы на меркаптогруппу
Замещение гидроксильной группы на меркаптогруппу (−SH) с образованием тиолов можно осуществить действием на спирты P4S10 или взаимодействием паров спирта с сероводородом в присутствии гетерогенного катализатора
![]()
Альтернативным методом получения органических производных сероводородной кислоты является взаимодействие спиртов с тиомочевиной в кислой среде с последующим гидролизом
![]()
Замещение гидроксильной группы на нитрильную
По аналогии с синтезом амидов, замещение гидроксильной группы на нитрильную производят через получение алкилсульфоната, который в дальнейшем при действии цианида натрия или калия приводит к нитрилу
![]()
Замещение гидроксильной группы на азидную
Спирты не вступают в прямое взаимодействие с неорганическими азидами, однако их нагревание с азидом дифенилфосфорила позволяет в одну стадию перейти к органическим азидам
![]()
Реакции элиминирования спиртов
Кислотно-каталитическая дегидратация
Кислотно-каталитическая дегидратация спиртов — один из наиболее простых и доступных методов получения алкенов; при этом в качестве дегидратирующего агента возможно использование различных минеральных и органических кислот (серная, фосфорная или щавелевая кислота), кислых солей (гидросульфат натрия), а также кислот Льюиса. В ненуклеофильной среде спирты, подвергаясь протонированию со стороны кислоты, элиминируются по механизму Е1. Механизм E2 для реакции дегидратации встречается редко
![]()
![]()
![]()
Образующийся в процессе реакции карбкатион склонен к проявлению H+-сдвига (миграции протона или алкильных групп), что приводит к перегруппировкам и получению в ходе элиминирования смеси конечных продуктов
![]()
Расщепление спиртов практически во всех случаях происходит по правилу Зайцева, то есть атом водород элиминируется от наименее гидрогенизированного атома углерода.
Оригинальным методом дегидратации является обработка алкоголятов соответствующих спиртов бромоформом (элиминирование происходит через образование промежуточных карбониевых интермедиатов)
![]()
Главным недостаткам кислотно-каталитической дегидратации спиртов является ограниченная возможность контроля положения образующейся двойной связи, а также структуры углеводородной цепи, поэтому данный метод, как правило, используется для стерически симметричных спиртов или спиртов, имеющих простое строение.
Термокаталитическая дегидратация
Термокаталитическая дегидратация спиртов над металлоксидными катализаторами — другой распространённый способ лабораторного получения алкенов. Существует множество различных катализаторов дегидратации среди которых: Al2O3, ThO2, ZnO, V2O5, оксиды редкоземельных металлов (Ho2O3, Er2O3, Tm2O3, Yb2O3, Lu2O3, Y2O3, CeO2), цеолиты. Реакция дегидратации осуществляется при высокой температуре, при этом в качестве побочных процессов наблюдается дегидрирование спиртов
![]()
![]()
Исследования показали, что продуктами термической дегидратации на алюмооксидном катализаторе являются термодинамически более стабильные транс-алкены. Недостатком термической дегидратации спиртов, как и каталитической дегидратации, является отсутствие контроля положения двойной связи, а также невозможность использования этого метола для соединений, содержащих различные термически неустойчивые функциональные группы.
Дегидратация с использованием специальных агентов
Д
 егидратация
по Бургессу. Термолиз
вторичных и третичных спиртов с метил
N-(триэтилдаммонийсульфонил)карбаматом
(реактив
Бургесса) мягко и селективно приводит
к алкенам
егидратация
по Бургессу. Термолиз
вторичных и третичных спиртов с метил
N-(триэтилдаммонийсульфонил)карбаматом
(реактив
Бургесса) мягко и селективно приводит
к алкенам
Реактив Бургесса применяется в каталитических количествах, при этом реакция идёт стереоспецифично и представляет собой цис-дегидратацию.
Дегидратация по Мартину. Наряду с реактивом Бургесса, для дегидратации спиртов используется ещё один органический реагент: сульфуран Мартина или дифенилбис(1,1,1,3,3,3-гексафторо-2-фенил-2-пропокси)сульфуран
Э![]() тот
дегидратирующий агент используют,
преимущественно, для вторичных и
третичных спиртов, при этом последние
реагируют с ним практически мгновенно;
первичные спирты нереакционноспособны
— образуют с сульфураном простые
эфиры.
тот
дегидратирующий агент используют,
преимущественно, для вторичных и
третичных спиртов, при этом последние
реагируют с ним практически мгновенно;
первичные спирты нереакционноспособны
— образуют с сульфураном простые
эфиры.
Элиминирование по Чугаеву. Реакция Чугаева — взаимодействие спиртов с CS2 и NaOH с последующим пиролизом образующегося ксантата
![]()
![]()
Продуктом реакции являются алкены, как правило, в цис-конфигурации. Главное преимущество метода — сведением к минимуму изомеризации и миграции кратной связи
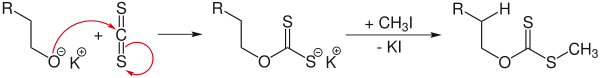
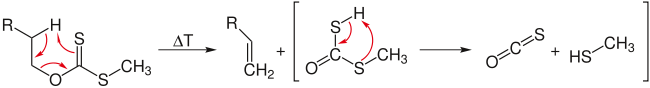
Строго говоря, элиминирование по Чугаеву аналогично получению алкенов пиролизом различных сложных эфиров.
Реакции окисления спиртов
Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот, вторичные — до соответствующих кетонов и кислот. Третичные спирты устойчивы к окислению, однако под действием сильных окислителей могут быть расщеплены с разрывом углеродной цепи в различные карбонильные соединения.
Реакции окисления спиртов, иначе — превращения в карбонильные соединения, можно разделить на две условные группы:
реакции химического окисления;
реакции каталитического дегидрирования.
В табл. 12. приведены сводные данные по реакциям окисления спиртов до различных производных.
