
технология бурения 2
.pdfvk.com/club152685050 | vk.com/id446425943
реакцию, то, естественно, оксид (гидроксид) кальция активно реагирует с кислотами. Практически все кислоты, взаимодействуя с гидроксидом кальция, а затем и с гидросиликатами и гидроалюминатами кальция, вызывают интенсивное разрушение цементного камня и бетона.
При реакции нейтрализации в зависимости от свойств кальциевых солей различных кислот агрессивное действие последних будет различным. Если образуются труднорастворимые соли, то они выпадают в порах цементного камня и создают препятствия для развития коррозионного процесса; если соли легкорастворимые, процесс будет идти интенсивно.
При контакте цементного камня с кислой средой происходит мгновенная нейтрализация кислоты щелочью:
2HCl + Ca(OH)2 → CaCl2 + H2O.
В результате химической реакции гидроксид кальция, находящийся в порах вблизи границы цементного камня, расходуется, и продукты твердения становятся термодинамически неустойчивыми. Поэтому они начинают растворяться и, гидролизуясь, выделяют Ca(OH)2, который идет на нейтрализацию новых порций кислоты. После уничтожения Ca(OH)2 в приграничном слое «агрессор» уничтожает Ca(OH)2 в следующем слое, и процесс коррозии идет до полного поражения цементного камня. В прокорродированной зоне остаются Si(OH)4, Al(OH)3, Fe(OH)3, которые обеспечивают некую связность этой системы, но впоследствии эти гидроксилы разлагаются, выделяя воду и образуя окислы кремния, алюминия и железа, т.е. вместо цементного камня остаются окислы, входящие в состав глины.
Особенностью кислотной коррозии является ее послойный характер. При этом ни один из материалов на основе гидравлических вяжущих не является стойким к данному виду коррозии.
С достаточной для практических целей точностью процесс√ кислотной коррозии цементного камня описывается уравнением ,
где h – глубина разрушения цементного камня; τ – продолжительность действия кислоты;
k – коэффициент, учитывающий вид и концентрацию кислоты, свойства цементного камня и условия взаимодействия кислоты и цементного камня.
Скорость коррозии зависит и от количества вещества, содержащегося в единице объема и способного вступить в реакцию с кислотой. Если в цементе, а затем в порах цементного камня будут содержаться вещества, которые наряду с Ca(OH)2 будут реагировать с кислотой, то скорость коррозии замедлится.
Через некоторое время скорость поступления кислоты будет определяться пористостью прокорродированного слоя, и если его пористость будет мала, то скорость движения кислоты будет замедляться.
118 |
439 |
vk.com/club152685050 | vk.com/id446425943
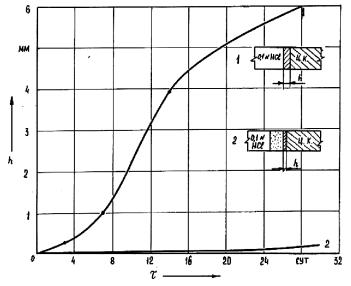
Скорость поступления кислоты к цементному камню можно снизить, если она будет диффундировать через пористый материал (перегородку), например, горную породу. Пример такого эксперимента приведен на рисунке 13.50. В первой части исследовался процесс коррозии цементного камня под действием 0,1N раствора HCl. Данный выбор был обусловлен тем, что процесс коррозии в этом случае не осложнен осадкообразованием в порах камня и может моделировать, в определенной степени, углекислотную и сероводородную коррозию цементного камня, представленного низкоосновными гидросиликатами кальция. Цементный камень формировался из портландцемента (В/Ц = 0,45). Время предварительного твердения 7 суток при нормальных условиях. Пористость керна около 10 %. Скорость цементного камня при непосредственном контакте камня и кислоты была очень высокой (кривая 1, рис. 13.50). В том случае, когда на границе цементного камня находилась малопроницаемая перегородка из песчаника, скорость коррозии существенно снизилась (кривая 2, рис. 13.50). Это связано с тем, что скорость диффузии кислоты через перегородку существенно ниже, чем скорость ее нейтрализации гидроксидом кальция, и лимитирующей стадией процесса коррозии становится именно диффузия.
Рис. 13.50. Влияние проницаемой перегородки на скорость кислотной коррозии цементного камня
Физико-химические основы сероводородной коррозии цементного камня
Сероводород (H2S) является коррозионно активным кислым газом, оказывающим интенсивное разрушающее действие не только на металлические конструкционные материалы (трубы, оборудование и т.д.), но также и на многочисленные неметаллические материалы, к которым относятся тампонажные цементы. Высокая токсичность газа создает серьезную опасность для окружающей среды в окрестности скважин, а также экологическому равновесию как на поверхности, так и в недрах.
440 |
119 |

vk.com/club152685050 | vk.com/id446425943
Растворяясь в воде, сероводород образует слабую сероводородную кислоту, рН которой около 3,8–4,0. В воде сероводород может находиться как в молекулярном виде, так и в диссоциированном состоянии, причем диссоциация его протекает в две ступени со следующими преобладающими формами:
H2S ↔ Н+ + HS- при 6 < рН < 11;
HS- ↔ H++ S2- при рН>11.
С увеличением температуры растворимость газа в воде уменьшается и становится равной 0 при температуре 104 оС, в то время как растворимость сероводорода в нефти (углеводородной среде) при этой температуре еще довольно высокая и почти не снижается с дальнейшим повышением температуры.
Сероводород, содержащийся в скважинах, может контактировать с тампонажным камнем как в газообразном, так и в растворенном состоянии.
Коррозия цементного камня под действием газообразного сероводорода
В условиях газовой сероводородной агрессии механизм поражения носит объемный характер, разрушение сопровождается объемными изменениями камня. Это характерно как для цементного камня из портландцемента, так и камня, полученного из мономинералов цемента (рис. 13.51).
C3S |
C3A |
C4AF |
Рис. 13.51. Продукты твердения мономинералов цементного камня после газовой сероводородной коррозии
Наиболее уязвимы к сероводороду высокоосновные гидросиликаты кальция, Са(ОН)2, гидроалюминаты кальция, соединения, содержащие оксиды железа.
Наличие кислорода усиливает процесс поражения благодаря образованию гипса и гидросульфоалюминатов в порах цементного камня.
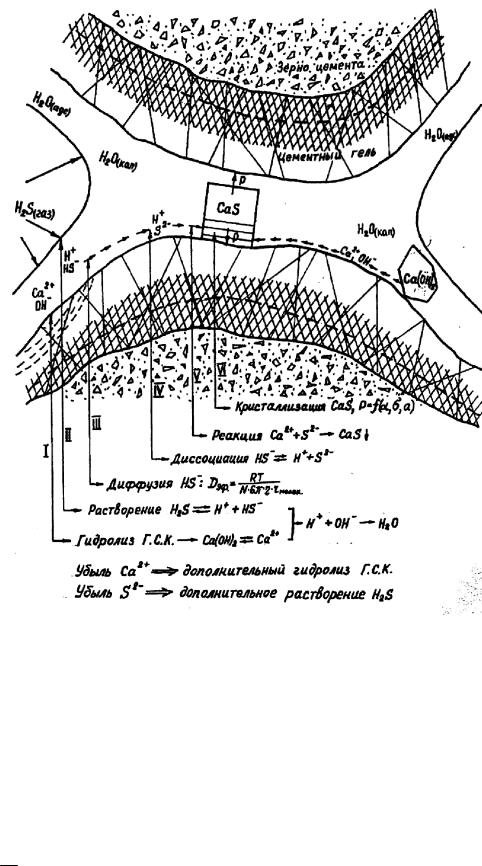
По нашему мнению, механизм газовой сероводородной коррозии представляется следующим образом. Пору цементного камня можно представить в виде капилляра с переменным сечением (рис. 13.52).
120 |
441 |
vk.com/club152685050 | vk.com/id446425943
Рис. 13.52. Схема, иллюстрирующая механизм поражения цементного камня под действием газообразного сероводорода
Согласно уравнению Томсона (Кельвина) существует зависимость между радиусом кривизны жидкости в капиллярах и относительным давлением пара над мениском, которая выражается формулой:
ln α1 = |
2 Vmσ |
, |
|
RT r * |
|
где α1 = PoP – относительное давление пара над мениском;
Vm – мольный объем жидкости; r * – радиус мениска.
442 |
121 |
vk.com/club152685050 | vk.com/id446425943
Если поровое пространство состоит из капилляров разных размеров, то в зависимости от влажности окружающей среды изменяется степень заполнения камня влагой. Для любой конкретной влажности существует определенный радиус пор (r), при котором все поры меньше этого размера будут заполнены влагой за счет самопроизвольной конденсации (рис. 13.52). При этом газ, проникая по открытым порам вглубь камня, достигает перемычки (поровой жидкости) и начинает растворяться в ней. В соответствии с законом Генри при постоянной температуре растворимость газа прямо пропорциональна парциальному давлению газа над раствором. Поровая жидкость содержит определенное количество
Са(ОН)2 (0,06 1,2 г/л) в зависимости от основности продуктов твердения. Растворяясь, Н2S диссоциирует, в результате чего в растворе появляются ионы Н+ , HS-, S 2-. Причем концентрация S2- максимальна там, где наибольшая рН. В свою очередь, гидроксид кальция в поровой жидкости находится в диссоциированном (на ионы Са2+ и ОН-) состоянии, с максимальной концентрацией вблизи твердой фазы, с которой они находятся в равновесии. В результате химической реакции между ионом S2-
и Са2+ образуется СаS, но поскольку для его кристаллизации (выпадение
восадок) необходим определенный размер поры, то СаS будет образо-
вываться только в этом месте, а в остальном объеме поры СаS будет находиться в диссоциированном виде. Убыль Са2+ и S2- в результате реакции смещает химическое равновесие между газом и жидкостью и твердой фазой.
Следствием этого является растворение в жидкости новых порций сероводорода и гидролиз твердой фазы. Поскольку диффузия сероводорода замедляется с увеличением вязкости жидкости, а она, в свою очередь, растет с уменьшением радиуса пор, то можно предполагать, что диффузия
ионов HS- и S2- будет происходить только в капиллярных (более 50 нм) и части промежуточных (10–50 нм) порах. В гелевых порах, где вода находится в адсорбционно связанном состоянии, не будет условий для образования CaS. В этой связи можно предполагать, что при отсутствии влаги в капиллярных и промежуточных порах (при влажности 30 %) коррозии не будет.
Ускорение описанных процессов в присутствии углеводородов объясняется повышенной растворимостью сероводорода в конденсате углеводородов по сравнению с его растворимостью в воде (см. выше).
В порах цементного камня оседают микроскопические капельки конденсата, содержащие в себе растворенный сероводород, причем концентрация его здесь выше, чем в водном растворе при таких же условиях. Вследствие более высокой концентрации сероводорода повышается степень пересыщения по отношению к продуктам реакции коррозии (CaS), вероятность их образования возрастает, а критический устойчивый радиус новообразований уменьшается. В случае роста кристаллов
122 443
vk.com/club152685050 | vk.com/id446425943
новообразований (в данном случае CaS) в направлении стенки поры цементного камня наступает момент, когда растущая грань кристалла достигает поверхности препятствия, и стенки пор начинают испытывать кристаллизационное давление, приводящее к разрушению камня.
Следовательно, даже небольшое количество продуктов коррозии, накопленное в порах или перегибах пор, вызывает резкое падение прочности и разрушение цементного камня в результате развития высоких кристаллизационных давлений и появления очагов разрушения в наиболее слабых местах камня. Разрушение наступает, когда в химическое взаимодействие с агрессором вступила только небольшая часть продуктов твердения материала, в первую очередь, часть гидроксида кальция – наиболее активного по отношению к сероводороду. То есть достаточно прореагировать небольшому количеству гидроксида кальция, чтобы камень претерпел необратимые изменения своих структурно-механических характеристик.
Таким образом, основной причиной разрушения камня в условиях газовой сероводородной агрессии является развитие кристаллизационных давлений в отдельных точках камня (перегибах пор), играющих роль очагов поражения. Увеличение скорости разрушения камня в присутствии углеводородов объясняется ростом величины кристаллизационного давления.
Уменьшение среднего размера пор и рационализация структуры порового пространства повышают его стойкость к газовой сероводородной коррозии.
Данная схема справедлива только в том случае, когда сероводород взаимодействует с портландцементным камнем, имеющим рН ≥ 12,0, и продуктом химической реакции является сульфид кальция CaS:
Н2S + Ca(OH)2 = CaS + 2H2O.
В том случае, когда с сероводородом контактирует цементный камень, имеющий в составе продуктов твердения низкоосновные гидросиликаты кальция (рН ≤ 11,0), химическая реакция идет иначе:
Н2S + Ca(OH)2 = Ca(НS)2 + H2O.
Гидросульфид кальция Ca(НS)2, являясь легко растворимым соединением, остается в поровой жидкости, и через некоторое время между жидкой и твердой фазами наступает равновесие, т.е. процесс коррозии прекращается. Доказательством могут служить результаты промысловых экспериментов, проведенные сотрудниками УГНТУ и ВолгоУралНИПИгаз на скважинах Оренбургского ГКМ. На рисунке 13.53 показаны некоторые образцы цементов после 6 месяцев пребывания в газовом трубопроводе. Наибольшую стойкость показали образцы, имеющие рН ≤ 11, полученные из цементов с добавкой кремнезема. Портландцемент показал наименьшую стойкость к газообразному сероводороду.
444 |
123 |

vk.com/club152685050 | vk.com/id446425943
Портландцемент, В/Ц = 0,5;
Т = 80 оС; τ = 2 сут.
Портландцемент, В/Ц = 0,5; Т = 20 оС; τ = 2 сут.
Шлако-известково-кремнеземистое
вяжущее В/Ц = 0,5; Т = 120 оС; τ = 2 сут.
Портландцементно-известково-
зольное вяжущее В/Ц = 0,5; Т = 80 оС; τ = 2 сут.
Рис. 13.53. Результаты испытания цементов в газе Оренбургского ГКМ
Для получения тампонажного материала, стойкого в среде газообразного сероводорода, необходимо иметь цементный камень, имеющий равновесную рН продуктов твердения ниже 11. Это большинство высокотемпературных цементов.
Кроме указанных выше факторов в цементном камне необходимо ограничивать количество железосодержащих фаз. Необходимость этого требования обусловлена тем, что сероводород, являясь сильным восстановителем, способен вступить в химическую реакцию с оксидом железа по
уравнению:
Fe2O3 + 3H2S = 2FeS + 3H2O + S0 .
Поскольку оксид железа в портландцементе входит в состав минералов, а в цементном камне – в состав структурообразующих элементов, обеспечивающих прочность, то разрушение любого из них неизбежно ведет к частичному или полному разрушению камня. Поэтому при наличии большого количества оксидов железа в тампонажном материале следует ожидать развития деструктивных процессов, приводящих к его разрушению.
Железосодержащие фазы отсутствуют в известково-кремнеземистых, шлаковых, шлакопесчаных цементах.
124 |
445 |
vk.com/club152685050 | vk.com/id446425943
Коррозия цементного камня под действием растворенного в воде сероводорода
Взависимости от состава продуктов твердения цементный камень может иметь различную рН, и при контакте с сероводородной кислотой могут образоваться различные продукты коррозии.
При рН ≤ 11 образуются продукты химической реакции в виде
Са(НS)2, которые являются хорошо растворимыми и выносятся в окружающую среду. При рН ≥ 12 и более вероятно образование малорастворимого соединения СаS, выпадающего в осадок, который за счет взаимодействия с новыми порциями сероводорода переходит в Са(НS)2.
Врезультате химических реакций поровая жидкость обедняется щелочью, что приводит к нарушению термодинамического равновесия между твердой и жидкой фазами цементного камня. Продукты твердения про-
должают растворяться и гидролизуются с выделением свободной Са(ОН)2. Прежде всего, разрушается твердая фаза, представленная кристаллическим гидратом окиси кальция, высокоосновными алюминатами, гидросиликатом и гидроферритом кальция. Следовательно, механизм сероводородной коррозии под действием растворенного сероводорода близок к кислотной коррозии.
Нерастворимая часть цементного камня, химически инертная по от-
ношению к Н2S, образует буферную зону. Она представлена продуктами разложения гидратных фаз в виде гелей SiO2 ·nН2О, А1(ОН)3 и продуктами коррозии в виде твердой (FeS, CaS) и жидкой фазы (Са(НS)2). Является более проницаемой, чем исходный камень, так как реакционноспособная часть цементного камня в процессе гидролиза и растворения перешла в раствор, а затем в виде хорошо растворимых продуктов коррозии –
Са(НS)2 удалилась в окружающую среду.
Процесс коррозии цементного камня в условиях скважины под дейст-
вием агрессивных кислых сред (Н2S) может протекать при встрече потока агрессора с потоками растворимой фазы как в пределах прокорродированной части цементного камня, так и в пределах породы.
Сточки зрения долговечности крепи более предпочтительным является встреча потока агрессора и гидроксида кальция за пределами цементного камня, т.к. при этом внутрь камня не поступают ионы агрессивного флюида, не происходит депассивация металла обсадной колонны за счет сульфидов, гидросульфидов и гидрокарбонатов, а также исключается накопление в порах камня нерастворимых продуктов коррозии, обуславливающих возникновение внутренних напряжений в цементном камне и его объемное разрушение.
Практически все эти показатели являются управляемыми с помощью тех или иных технологических приемов, в частности:
-концентрация Са(ОН)2 в цементном камне – регулируется составом продуктов твердения;
446 |
125 |
vk.com/club152685050 | vk.com/id446425943
-концентрация Н2S в приствольной части пласта – может быть снижена за счет замены части агрессивного флюида на инертный по отношению к цементному камню;
-пористость цементного камня – может регулироваться начальным водосодержанием или технологией приготовления тампонажного раствора;
-пористость пласта в приствольной зоне – управляется кольматацией.
Физико-химические основы и средства управления термостойкостью тампонажных растворов
Рассматривая продукты твердения цементного камня можно говорить, что они отличаются друг от друга не только строением и химическим составом, но и основностью (C/S) – это соотношение количества CaO к SiO2 по молекулярной массе. При этом различают высокоосновные продукты твердения, у которых C/S ≥ 1,2, и низкоосновные, у которых C/S < 1,2.
Традиционные портландцементы могут применяться при температуре ниже 100 0С. При твердении в условиях более высоких температур они со временем начинают терять свою прочность. Причем, чем выше температура, тем быстрее происходит падение прочности. Одновременно с этим возрастает проницаемость цементного камня.
В основе данных явлений лежит термическая коррозия цемента, суть которой состоит в перекристаллизации продуктов твердения.
Возможны два вида перекристаллизации:
Внутрифазовая перекристаллизация, заключающаяся в том, что обра-
зовавшиеся при твердении цемента мельчайшие продукты твердения (например, гидросиликаты кальция), начинают укрупняться. При внутрифазовой перекристаллизации происходит растворение термодинамически менее устойчивых мелких кристаллов и выкристаллизация более крупных, т.е. идет самопроизвольный процесс сокращения удельной поверхности твердой фазы. В первую очередь растворяются контакты срастания, которые имеют искаженную кристаллическую решетку и поэтому термодинамически менее устойчивы по сравнению с кристаллами тех же размеров, образовавшимися в условиях свободного роста. При этом уменьшается количество контактов между кристаллами и прочность камня падает. Данные процессы протекают и при обычных температурах, однако их скорость мала, кроме того, падение прочности компенсируется за счет гидратации неизрасходованного цемента, находящегося в камне.
Межфазовая перекристаллизация, заключающаяся в том, что на пер-
вом этапе твердения в цементном камне образуются термодинамические неустойчивые фазы, которые начинают растворяться, и на их основе начинают образовываться новые более устойчивые фазы. Межфазовая перекристаллизация приводит к образованию кристаллических соединений иной кристаллической структуры. Выраженную склонность к внутрифазовой перекристаллизации имеют высокоосновные гидросиликаты кальция.
126 |
447 |
vk.com/club152685050 | vk.com/id446425943
Этим объясняется снижение прочности и повышение водопроницаемости цементного камня. Так, медленное снижение прочности цементного камня при температурах 20–75 оС, в основном, связано с укрупнением кристаллов, а быстрое снижение прочности при температурах более 100 оС – с межфазовой перекристаллизацией высокоосновных продуктов твердения.
Наибольшей склонностью межфазовых перекристаллизаций обладают высокоосновные продукты твердения, в которых C/S > 1,2.
Наиболее устойчивы к межфазовым перекристаллизациям низкоосновные соединения, в которых отношение С/S ≤ 1.
Наиболее эффективным способом предупреждения термической коррозии является уменьшение соотношения С/S в самом цементе. На практике этого можно достичь добавкой песка к цементу в количестве 40–45 %. Причем, чем выше температура твердения, тем больше должна быть крупность песка. Роль песка (SiO2) сводится к связыванию свободного Са(ОН)2 и понижению основности образующих продуктов твердения по уравнениям:
3СаО .SiО2 + Н2О → 3СаО . 2SiО2 . 3Н2О + 3Са(ОН)2; SiО2 + Са(ОН)2 → xСаО .ySiО2 .z Н2О.
При взаимодействии с водой клинкерных минералов, например, трехкальциевого силиката (C3S), всегда образуется свободный гидроксид кальция (Са(ОН)2), который взаимодействует с кремнеземом (SiO2), образуя новые продукты твердения – гидросиликаты кальция. Поскольку при этом происходит убыль свободного Са(ОН)2, то образовавшиеся ранее высокоосновные гидросиликаты кальция (3СаО . 2SiО2 . 3Н2О), устойчиво существующие только при наличии свободного Са(ОН)2, начинают гидролизоваться с выделением Са(ОН)2. Таким образом, SiO2 уменьшая количество Са(ОН)2, вызывает «разложение» высокоосновных гидросиликатов кальция с выделением свободного Са(ОН)2, который связывается новыми порциями растворенного кремнезема.
Свободный Са(ОН)2 может вступить в реакцию взаимодействия и при меньших температурах, однако для этого необходимо использовать активные аморфизированные модификации кремнезема. Это кремнезем, подвергшийся высокотемпературной обработке искусственно или в природных условиях, в результате чего кристаллическая решетка кремнезема деформировалась и стала реакционноспособной, например, золы сжигания каменных углей, микросферы, опока, высокообоженные глины.
13.6.7. Специальные виды цементов
Цементы для низких положительных и отрицательных температур
При твердении цементных растворов при пониженных температурах основной проблемой является низкие скорости твердения.
Применительно к креплению скважин в зонах многолетнемерзлых пород (ММП) это может привести к серьезным последствиям. В частности,
448 |
127 |
