
ЛЕКЦИЯ № 5
ТЕМА: «ЛЕКАРСТВЕННЫЕ СРЕДСТВА ИЗ ГРУППЫ СУЛЬФАНИЛАМИДОВ»
Лекарственные средства, изучаемые на лекции:
стрептоцид, сульфацил-натрий, фталазол.
План лекции.
1. Предпосылки создания сульфаниламидных препаратов.
2. Синтез сульфаниламидов.
3. Физические и химические свойства.
4. Испытания на подлинность.
5. Испытания на чистоту.
6. Методы количественного определения.
7. Идентификация и количественное определение сульфаниламидов физико-химическими методами.
8. Хранение и применение.
Предпосылки создания сульфаниламидных препаратов.
Сульфаниламидные препараты (далее сульфаниламиды) являются производными п-аминобензолсульфамида (амида сульфаниловой кислоты):
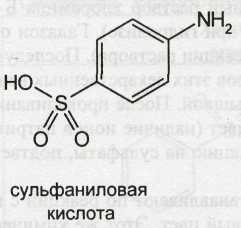
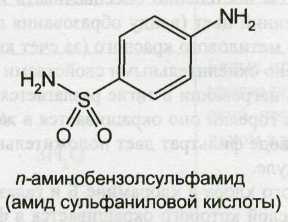
Амид сульфаниловой кислоты, являющийся родоначальником этой группы лекарственных веществ, был впервые синтезирован в 1908 г. Гельмо. Однако его уникальные лечебные свойства были обнаружены лишь 21 год спустя. В феврале 1935 г. в печати появилось сообщение венгерского ученого Домагка, которое открыло новую эру в химиотерапии. Домагк исследовал на мышах действие пронтозила, представляющего собой 4-сульфамидо-2,4-диаминоазобензол (красителя, полученного из амида сульфаниловой кислоты):
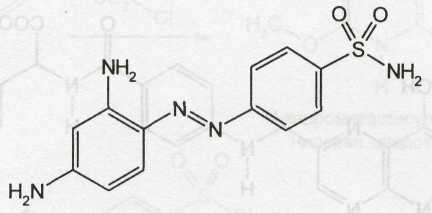
Эффект был поразительный. Все мыши, получившие предварительно по 10 смертельных доз культуры гемолитического стрептококка, после введения пронтозила остались живы, а все контрольные погибли. Работы Домагка положили начало широким исследованиям в области химиотерапевтического действия производных амида сульфаниловой кислоты. В конце 1935 г. работами супругов Трефуэль в Институте Пастера (Париж) было показано, что действие пронтозила обусловлено наличием в его молекуле амида сульфаниловой кислоты. Эта идея открыла путь для синтеза различных производных амида сульфаниловой кислоты и установления механизма их антибактериального действия.
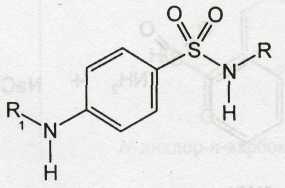
В 1935 г. О.Ю.Магидсон и М.В.Рубцов (ВНИХФИ), И.Я. Постовский (Свердловский филиал ВНИХФИ) провели систематические исследования сульфаниламидных препаратов. Синтезировано более 80 соединений этого ряда и установлена связь между химической структурой и противомикробным действием. Было показано, что химиотерапевтическое действие этой группы соединений является частным случаем активности веществ с общей формулой:
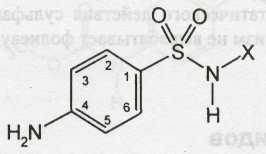
где X — Н, арил, алкил, гетероцикл.
Замена NH2-rpyппы в положении 4 другим радикалом (-СН3, -ОН, -С1, -СООН и др.) ведет к полной потере активности. Но активность сохраняется при наличии в положении 4 радикалов — CONH-; R=N-; НО-NH-; (CH3)2N- и др., которые при гидролизе или других химических превращениях образуют свободную аминогруппу. Перемещение аминогруппы из положения 4 в положение 2 или 3, а также введение дополнительных радикалов в бензольное ядро приводит к значительному снижению или полной потере активности сульфаниламидов.
При изучении влияния азогрупп на активность сульфаниламидов (вопреки утверждениям французских исследователей супругов Трефуэль) было доказано, что азогруппа в положении 4 придает этим соединениям более высокий терапевтический эффект по сравнению с аминогруппой. В последующие годы это нашло свое подтверждение в создании сульфаниламидов пролонгированного действия. Было также установлено, что химиотерапевтическое действие сульфаниламидов усиливается при введении кислотных остатков в аминогруппу и слабоосновных заместителей в сульфамидную часть молекулы. Замещение водорода в сульфамидной группе позволило получить соединения с пониженной токсичностью и различной степенью активности. Это явилось предпосылкой для синтеза многих производных амида сульфаниловой кислоты.
Проведенные теоретические исследования нашли свое практическое подтверждение. Уже через несколько месяцев после публикаций Домагка в нашей стране был разработан промышленный способ получения стрептоцида, а в последующие годы налажено производство других сульфаниламидов.
По современным представлениям механизм антибактериального действия сульфаниламидов заключается в следующем. Микроорганизмы в своём развитии синтезируют фолиевую кислоту, которая контролирует биосинтез аминокислот, пуриновых и пиримидиновых оснований. В химической структуре нормальной фолиевой кислоты содержится фрагмент п-аминобензойной кислоты. Однако в присутствии сульфаниламидов фермент, осуществляющий биосинтез фолиевой кислоты, вместо п-аминобензойной кислоты использует её имитатор — антагонист (сульфаниламидный фрагмент). В результате микроорганизм вместо фолиевой (I) синтезирует псевдофолиевую кислоту (II):
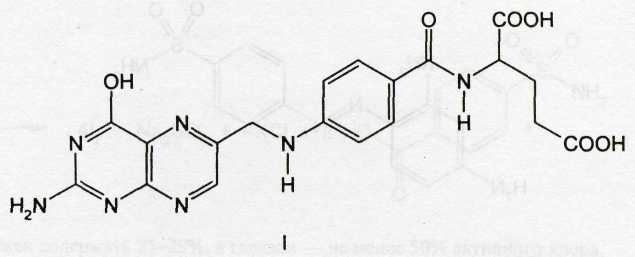
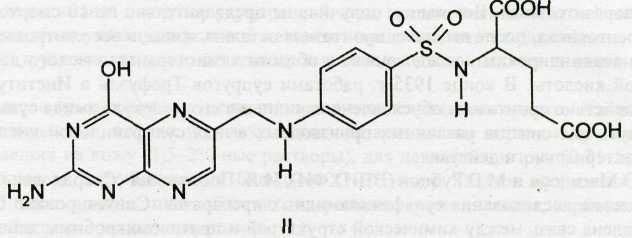
Указанные изменения в структуре блокируют образование нормальных метаболитов: дигидро- и тетра-гидрофолиевых кислот. При этом нарушается синтез нуклеиновых кислот и клеточных белков, что и лежит в основе бактерицидного и бактериостатического действия сульфаниламидов. На клетки человека они такого действия не оказывают, т.к. его организм не вырабатывает фолиевую кислоту, а получает её с пищей.
Синтез сульфаниламидов.
Сульфаниламид (стрептоцид) — структурная основа всех сульфаниламидных препаратов. В качестве источников получения сульфаниламида используют различные органические соединения с общей формулой:
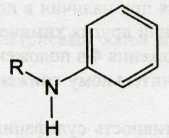
Синтез сульфаниламида осуществляют по указанной выше общей схеме получения амидов сульфокислот. Исходные продукты синтеза должны содержать ацилированную первичную ароматическую аминогруппу. Это позволяет предохранить ее от изменений в процессе синтеза. На последнем этапе синтеза ацилированный амин гидролизуют, получая первичный ароматический амин.
Впервые в нашей стране сульфаниламид был синтезирован О.Ю.Магидсоном и М.В.Рубцовым из ацетанилида. Известны также способы его получения из хлорбензола, форманилида, дифенилмочевины, фенилуретанов. Наиболее рациональным и экономичным является синтез сульфаниламидов из N-карбометоксисульфанилхлорида (фенилуретилансульфохлорида), который получают действием избытка хлорсульфоновой кислоты на N-фенилметилуретан:
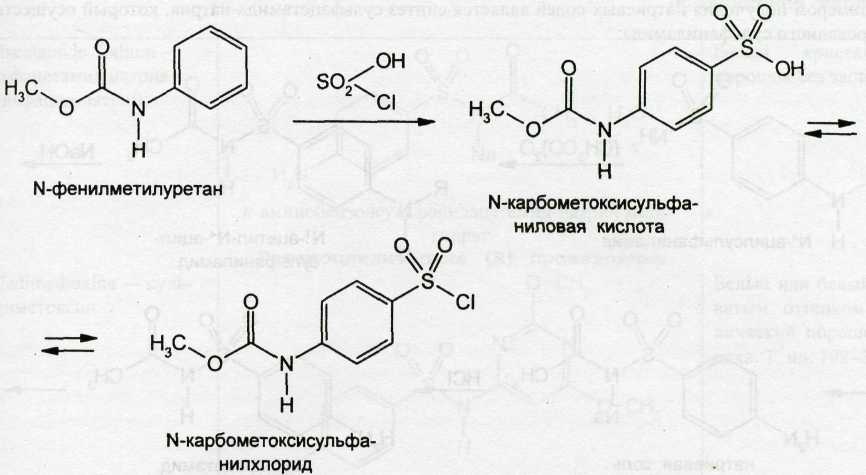
При последующем синтезе сульфаниламида (стрептоцида) действуют аммиаком. После этого уретановую группировку подвергают гидролизу:
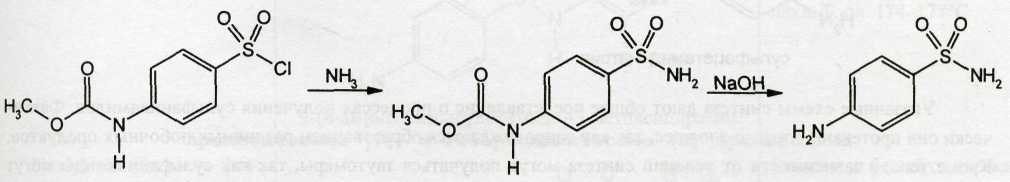
Примером получения натриевых солей является синтез сульфацетамида-натрия, который осуществляют из ацилированного сульфаниламида:
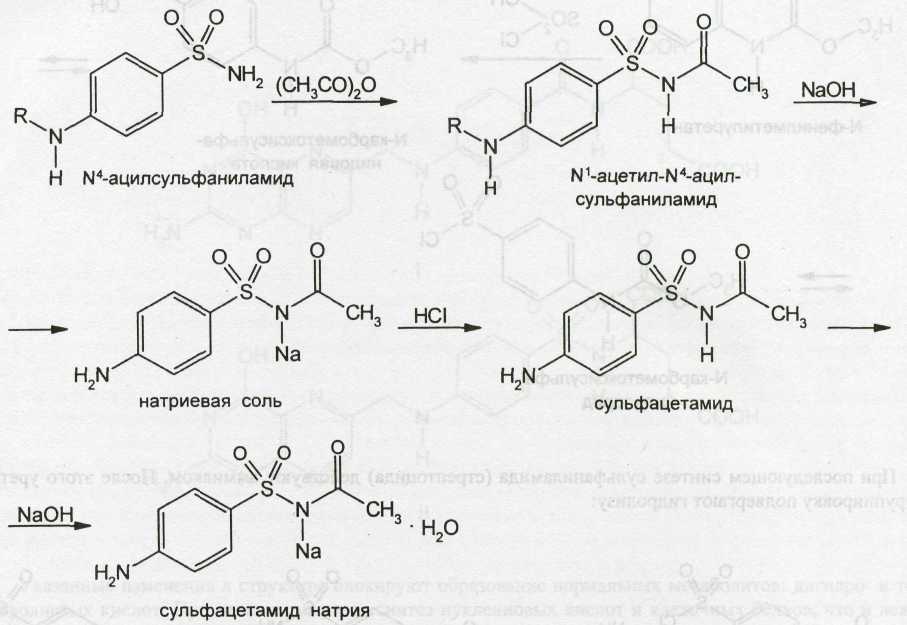
Указанные схемы синтеза дают общее представление о процессах получения сульфаниламидов. Фактически они протекают гораздо сложнее, так как сопровождаются образованием различных побочных продуктов. Кроме того, в зависимости от условий синтеза могут получаться таутомеры, так как сульфаниламиды могут существовать в амидо- и имидоформах. Более 60% сульфаниламидов имеют одну или несколько полиморфных модификаций. Например, стрептоцид — четыре, а кроме них моногидрат и два сольвата. Полиморфные формы, сольваты, гидраты образуются и видоизменяются в зависимости от условий кристаллизации, используемых растворителей, при сушке, измельчении и зависят от температурного режима при проведении этих процессов, а также от того, как хранятся сульфаниламиды.
Физические и химические свойства.
Сульфаниламиды представляют собой белые или белые с желтоватым оттенком кристаллические вещества без запаха.
Sulfanilamide — сульфаниламид (Стрептоцид)
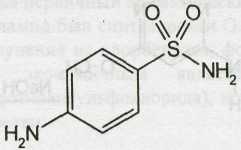
Белый кристаллический порошок без запаха. Т. пл. 164-167°С.
Sulfacetamide Sodium — сульфацетамид натрия (Сульфацил-натрий)
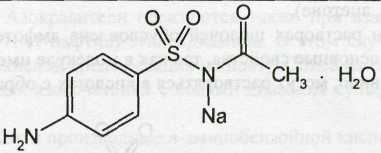
Белый кристаллический порошок без запаха.
Phtalylsulfathiazole — фталилсульфатиазол (Фталазол)
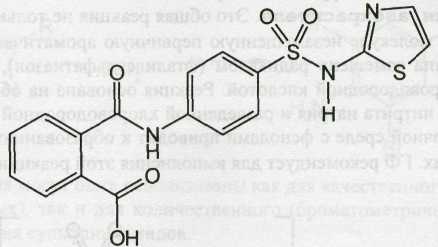
Белый или белый со слегка желтоватым оттенком порошок.
Сульфаниламиды мало растворимы или практически нерастворимы в воде и в таких органических растворителях, как этанол, эфир, хлороформ. Сульфаниламид умеренно растворим в этаноле. В ацетоне некоторые из них растворимы (сульфаниламид).
Натриевые соли сульфаниламидов (сульфацетамид натрия) легко растворимы в воде и метаноле (при комнатной температуре) и практически нерастворимы или мало растворимы в других органических растворителях (этаноле, эфире, хлороформе, ацетоне).
Растворимость в кислотах и растворах щелочей обусловлена амфотерными свойствами большинства сульфаниламидов. Они проявляют основные свойства, так как в молекуле имеется ароматическая аминогруппа. Поэтому сульфаниламиды, как правило, могут растворяться в кислотах с образованием солей (сильно гидролизованных в растворах):
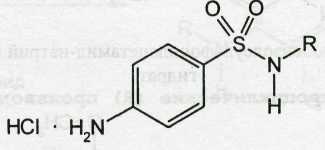
В разведенных кислотах при комнатной температуре нерастворим фталилсульфатиазол, в молекулах которого атом водорода первичной аминогруппы замещен ароматическим радикалом.
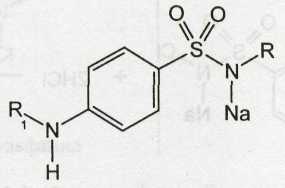
Кислотные свойства у сульфаниламидов выражены сильнее, чем основные. Они обусловлены наличием в молекуле группы -SO2-NH-, содержащей подвижный атом водорода. Вследствие этого сульфаниламиды образуют со щелочами соли:
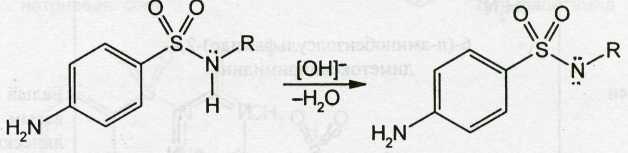
Поэтому все они легко растворяются в растворах щелочей.
