- •Техника безопасности
- •1. Электропроводность растворов электролитов
- •Электропроводность растворов электролитов
- •Удельная электропроводность
- •Кондуктометрическое титрование
- •Определение растворимости труднорастворимой соли.
- •Работа 1.1. Определение концентрационной зависимости удельной и молярной электропроводности сильного электролита
- •Порядок выполнения работы:
- •Работа 1.2. Определение константы диссоциации слабого электролита методом электропроводности
- •Порядок выполнения работы:
- •Работа 1.3. Кондуктометрическое титрование
- •Порядок выполнения работы:
- •Работа 1.4. Кондуктометрическое определение термодинамических параметров растворения труднорастворимого соединения
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •2. Электродвижущие силы Возникновение потенциалов на границах фаз.
- •Электродный потенциал
- •Водородный электрод
- •Измерение электродных потенциалов
- •Электрохимический (гальванический) элемент
- •Концентрационный гальванический элемент
- •Измерение эдс гальванического элемента компенсационным методом
- •Температурная зависимость эдс.
- •Электроды сравнения
- •Хлорсеребряный электрод
- •Окислительно-восстановительные электроды и их потенциалы
- •Мембранные равновесия. Стеклянный электрод
- •Кислотно-основные буферные системы
- •Механизм буферного действия
- •Буферная емкость
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Окислительно-восстановительных потенциалов
- •Порядок выполнения работы:
- •Буферной ёмкости буферных систем
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы Перед выполнением работы:
- •К защите работы:
- •3. Адсорбция
- •Метод полных концентраций
- •Термодинамика адсорбции по Гиббсу
- •Уравнение адсорбции Гиббса
- •Адсорбция из жидких растворов на поверхности твердых адсорбентов
- •Теплоты адсорбции
- •Работа 3.1. Изучение адсорбции паров воды на твердом адсорбенте
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.2. Изучение адсорбции уксусной кислоты из водного раствора на активированном угле
- •Интерферометрический метод анализа концентрации растворов.
- •Технология проведения адсорбции и методика определения равновесных концентраций растворов и расчета адсорбции по результатам эксперимента:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.3. Изучение адсорбции поверхностно-активных веществ (пав) на границе воздух-раствор
- •Измерение поверхностного натяжения жидкостей методом Ребиндера.
- •Расчет адсорбции на границе раздела водный раствор – воздух.
- •Порядок выполнения работы:
- •Проверка выполнимости правила Дюкло – Траубе
- •Перед выполнением работы:
- •К защите работы:
- •4. Газовая хроматография
- •Общие сведения о газовом хроматографе
- •Детекторы
- •Детектор по теплопроводности (дтп)
- •Пламенно-ионизационный детектор (пид)
- •Качественный и количественный анализ в газовой хроматографии.
- •Определение мольных теплот растворения газов и паров в жидкостях газохроматографическим методом
- •Порядок работы на хроматографе лхм-80
- •Работа 4.1. Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенным на хроматон.
- •Определение качественного состава смеси углеводородов по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов c6 - с9 .
- •Расчет поправочных коэффициентов для углеводородов c6 - с9 и определение количественного состава контрольной смеси углеводородов в мольных процентах.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.2. Определение мольных теплот растворения нормальных углеводородов c6- c9 в апьезоне хроматографическим методом
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.3. Определение индексов ковача веществ и их температурных коэффициентов на апьезоне
- •Перед выполнением работы:
- •К защите работы:
- •Химическая кинетика
- •Кинетические уравнения реакций различных порядков Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции n-го порядка
- •Способы определения порядков реакции.
- •Зависимость скорости реакции от температуры
- •Сложные реакции
- •Работа 5.1. Кинетика омыления этилацетата в присутствии ионов гидроксила.
- •Порядок выполнения работы:
- •Определение æ0.
- •Определение константы скорости реакции при разных температурах.
- •Определение энергии активации и предэкспоненциального множителя.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.2. Изучение кинетики гомогенно-каталитического разложения н2о2 .
- •Порядок подготовки установки к работе и работа на ней.
- •Порядок проведения кинетических опытов:
- •Варианты задания и методика расчетов.
- •Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
- •Влияние начальной концентрации н2о2 на период полупревращения. Определение порядка реакции.
- •III. Определение константы равновесия и константы скорости реакции разложения перекиси водорода.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.3. Изучение кинетики инверсии сахарозы.
- •Методика измерения угла вращения на поляриметре (сахариметре)
- •Методика измерения угла вращения на автоматическом поляриметре
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.4. Изучение кинетики реакции окисления иодид-ионов ионами трёхвалентного железа фотометрическим методом
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
Температурная зависимость эдс.
К электрохимическим цепям, находящимся при постоянном давлении применимо уравнение Гиббса-Гельмгольца
![]() ,
2.11
,
2.11
где ∆H-изменение энтальпии в ходе химической реакции.
Если ОВР(окислительно-восстановительная
реакция) является итогом электродных
процессов в электрохимической цепи и
соответствует прохождению через цепь
n электронов, то разделив все члены
уравнения (II.9) на nF и поменяв знаки, с
учетом соотношения![]() ,
получаем выражение
,
получаем выражение
![]() 2.12
2.12
где величина
![]() называется температурным коэффициентом
ЭДС.
называется температурным коэффициентом
ЭДС.
Так, как
![]() , то
, то
![]() 2.13
2.13
Таким образом, температурный коэффициент ЭДС характеризует изменение энтропии ∆S в ходе соответствующей химической реакции, а величина ∆ H характеризует общий тепловой эффект химической реакции при ее обратимом протекании в условиях постоянного давления. Гальванические элементы являются электрохимическими цепями с самопроизвольно протекающими химическими реакциями, для которых E > 0.
Если (dE/dT) < 0, то ОВР, протекающая в гальваническом элементе, может быть только экзотермической (∆H<0).Поскольку при протекании реакции энтропия уменьшается S<0 (см. 2.12), то работа гальванического элемента должна сопровождаться выделением теплоты. Следовательно, в условиях теплоизоляции электрохимическая система будет нагреваться. Таким образом, при работе гальванического элемента в условиях (dE/dT )<0 за счет убыли энтальпии совершается электрическая работа nFE и выделяется теплота в количестве nFТ(dE/dT).
Аналогичным образом можно показать, что если (dE/dT).>0, то при работе такого элемента будет происходить поглощение теплоты из окружающей среды. В случае теплоизоляции электрохимической цепи, она будет охлаждаться.
Если (dE/dT)=0, то реакция может быть только экзотермической. В этом случае ∆S=0 и работа гальванического элемента, совершаемая за счет убыли энтальпии, не должна сопровождаться тепловыми эффектами.
Электроды сравнения
Потенциометрические методы основаны на измерении электродных потенциалов, которые зависят от концентрации ионов в растворе. Поскольку измерить абсолютное значение электродного потенциала невозможно, на практике измеряют ЭДС цепи, составленной из двух электродов, т.е. разность потенциалов измерительного электрода и электрода сравнения, потенциал которого известен, практически постоянен и хорошо воспроизводится. Этим условиям удовлетворяют водородный, каломельный и хлорсеребряный электроды сравнения.
Водородный электрод сложен по конструкции, а его потенциал зависит от трудно контролируемых факторов. Его нельзя использовать для измерений в растворах, содержащих сильные окислители, которые отравляют платину. Поэтому на практике в качестве электродов сравнения применяют более простые электроды, потенциалы которых предварительно точно определены относительно стандартного водородного электрода.
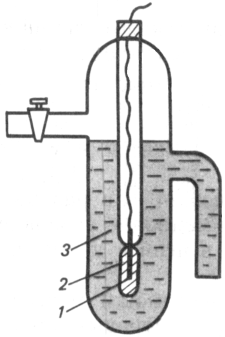
Хлорсеребряный электрод
Хлорсеребряный электрод (рис. II.7) представляет собой серебряный электрод (1), часть поверхности которого электролитически покрыта слоем труднорастворимой соли AgCl (2). Он погружен в насыщенный раствор хлорида серебра AgCl в хлориде калия KCl (3). На границе раздела металл - раствор протекает окислительно-восстановительная реакция
AgCl + e- == Ag + Cl-.
Рис. 2.7. Хлорсеребряный электрод
|
Потенциал такого электрода второго рода, согласно уравнению Нернста, определяется концентрацией катионов серебра в растворе:
где
|
Концентрацию ионов Ag+ определим из произведения растворимости L для AgCl:
LAgCl
= CAg+ × CCl-,
тогда
![]() =
L AgCl
/ C Cl-
=
L AgCl
/ C Cl-
С учетом последнего выражения запишем уравнение (4.14) в виде:
![]() 2.15
2.15
Поскольку величины
![]() и
и
![]() постоянны при данной температуре,
последнее уравнение принимает вид:
постоянны при данной температуре,
последнее уравнение принимает вид:
![]() 2.16
2.16
где
![]() - стандартный потенциал
хлорсеребряного электрода. Из уравнения
(II.16)следует, что потенциал хлорсеребряного
электрода определяется концентрацией
ионов Cl - в растворе.
Потенциал хлорсеребряного электрода
в насыщенном растворе KCl зависит только
от температуры, он хорошо воспроизводится,
и его величина относительно стандартного
водородного электрода рассчитывается
по формуле
- стандартный потенциал
хлорсеребряного электрода. Из уравнения
(II.16)следует, что потенциал хлорсеребряного
электрода определяется концентрацией
ионов Cl - в растворе.
Потенциал хлорсеребряного электрода
в насыщенном растворе KCl зависит только
от температуры, он хорошо воспроизводится,
и его величина относительно стандартного
водородного электрода рассчитывается
по формуле
ЕAgCl = 0.2224 - 0.00065 (t -25) [В]. 2.17
Если при измерении электродных потенциалов Ex в качестве стандарта используются разные электроды сравнения, например, хлорсеребряный и каломельный, то получают разные значения электродных потенциалов, отличающиеся друг от друга на значение разности потенциалов между различными электродами сравнения
(Ex =Eизм.- Eстанд.).