
- •Техника безопасности
- •1. Электропроводность растворов электролитов
- •Электропроводность растворов электролитов
- •Удельная электропроводность
- •Кондуктометрическое титрование
- •Определение растворимости труднорастворимой соли.
- •Работа 1.1. Определение концентрационной зависимости удельной и молярной электропроводности сильного электролита
- •Порядок выполнения работы:
- •Работа 1.2. Определение константы диссоциации слабого электролита методом электропроводности
- •Порядок выполнения работы:
- •Работа 1.3. Кондуктометрическое титрование
- •Порядок выполнения работы:
- •Работа 1.4. Кондуктометрическое определение термодинамических параметров растворения труднорастворимого соединения
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •2. Электродвижущие силы Возникновение потенциалов на границах фаз.
- •Электродный потенциал
- •Водородный электрод
- •Измерение электродных потенциалов
- •Электрохимический (гальванический) элемент
- •Концентрационный гальванический элемент
- •Измерение эдс гальванического элемента компенсационным методом
- •Температурная зависимость эдс.
- •Электроды сравнения
- •Хлорсеребряный электрод
- •Окислительно-восстановительные электроды и их потенциалы
- •Мембранные равновесия. Стеклянный электрод
- •Кислотно-основные буферные системы
- •Механизм буферного действия
- •Буферная емкость
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Окислительно-восстановительных потенциалов
- •Порядок выполнения работы:
- •Буферной ёмкости буферных систем
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы Перед выполнением работы:
- •К защите работы:
- •3. Адсорбция
- •Метод полных концентраций
- •Термодинамика адсорбции по Гиббсу
- •Уравнение адсорбции Гиббса
- •Адсорбция из жидких растворов на поверхности твердых адсорбентов
- •Теплоты адсорбции
- •Работа 3.1. Изучение адсорбции паров воды на твердом адсорбенте
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.2. Изучение адсорбции уксусной кислоты из водного раствора на активированном угле
- •Интерферометрический метод анализа концентрации растворов.
- •Технология проведения адсорбции и методика определения равновесных концентраций растворов и расчета адсорбции по результатам эксперимента:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.3. Изучение адсорбции поверхностно-активных веществ (пав) на границе воздух-раствор
- •Измерение поверхностного натяжения жидкостей методом Ребиндера.
- •Расчет адсорбции на границе раздела водный раствор – воздух.
- •Порядок выполнения работы:
- •Проверка выполнимости правила Дюкло – Траубе
- •Перед выполнением работы:
- •К защите работы:
- •4. Газовая хроматография
- •Общие сведения о газовом хроматографе
- •Детекторы
- •Детектор по теплопроводности (дтп)
- •Пламенно-ионизационный детектор (пид)
- •Качественный и количественный анализ в газовой хроматографии.
- •Определение мольных теплот растворения газов и паров в жидкостях газохроматографическим методом
- •Порядок работы на хроматографе лхм-80
- •Работа 4.1. Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенным на хроматон.
- •Определение качественного состава смеси углеводородов по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов c6 - с9 .
- •Расчет поправочных коэффициентов для углеводородов c6 - с9 и определение количественного состава контрольной смеси углеводородов в мольных процентах.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.2. Определение мольных теплот растворения нормальных углеводородов c6- c9 в апьезоне хроматографическим методом
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.3. Определение индексов ковача веществ и их температурных коэффициентов на апьезоне
- •Перед выполнением работы:
- •К защите работы:
- •Химическая кинетика
- •Кинетические уравнения реакций различных порядков Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции n-го порядка
- •Способы определения порядков реакции.
- •Зависимость скорости реакции от температуры
- •Сложные реакции
- •Работа 5.1. Кинетика омыления этилацетата в присутствии ионов гидроксила.
- •Порядок выполнения работы:
- •Определение æ0.
- •Определение константы скорости реакции при разных температурах.
- •Определение энергии активации и предэкспоненциального множителя.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.2. Изучение кинетики гомогенно-каталитического разложения н2о2 .
- •Порядок подготовки установки к работе и работа на ней.
- •Порядок проведения кинетических опытов:
- •Варианты задания и методика расчетов.
- •Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
- •Влияние начальной концентрации н2о2 на период полупревращения. Определение порядка реакции.
- •III. Определение константы равновесия и константы скорости реакции разложения перекиси водорода.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.3. Изучение кинетики инверсии сахарозы.
- •Методика измерения угла вращения на поляриметре (сахариметре)
- •Методика измерения угла вращения на автоматическом поляриметре
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.4. Изучение кинетики реакции окисления иодид-ионов ионами трёхвалентного железа фотометрическим методом
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
Водородный электрод
Водородный электрод (рис. 2.4) представляет собой электрод из платинированной платины (1), помещенный в раствор кислоты (2). Он омывается потоком газообразного водорода при давлении 101,3 кПа (» 1 атм). Водород в этой системе находится в трех состояниях: в молекулярной форме (Н2, газ), в атомарной (НPt на поверхности платины) и окисленной форме (ионы Н+ в растворе электролита). Молекулы водорода адсорбируются на поверхности электрода, диссоциируют на атомы, и непосредственно в электродном процессе участвуют адсорбированные на платине атомы водорода:
Н+(раствор) + e-==HPt,
2HPt == H2 (газ).
Суммарная электродная реакция
2Н+(раствор) + 2e- == H2 (газ)
протекает на поверхности платины с участием ее электронов. где Eo - стандартный потенциал водородного электрода; P - давление газообразного водорода; СН+ - концентрация Н+ в растворе.
|
Количественно электродный потенциал такого электрода описывается уравнением Нернста, в котором концентрация восстановленной формы водорода выражена, в соответствии с законом Генри, через растворимость водорода в электролите(CH2= kPH2) :
|
Если концентрация ионов водорода в растворе 1моль× л-1, а давление газообразного водорода 1 атм, такой водородный электрод называется стандартным (нормальным). Стандартные электродные потенциалы металлических электродов, определенные по отношению к нормальному водородному электроду при 25оС, составляют ряд напряжений металлов.
Измерение электродных потенциалов
Потенциал стандартного водородного электрода при всех температурах принят равным нулю, тогда электродный потенциал любого другого электрода можно определить как ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного. В схеме цепи слева записывают водородный электрод. Так, для определения электродного потенциала медного электрода составляют элемент:
Pt, H2│H+ ║Cu2+│Cu
Из опыта известно, что в такой системе медный электрод является положительным (на нем самопроизвольно протекает реакция восстановления меди Cu+2 +2e- = Cu), а водородный электрод – отрицательным. ЭДС этого элемента, представленная в виде алгебраической суммы электродных потенциалов, равна:
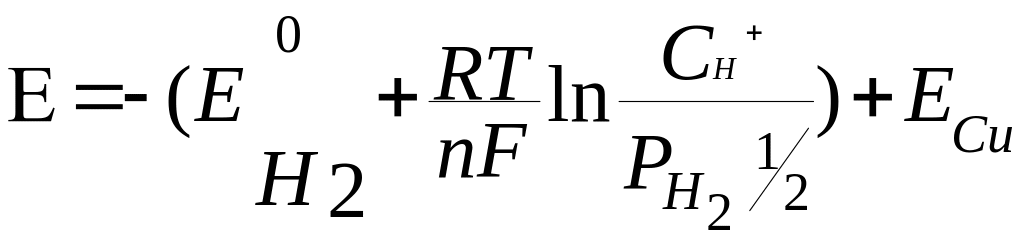 2.5
2.5
При
![]() = 1 моль× л-1
и
= 1 моль× л-1
и
![]() = 1 атм
(т.е. при использовании стандартного
водородного электрода)
= 1 атм
(т.е. при использовании стандартного
водородного электрода)
![]() . Принимая во внимание, что
. Принимая во внимание, что
![]() = 0, получаем E = ECu. Таким
образом ЭДС этого гальванического
элемента (а значит и электродный потенциал
меди) положительны (E = ECu >
0) .
= 0, получаем E = ECu. Таким
образом ЭДС этого гальванического
элемента (а значит и электродный потенциал
меди) положительны (E = ECu >
0) .
Для нахождения знака электродного потенциала цинкового электрода составляют элемент:
Pt, H2│H+ ║ Zn2+│Zn.
Из опыта известно, что цинковый электрод является отрицательным (на нем протекает реакция окисления цинка , ЕZn < 0), тогда водородный электрод будет положительным относительно цинкового(протекает реакция восстановления). ЭДС элемента E, представленная в виде алгебраической суммы электродных потенциалов, равна:
.
![]() ,
учитывая, что
,
учитывая, что
![]() получаем E = -
ЕZn.
получаем E = -
ЕZn.
Значит, ЭДС этого элемента (т.е. электродный потенциал цинка) отрицательна. Таким образом, электродный потенциал металла численно равен ЭДС (со знаком ²+² или ²-²) гальванического элемента, составленного из стандартного водородного электрода (слева) и исследуемого электрода (справа).

 Рис. 2.4. Схема водородного электрода.
Рис. 2.4. Схема водородного электрода.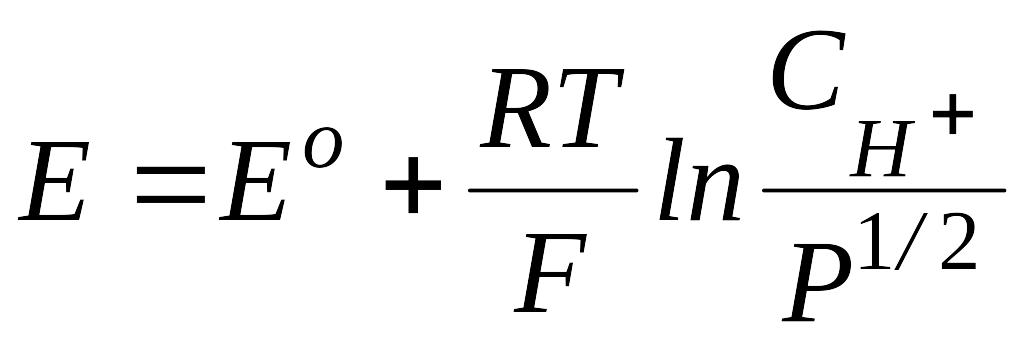 ,
2.4
,
2.4