
- •Развитие производства благородных металлов
- •Производство серебра
- •Применение благородных металлов
- •Поведение благородных металлов в различных средах
- •Азотно-кислые среды
- •Солянокислая среда
- •Аммиачные системы
- •Нитритные системы
- •Гидроксиды пм
- •Руды и минералы Au, Ag. Формы нахождения Au, Ag в рудах
- •Формы нахождения
- •Пробность
- •Схемы переработки кварцевых руд
- •Блок-схема переработки кварцево-сульфидных руд
- •Механическая подготовка руды
- •I. Метод амальгамации
- •II. Плавка золотой головки
- •III. Гидрометаллургичесие методы
- •Цианирование золотосодержащих руд
- •Химизм процесса
- •Термодинамика процесса
- •Кинетика процесса
- •Факторы, влияющие на процесс цианирования
- •III. Влияние температуры
- •IV. Вязкость пульп
- •VI. Крупность частиц руды и золота
- •VII. Состав золотин
- •Электрохимическая природа цианирования
- •Потери цианида
- •Практика цианирования
- •Схемы цианирования
- •II. Метод кучного выщелачивания
- •Хвостывосты
- •П ачуки. Рисунок 17.
- •Разделение золотосодержащих пульп
- •Цементация Zn
- •Электрохимическая природа цементации
- •Влияние примесей на процесс
- •Практика цементации
- •Переработка Au-Zn осадков (цианшламов)
- •Методы переработки
- •Свойства смол-сорбентов
- •Свойства смол. К смолам предъявляются следующие требования :
- •Закономерности сорбционного выщелачивания
- •Кинетика и механизм сорбции
- •Практика сорбционного выщелачивания
- •Параметры сорбционного выщелачивания
- •Аппаратура сорбционного цианирования
- •Регенерация смолы
- •Электролитическое выделение Au из тиомочевинного элюата
- •Устройство электролизной ванны
- •Сорбция на активированных углях
- •Особенности углеродистых сорбентов
- •Области применения активированных углей
- •Обезвреживание сточных вод зиф
- •Аффинаж золота и серебра
- •Хлорный процесс
- •Ag выделяют двумя способами:
- •Поведение примесей
- •Аппаратурное оформление
- •Ванны с горизонтальным расположением электродов
- •Электролитическое рафинирование Au
- •Поведение примесей
- •Аппаратура
Области применения активированных углей
Извлечение золота из растворов кучного выщелачивания. Растворы бедны по золоту, содержат много примесей. Уголь как правило сжигается, получается золотой осадок.

2. Извлечение золота и серебра из растворов по переработке Pb-Zn руд обогатительных фабрик;
3. Извлечение золота, серебра из растворов хвостохранилищ ЗИФ;
4. Использование активированных углей для извлечения золота и серебра из технологии сорбционного выщелачивания “уголь в пульпе”.
Для шламистых руд используют с осторожностью из-за возможности забивания пор сорбента .
Технология аналогичнa технологии сорбционного выщелачивания с использованием ионитов:
-предварительное выщелачивание;
-сорбционное выщелачивание (4-5 колонн);
- регенерация.
Регенерация насыщенных углей ведется по схеме, включающей:
- oбработку раствором :
0,1-0,2% NaCN и 1-2% NaOH
a) t=200С Т= 5 3 суток;
b) t=1300C (в автоклаве) Т=10 12 ч.
[Au(CN)2]- на выделение золота
- рециркуляция угля.
CaCO3 , смоляные вещества, масла, примеси удаляют раствором HCl и прокалкой без доступа воздуха в трубчатой вращающейся печи. Получают регенерированный уголь. Из цианистого раствора золото выделяют электролизом. Применяют электролизеры цилиндрической формы с катодом из стальной ваты.
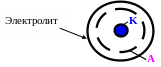
Полученный катодный осадок Fe-Au(Ag) подвергается переплавке с добавкой окислителя (селитра) и образованием шлака (сода и бура). Получают сплав золота пробы 900 и выше.
Недостаток технологии: высокие потери угля.
Обезвреживание сточных вод зиф
Для переработки 1 т руды на фабриках расходуется:
- 0,2 – 1,5 кг/т NaCN;
- 0,5 – 1,3 кг/т каустической соды;
- 0,3 – 0,9 кг/т H2SO4;
- 0,2 – 0,5 кг/т Thio;
- 3,0 – 9,0 кг/т извести, ртути и другие реагенты.
Поэтому сточные воды фабрик содержат токсичные элементы, основным из которых является CN—, а также CNS—, Hg, As и некоторые др. Поэтому продукты обработки, выбрасываемых в отвал (хвосты сорбционного выщелачивания, обеззолоченные растворы после цементации золота, кеки фильтрации пульп цианирования и др.) должны быть обезврежены до ПДК.
Содержание токсичных веществ в продуктах и ПДК на них могут колебаться в следующих пределах. Таблица
Для рыбно – хозяйственных нужд (1)
 Для
хозяйственных нужд (2)
Для
хозяйственных нужд (2)
|
C ж.ф , мг/л |
ПДК, мг/л |
CN— CNS— Cl— (акт.) As Pb Fe Cu Thio Hg |
32-570 13-420 100-500 0,1-4,0 0,5-200 0,01-6,0 0,1-6,0
0,1-0,5 |
0,1-0,05 0,1-0 0-0 0,05-0,01 0,1-0,1 0,5-0,25 1,0-0,1 0,03-0 0,015-0,001 |
Цианид может находится в следующих соединениях:
1.Простые растворимые токсичные соединения NaCN, KCN, HCN
2.Комплексные растворимые токсичные соединения:
[Cu(CN)3]2— , [Zn(CN)4]2—
3. Растворимые нетоксичные соединения:
[Fe(CN)6]4— и [Fe(CN)6]3—
Эти соединения в кислой среде, например под действием желудочного сока разлагается на:FeCl3, NaCN, HCN- токсичные соединения.
4. нерастворимые нетоксичные простые цианиды Cu(CN)2 и Fe(CN)2
в кислой среде также разлагаются с образованием токсичных соединений.
5. комплексное нерастворимое соединение Fe4[Fe(CN)6]3.
Ион [Fe(CN)6]4- под действием О2 в водной среде переходит в [Fe(CN)6]3- + OH-. Далее ион гидрализует :
[Fe(CN)6]3- + Н2О Fe(OH)3 + HCN
Роданиды могут находиться в форме:
- NaCNS;
- комплексных соединений.
Методы обезвреживания
Hейтрализация цианистых растворов с отгонкой образующихся HCN и последующим улавливанием ее щелочным раствором.
Исходная пульпа (рН=10 11) подкисляется H2SO4 до рН=2,5 2,8.
При этом под действием H2SO4 происходит разложение простых и некоторых комплексных соединений.
NaCN + H2SO4 = HCN + Na2SO4
[Zn(CN)4]2- + H2SO4 HCN +ZnSO4
НСN удаляется в газовую фазу, улавливается NaOH , происходит регенерация NaCN (достоинство метода).
Недостатки: не регенерируется значительная часть комплексных соединений, поэтому очистки до ПДК не происходит.
2. Oбработка цианистой пульпы сульфатом Fe(II) (солью Мора).
Преследуется цель: связать простые растворимые токсичные соединения в
нетоксичные растворимые или нерастворимые соединения: Fe(CN)6]3- , [Fe(CN)6]4- , Fe(CN)2.
Недостатки:
- очистки до ПДК нет ;
- не разрушаются CNS– ;
- возможен переход нетоксичных соединений снова в токсичные.
3. Oкислительные методы;
Суть их основана на обработке цианистой пульпы окислителями, которые окисляют все группы цианистых соединений и роданидов, разрушают при этом CN– , переводя его в безвредные CO32- , NH4+ или N2.
Очистка этими методами ведется до ПДК.
Действующим методом в этой группе является:
a) Xлорный метод;
В качестве окислителя используют NaClO, Ca(ClO)2, CaOCl2 или Cl2.
CN- + ClO- = CNO- + Cl- ;
хлорат- цианат-
ион ион
CNO- +2H2O = CO32- + NH4+;
CNS- +4ClO + 2OH- = CNO- + 4Cl- + SO42- + H2O;
[Cu(CN)3]2 + 7ClO + 2OH + H2O = 2Cu(OH)2 + 6CNO + 7Cl.
Обезвреживание с помощью жидкого хлора ведется по следующей схеме:
Достоинства: очистка до ПДК.
Недостатки:
- использование токсичного хлор-газа;
- дорогой метод ;
- образование ионов хлора, что приводит к “засаливанию” воды.


б) Метод озонирования
Считается перспективным.
В качестве окислителя используется озон : О3=О2 + О
Он образуется при воздействии электрического разряда на воздух (или кислород):
CN + O = CNO
CNO + H2O = CO32 + NH4+ и т.д.
Очистка ведется до ПДК, но не нужны ни какие дополнительные реагенты и не образуется побочных продуктов.
Недостаток: высокая стоимость электроэнергии необходимой для получения озона.
в) Анодное окисление
Заключается в пропускании раствора через электролизер с нерастворимыми анодами и катодами. Метод применяют для пульп с высокой концентрацией CN.
На аноде:
CN + 2OH = CNO+ 2H2O +2e;
[Cu(CN)3]2 + 8OH = Cu(OH)2 + 3CNO + 3H2O +7e;
CNS + 10OH = CNO + SO42 + 5H2O +8e
2CNO + 4OH = 2CO2 + N2 + 2H2O +6e
Недостатки: высокий расход электроэнергии.
Известны и другие методы (сорбции на анионитах, экстракция ), не вышедшие из стадии лабораторных исследований.
Очистка от As
И
гидролиз
 ClO
+ FeSO4
Fe2
(SO
4)3
Fe(OH)3,
ClO
+ FeSO4
Fe2
(SO
4)3
Fe(OH)3,
который является эффективным сорбентом As.
Очистка идет до ПДК.
Очистка от Hg
Метод основан на малой растворимости в водных средах сульфида Hg (HgS). Для образования этого соединения вводят сульфид Na:
Na2S + HgCl2 = HgS + 2NaCl (Пр=1050)
Очистка идет до ПДК.
!!! Oбезвреживаниe сточных вод является обязательным, но неокончательным решением вопросов охраны окружающей среды.
С целью обеспечения более экологически чистой обстановки на фабриках рекомендуют использовать оборотное водоснабжение.
4 + FeCl2 + Na2SO4
