
- •Квантовая физика
- •Квантовые свойства электромагнитного излучения (эми) Тепловое излучение (ти)
- •Фотоэффект
- •Тормозное рентгеновское излучение
- •Корпускулярно-волновой дуализм
- •Эффект Комптона
- •Атом Резерфорда-Бора. Формула Резерфорда
- •Дифференциальное сечение
- •Спектральные закономерности
- •Постулаты Бора
- •Опыт Франка и Герца (1913)
- •Модель атома Бора
- •Спектральные серии водородоподобных систем
- •Магнитный момент атома водорода
- •О теории Бора
- •Волновые свойства частиц
- •Опыты Дэвисона и Джермера (1927)
- •Опыты Томсона и Тартаковского
- •Другие опыты
- •Парадоксальное поведение микрочастиц
- •Критерий классического описания
- •Принцип неопределенности
- •Опыт со щелью
- •Размер атома водорода
- •Состояние частицы
- •Принцип суперпозиции
- •Уравнение Шредингера
- •Стационарные состояния
- •Квантование
- •Частица в прямоугольной яме
- •Квантовый гармонический осциллятор
- •Колебания в молекуле
- •П отенциальные барьеры
- •Туннельный эффект
- •Средние значения физических величин
- •Операторы
- •Основные постулаты квантовой теории
- •Квантование момента импульса
- •П роекция момента импульса
- •Ротатор
- •Квантование атомов
- •Плотности распределения вероятности
- •Правило отбора
- •Тонкая структура спектральных линий
- •Спин электрона
- •Полный момент импульса электрона
- •Механический момент многоэлектронного атома
- •Правила отбора
- •Принцип Паули
- •О периодической системе Менделеева
- •Характеристические рентгеновские спектры
- •Магнитные свойства атома
- •Опыт Штерна и Герлаха
- •Спиновой магнитный момент
- •Полный магнитный момент атома
- •Эффект Зеемана(1896)
- •П ростой эффект Зеемана
- •Сложный эффект Зеемана
- •Эффект Пашена-Бака
- •Электронный парамагнитный резонанс
- •Атомное ядро Некоторые сведения о ядре
- •Размеры ядра
- •Спин ядра(I)
- •Масса и энергия связи ядра
- •Удельная энергия связи
- •Механизм взаимодействия нуклонов
- •Модели ядра
- •Радиоактивность
- •Закон радиоактивного распада
- •Типы радиоактивности
- •Ядерные реакции
- •Выход ядерной реакции
- •Энергия реакции
- •Квантовые статистики (кс)
- •Фазовые ячейки
- •Квантовые распределения
- •Число фазовых ячеек
- •Распределение частиц
- •Свободные электроны в металле
- •Энергия Ферми
- •Зонная теория твердого тела Предпосылки возникновения зонной теории
- •Образование электронных зон
- •Характеристика энергетических зон
- •Металлы, диэлектрики и полупроводники
- •Собственная проводимость полупроводников (п/п)
- •Примесная проводимость полупроводников
- •Электропроводность металлов
- •Энергия молекулы
- •Элементарные частицы
- •Фундаментальные взаимодействия
- •Хронология
- •Систематика
- •Античастицы
- •Законы сохранения
- •Заряды элементарных частиц
- •Странность
- •Шарм (очарование) и красота (прелесть)
- •Четность
- •Изотопический спин
- •Кварковая модель адронов
- •Современная картина мира
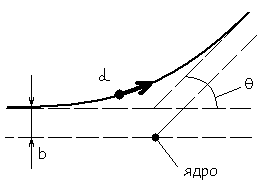
Атом Резерфорда-Бора. Формула Резерфорда
В
1911 г. Резерфорд по результатам опытов
прохождения
 -частиц
сквозь тонкую фольгу обнаружил, что:
-частиц
сквозь тонкую фольгу обнаружил, что:
1
α
 )
основная часть
-частиц
испытывает незначительное отклонение
≤3°;
)
основная часть
-частиц
испытывает незначительное отклонение
≤3°;
2) крайне малое число -частиц испытывает неожиданно большое отклонение > 90°, откуда следует, что атом должен содержать ядро, размеры которого ~ в 105 раз меньше размеров атома и составляют порядка 10-12 см;
3) траектория полета -частицы имеет вид:
b
– прицельный
параметр,
 - угол отклонения;
- угол отклонения;
4) формула
распределения рассеянных
-частиц:
 , где q
и q0
– заряды налетающей частицы и ядра; К
– кинетическая энергия частицы вдали
от ядра.
, где q
и q0
– заряды налетающей частицы и ядра; К
– кинетическая энергия частицы вдали
от ядра.
5) прицельный параметр b измерению не доступен и Резерфорд связал его изменение в интервале (b, b+db) с изменением угла рассеивания в интервале ( , +d ), а затем и с телесным углом dΩ, в пределах которого заключены все углы рассеивания ( , +d ).
Тогда
формула
Резерфорда:
 ,
где
,
где
 -
относительное число частиц, имеющих
прицельный параметр b
в интервале (b,
b
+ db),
рассеянных в телесном угле dΩ
под углом
к первоначальному направлению их
движения, n
– число ядер металла фольги на единицу
её поверхности.
-
относительное число частиц, имеющих
прицельный параметр b
в интервале (b,
b
+ db),
рассеянных в телесном угле dΩ
под углом
к первоначальному направлению их
движения, n
– число ядер металла фольги на единицу
её поверхности.
Для определения относительного числа
 частиц,
рассеянных в интервале (
1,
2)
формулу Резерфорда интегрируют с
учетом
частиц,
рассеянных в интервале (
1,
2)
формулу Резерфорда интегрируют с
учетом
 .
.Формула Резерфорда неприменима к малым (<3°) углам.
Дифференциальное сечение
Если
b
изменяется в интервале (b,
b
+ db),
то
изменяется в(
,
+ d
).
Рассмотрим кольцо радиуса b
и ширины db.
Его площадь
 .С
учетом
.С
учетом
 формула Резерфорда:
формула Резерфорда:
 или
или ,
где
,
где
![]() – дифференциальное
сечение.
– дифференциальное
сечение.
Введение
 упрощает расчеты.
упрощает расчеты.
Итак: относительное число частиц, рассеянных в интервале углов ( , +d ), равно произведению количества ядер на единице площади поверхности фольги (n) на соответствующее дифференциальное сечение.
Спектральные закономерности
Изучение спектров излучения невзаимодействующих друг с другом атомов показало, что:
1) эти спектры линейчатые(состоят из отдельных узких спектральных линий);
2) большое число спектральных линий указывает на сложную структуру атома;
3) линии расположены упорядоченно и образуют серии;
4) в 1885 г. Бальмер установил закономерность видимой серии спектра атома водорода:
 ,
где n
= 3, 4, 5, …;
,
где n
= 3, 4, 5, …;
 – циклическая частота определенной
– циклическая частота определенной
(для каждого значения n) линии серии, R = 2,07· 1016с-1 – постоянная Ридберга;
5)
исследования привели к обнаружению
других серий и к обобщению формулы
Бальмера: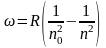 ,
при этом:
,
при этом:
n0 = 1 – серияЛаймана (ультрафиолетовая область)
n0 = 2 – серия Бальмера (видимая область)
n0 = 3 – серия Пашена (инфракрасная область)
n0
= 4 – серия Бреккета ( )
)
n0 = 5 – серия Пфунда( )
При заданном значении n0 n принимает все целочисленные значения, начиная с n0+1.
При

 ,
называемое границей
серии.
,
называемое границей
серии.При n0 = 1 и n = 2 для этой серии
 и
и
 .
Эту спектральную линию называют
резонансной
линией
водорода.
.
Эту спектральную линию называют
резонансной
линией
водорода.
