
геохимия ответы
.pdfvk.com/club152685050 | vk.com/id446425943
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
01-1. Периодический закон Д.И.Менделеева в геохимии.
Периодический закон Менделеевафундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в 1869 при сопоставлении свойств хим. элементов и величин их атомного веса. Периодический закон химических элементов, сформулированный русским ученым Д. И. Менделеевым, отразил естественную классификацию элементов и стал ключом к расшифровке строения атома, основой геохимии.Так же замечено,что элементы четных порядковых номеров
преобладают над нечетными. С увеличение порядковых номеров распространеность уменьшается. Избыточные элементы O, Si, Ca, Fe, Sr, Ba и другие имеют разницу порядковых номеров, равную или кратную 6.
01-2. Внутренние и внешние факторы миграции химических элементов.
Термин миграция элементов(МЭ) введен Ферсманом в 1923г. МЭ-это перемещение и перераспределение х.э.,приводящие к их концентрации или рассеянию.
Внешние факторы определяются условиями среды:1)перепады Т,Р(дегазация);2)рН(кислотность)-Сl,F,комплексные анионы, гуминовые кислоты(органические).(щелочность)-К,Na. 3)еН-окислительно –восстановительный потенциал.Окислитель-О2,восстановитель-S,C,углеводороды. Чем больше температура, тем активнее миграция. Внутренние факторы определяются свойствами атомов и соединений .1)соотношение валентности и радиуса иона 2)сродство к кислороду или сере 3)переменная валентность(зависит от еН) 4)химическая активность 5)биофильность 6)способность быть сорбированным 7) молекулярный вес 8)Т плавления и др. 9)летучесть(Н2,Н2S,Cl,B) ; 10)твердость вещества
01-3. Принципиальное отличие химического состава осадочных и магматических. пород
Принципиальным отличием химического состава осадочных пород от магматических является значительное (около 10%) содержание летучих компонентов, главным образом воды и СО2, практически не содержащихся в магматических породах. Они поступают в осадочные породы главным образом из атмосферы и гидросферы.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
02-1. Определение геохимии, её объект, место среди других наук. История геохимии.
Определение: ГЕОХИМИЯнаука о распространенности и миграции хим. элементов в геосферах Земли.
Объект: Геохимия изучает миграцию, концентрацию и рассеяние химических элементов в геологических структурах под влиянием факторов и процессов при различных термодинамических физико-химических условиях.
Место среди других наук:
Геохимия является необходимым направлением в цикле геолого-минералогических наук и тесно связана с минералогией и петрографией. Методология геохимии базируется на общих законах диалектики и, в частности, на изучении закономерностей миграции химических элементов в геологических системах.
vk.com/club152685050 | vk.com/id446425943
Объект:Предметом изучения геохимии являются атомы химических элементов Земли и космоса, их распределение и миграция в магматических, метаморфических и гипергенных системах под воздействием физико-химических процессов.
История: До появления в печати термина «геохимия» ( 1838) ее корни уходят во времена средневековья. Алхимики и их последователи в Европе пытались познать химический состав природных тел (16в). Английский врач и химик Р. Бойль (17в) интересовался химией океана и атмосферы. Тогда же Гюйгенс высказал идею о единстве химического состава космоса. Э. Галлею (1742) принадлежит первая попытка определения возраста океана по накоплению в нем солей, приносимых реками с поверхности суши.Также свои вклады сделали Ломоносов,Берцелиус,Пристли,Лавуазье и многие другие. Фундамент для возникновения геохимии подготовили открытия двух выдающихся ученых во второй половине XIX в.: открытие в 1859 г. Р. Бунзеном и Г. Кирхгофом спектрального анализа и в 1869 г.
Д. И. Менделеевым периодического закона химических элементов. в России геохимическое направление возникает на рубеже XIX–XX вв. Его развитие связано с именем В. И. Вернадского.Большой вклад в развитие геохимии вложил Ферсман в 19-20 вв. Он наряду с Кларком,Гольдшмидтом и Вернадским является основоположником современной геохимии.
02-2. Типы химических связей в кристаллах.
1)металлическая-в узлах кристалла положительные ионы ме. Между ними валентные е-. Характерно : -высокая плотность вещ-ва, -электропроводность,
-высокая оптическая плотность=>высокая отражательная способность=>металлический блеск=>ковкость=>слои легко смещаются от пустоты к пустоте -кристаллы кубической или гексагональной сингонии.
Сплавы «ТВ.р-ры». Часто реализуется плотнейшая упаковка.
2)ионная(гетерополярная) связь-в узлах ионы с противоположными зарядами(катион отдает е- аниону) . Типичный примеркристалл NaCl
3)ковалентная(не ме) связь-попарное обобществление валентных е-. Упаковки часто не плотнейшие .Связи направленные.Для возникновения необходима активизация(Т,Р).Самая прочная структура-Алмаз.
4)молекулярные связи - в узлах ориентированные молекулы. Характерны: низкие Т плавления, высокая сжимаемость. Разновидность молекулярной связиводородная связь.
02-3. Треугольная диаграмма химического состава магматических и осадочных пород.
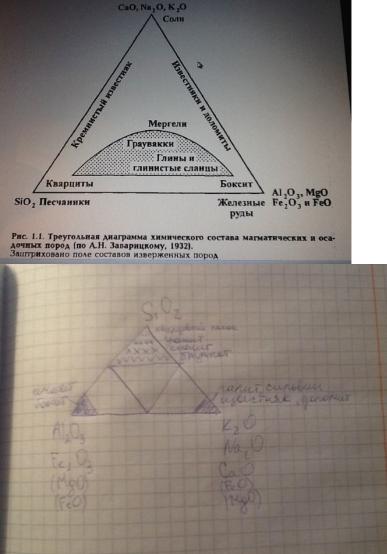
vk.com/club152685050 | vk.com/id446425943
Ввершинах треугольника скомпонованы оксиды, обладающие разной геохимической подвижностью.
Вэтих координатах магматические породы при всем их разнообразии занимают лишь незначительную часть треугольной диаграммы. Осадочные же породы распространены по всему полю этой диаграммы, и лишь глинистые породы и граувакки соответствуют по своему химизму магматическим. Принципиально важно, что среди осадочных пород есть весьма «чистые» линии, т.е. мономинеральные породы, состоящие практически из одного минерала — кварцевые песчаники, известняки, доломиты, соли и т.д. В этом проявляется открытое позднее, чем была составлена эта диаграмма, явление осадочной дифференциации вещества —как результат осадочного процесса.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
03-1. Методологическая основа геохимии - второй закон термодинамики (закон энтропии)
Второй Закон Термодинамики впервые сформулировал Клаузиус: "теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении".
Другая формулировка: все самопроизвольные процессы в природе идут с увеличением энтропии. (Энтропия - мера хаотичности, неупорядоченности системы). И факт,что любая природная система стремится перейти в состояние максимальной устойчивости с минимальным запасом свободной энергии лёг в методологическую основу геохимии.
03-2. Энергия кристаллической решетки(ЭК).
vk.com/club152685050 | vk.com/id446425943
равна работе, которую необходимо затратить, чтобы разделить и отделить друг от друга на бесконечное расстояние частицы, образующие кристаллическую решетку. Величина Э. к. р. зависит от начальной энергии частиц, образующих кристаллическую решетку.
Малая ЭК = легкая растворимость минералов,высокая миграционная способность.
03-3. Механическая, физико-химическая, биогенная и техногенная миграция химических элементов.
Миграция-это перемещение и перераспределение х.э., приводящие к их концентрации или рассеянию. 4 вида миграции:
1.механическая подразумевает механическое перемещение хим. элементов без изменения форм их нахождения.
2.физ-хим включает миграцию и сопровождающие ее хим реакции для таких форм нахождения хим элементов как водные растворы, газовые смеси
3.биогенная объединяет всю миграцию элементов, связанную с жизнедеятельностью организмов
4.техногенная миграция элементов вызвана деятельностью людей, ее роль непрерывно возрастает .
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
04.-1. Иерархическая лестница природных объектов геохимии.
кварк, нуклон, атом, молекула, минерал, горная порода, фация (слой); геологическая формация, геосфера, планета,галактика; скопление галактик; космос.
04-2. ЭКи по А.Е.Ферсману.
ЭКиэнергетические коэффициенты. ЭК— пай энергии, выделяемый ионом при образовании кристаллической решетки, обычно дается в условных единицах или в килокалориях (напр. для О2 — 1,55 или 396,95 ккал) по расчету на 1 моль.
ЭК-базируются на величинах радиусов ионов и относятся к важнейшим понятиям в геохимии.
ЭК ионов в условных единицах умноженный 1071,74 дает значение в килоджоулях. Малые ЭК у щелочных металлов и галогенов. Ферсман предложил также коэффициент
ВЭК-пай энергии иона, приходящийся на единицу заряда, равный ЭК, деленной на валентность. используются для определения энергии кристаллических решеток, твердости и растворимости минералов, дальности миграции и зональности концентрации ионов. Малые ЭК = легкая растворимость минералов,высокая миграционная способность.
04-3 Геохимические и энергетические особенности экзогенных процессов.
Экзогенные процессы- геологические процессы, обусловленные внешними по отношению к Земле источниками энергии (преимущественно солнечное излучение) в сочетании с силой тяжести и жизнедеятельностью организмов. К экзогенным процессам относятся : Выветривание, геологическая деятельность ветра , поверхностных и подземных вод, ледников. Главные формы проявления Э. п. на поверхности Земли: разрушение горных пород и химическое преобразование слагающих их минералов;их удаление и перенос ,аккумуляция и постепенное их преобразование в осадочные горные породы . Глубинные минералы и слагаемые ими породы в условиях земной поверхности становятся неустойчивыми и стремятся перейти в более устойчивые соединения в данных физ-хим процессах. Начинается новый цикл миграций хим элементов, резко отличной от их миграции в эндогенных условиях. Новые формы соединений, новые сочетания хим элементов.
vk.com/club152685050 | vk.com/id446425943
Следует заметить,что плотность экзогенных продуктов меньше по отношению к эндогенным.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
05-1. Химическая классификация элементов.
Щелочны́е мета́ллы — это элементы 1-й группы главной подгруппы: литий Li, натрий Na, калий K…При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Щё́лочноземе́льные мета́ллы — химические элементы II-й А группы периодической таблицы элементов: магний, кальций и тд.Их оксиды в воде сообщают щелочную реакцию.(Са,Мg)
Перехо́дные мета́ллы — элементы побочных подгрупп, в атомах которых появляются электроны на d- и f-орбиталях. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.(Fe,Ni,Ag,Au)
Постпереходные металлы - элементы которые напоминают по своим свойствам металлы. Данные металлы располагаются справа от переходных металлов в периодической таблице. (Al)
Полумета́ллы (металлоиды, амфотерные металлы) — химические элементы, расположенные в периодической системе на границе между металлами и неметаллами. Для них характерно образование ковалентной кристаллической решётки и наличие металлической проводимости.(B,Si,Te)
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы, главные подгруппы.(C,N,P,S,O) Галоге́ны- элементы главной подгруппы VII группы. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. (F, Cl , Br, I)
Ине́ртные, или благоро́дные газы —элементы главной подгруппы VIII группы. К инертным газам относятся гелий, неон и тд. Инертные газы отличаются химической неактивностью.
Лантаноиды-14 редкоземельных элементов. с атомными номерами 57-71 Актино́иды (актини́ды) — семейство, состоящее из 14 радиоактивных химических элементов. . с атомными номерами 89-103
Суперактино́иды (суперактини́ды) — гипотетически возможные химические элементы с атомными номерами 121— 153
2 вар
В зависимости от строения и заполненности электронных оболочек Спайс выделил шесть классов элементов:
1.Инертные газы с 8-электронной оболочкой.
2.Сильно электроположительные (катионы) металлы, которые имеют от одного до трех электронов сверх конфигурации инертных газов. Это щелочные элементы I и II группы (Li, Na, K, Rb, Cs, Fr; Be, Mg, Ca, Sr, Ba, Ra) и большая часть III группы (Al, Sc, Y, La, Ac).
3.Неметаллы (анионы) – у них недостает от одного до четырех электронов до конфигурации инертных газов: F, Cl, Br, I, At; O, S, Se,Te; N, P, As; C, Si.
4.Переходные металлы с переменной валентностью и ковалентной связью. Для химических связей используют d-электроны предпоследнего слоя: Ti, V, Cr, Mn, Fe, Co, Ni; Zr, Nb, Mo, Tc, Ru, Rh, Pd; Hf,Ta, W, Re, Os, Ir, Rt.
5.Лантаноиды и актиноиды, атомы которых имеют незаполненные d- и f-слои. Лантаноиды образуют трехвалентные катионы с электронной конфигурацией слоя 4 f n. Они дают устойчивые соли и слабо гидролизуются в растворах, подобны солям Sc, Y.
6.Металлы (катионы) побочных подгрупп. В них от одного до трех электронов свыше 18 электронов в предыдущей оболочке: Cu,Ag, Au; Zn, Cd, Hg; Ga, In, Tl. В них связь
vk.com/club152685050 | vk.com/id446425943
образуют электроны d-слоя. При образовании соединений основным «мотивом» всех атомов является тенденция к достижению такой конфигурации, как у ближнего инертного газа в этом ряду.
05-2. Изоморфизм, основные типы, законы.
Изоморфизм-св-во сохр.структуры кристалла при полном или частичном замещении одних атомов другими-«тв. Р-ры.».
Необх.усл(внутр.факторы):1)близость размеров ионов или атомов. 2)сходство строения атомов т.е сходство хим. свойств -соседство в табл.Менделеева.Преимущественное образование какого либо вида связей.3)направленность-вхождение в решетку иона с меньшим радиусом или большим зарядом-предпочтительнее.
Внеш.факторы:
-увелич.способности к изоморфизму с повышением Т. -распад ТВ. Р-ров при уменьшении Т -Р выталкивает элемент из структуры или заталкивает в нее.
Изоморфизм бывает совершенный и несовершенный Яркий пример изоморфизма демонстрирует группа гранатов.
05-3. Различие поведения химических элементов при выветривании в разных ландшафтно-климатических зонах.
В зависимости от среднегодовой температуры и влажности выделяют 2 типа выветривания: аридный (безводный), характерный для жаркого климата и гумидный (сырой), характерный для умеренного климата с большой влажностью.
Климат регулирует скорости процессов выветривания, определяя мощности отдельных горизонтов и толщи в целом. Поведение элементов в коре выветривания зависит от их химических свойств, типа ландшафта и особенностей горных пород. Устойчивость минералов, в состав которых входят одни и те же элементы, неодинакова в различном климате. Например, кальцит (СаСО3), гипс (CaSO4·2Н2О), доломит [CaMg(CO3)2] устойчивы в коре выветривания, формирующейся в аридном климате (образуются скопления этих минералов, вплоть до залежей), но неустойчивы (выщелачиваются) в гумидном климате. Мощность коры выветривания колеблется от нескольких десятков
сантиметров до сотен метров.
Варидном климате миграция элементов слабо выражена. Преобладают окисление и
гидратация. Концентрируются щелочи, мало органических кислот. В гумидном климате полнее протекают процессы выщелачивания, растворения, гидролиза и миграции.
Вусловиях теплого и относительно влажного климата, где преобладает химическое и биогенное выветривание, конечными продуктами являются глины. В арктических пустынях, пустынных и полупустынных районах кора выветривания состоит в основном из грубообломочного материала и песка. При гумидном климате создаются восстановительные условия, при аридном-окислительные.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
06-1. Геохимическая классификация химических элементов по В.М. Гольдшмидту.
Классификация по принципу наибольшей концентрации в определенных сис-мах. ; 4 группы:1)Литофильные-распространенные минерало- и породообразующие х.э. Место их концентрации-литосфера и мантия.Хим-ки-черезвычайно активны.Образуют соединения с О.Меньше с F,Cl,Br,I.(Галит,флюорит).Связи всегда ионные. 2)сидерофильные элементы(сидерес-железо)-х.э близкие к железу,со сходными сввами.Место концентрации-ядро.Хим-ки абсолютно не активны.Могут создавать
vk.com/club152685050 | vk.com/id446425943
природные сплавы(металлические),но не соединения,металлические связи. Высоко Т и глубинное происхождение.
3)халькофильные хэ(халько-медь)=.> элементы схожие по св-вам с медью.Не концентрируются в оболочках земли .Руды цв.мет.Место концентрации-месторождения цвет.мет. Хим.активность-умеренная. Могут создавать самородные сплавы.Соединения в основном с S-сульфиды. Связи-ме в самородках,ионные с S,ковалентные-пирит(FeS2- между S и S. Между Fe и S2-ионные)
4)Атмофильные х.э.- Н, N и инертные газы. Концентрируются в атмосфере и гидросфере.Есть активные(О,Н)и неактив.газы . Связи ковалентные,ков-пол.,редко молекулярные(вода,лед)
5)Также можно выделить биофильные элементы.Fe(гемоглобин),О,Н,Р,F,К,Mg,N(белок) О сере можно сказать что она и литофильная и халькофильная. В зависимости от соединения.СаSO4-сера катион.FeS2-сера анион.
06-2. Изоморфизм: изоморфные ряды, внутренние и внешние факторы.
Изоморфизм-св-во сохр.структуры кристалла при полном или частичном замещении одних атомов другими-«тв. Р-ры.».
ИЗОМОРФНЫЕ РЯДЫряды химических элементов (в частности, т. н. диагональные ряды таблицы Д. И. Менделеева), способных изоморфно замещать друг друга в соединениях с образованием смешанных кристаллов.
Необх.усл.(внутр.факторы)1)близость размеров ионов или атомов. 2)сходство строения атомов т.е сходство хим. свойств -соседство в табл.Менделеева. Преимущественное образование какого либо вида связей.3)направленность-вхождение в решетку иона с меньшим радиусом или большим зарядом-предпочтительнее.
Внеш.факторы:
-увелич.способности к изоморфизму с повышением Т. -распад ТВ. Р-ров при уменьшении Т -Р выталкивает элемент из структуры или заталкивает в нее.
06-3. Литогенез, осадочная механическая дифференциация вещества по Л.В. Пустовалову
Литогенезсовокупность природных процессов образования и последующего изменения осадочной горной породы.
Механическая дифференциация – это разделение обломочного материала по массе и тяжести благодаря разной скорости переноса их различными потоками и разной скорости его оседания в бассейне. В результате происходит четкое зональное распределение обломочного материала по дну бассейна.
Сначала в предгорьях или в устье горных рек остается грубообломочный материал - валуны и гальки, в прибрежной зоне - гравий, подальше от берега - песок, распространяющийся на большие площади. Еще дальше простирается область осаждения мелкого алеврита, нередко осаждающегося вместе с глиной.
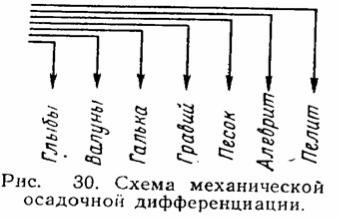
vk.com/club152685050 | vk.com/id446425943
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 7
07-1.Геохимические классификации химических элементов по А.Е.Ферсману.
А. Е. Ферсман выделил ассоциации элементов в зависимости от поведения элементов в магматических и гидротермальных процессах. А. Е. Ферсман различал элементы магм: кислых (О, Н, Не, Li, Be, В, F, Al, Si, К, Rb, Y, Mo, W, РЗЭ и др.), средних (Na, С, Са, Mn, Sr и др.), ультраосновных (Mg, V, Сг, Fe, Co, Ni, Pt и др.) и элементы сульфидных месторождений (S, As, Se, Те, Sb, Си, Ag, Zn, Cd, Hg, Pb и др.)
07-2. Геохимия магматических процессов.
Основные сведения по геохимии магматических процессов дают изверженные породы, современный вулканизм или эксперименты при высокой температуре и давлении. Геохимия магматических процессов тесно связана с температурой,давлением и концентрацией раствора. При понижении температуры происходит выделение тепла и кристаллизация магмы. Повышение давления приводит к уменьшению объема и повышению плотности магмы. Если повышается концентрация магмы, то происходит
переход ее в твердую фазу, при понижении – сохраняется ионная жидкая фаза. В
кристаллизации |
магмы |
выделяют |
следующие |
последовательные |
этапы: |
протокристаллизацию,главную и остаточную кристаллизацию. Протокристаллизация – образование наиболее ранних продуктов кристаллизации из расплава. Происходит образование темных и устойчивых минералов. Кристаллизация расплава начинается с
образования наиболее тугоплавких, богатых Mg и Fe силикатов. В период главной кристаллизации по мере падения температуры в породах увеличивается содержание Ca –
Mg силикатов и алюмосиликатов Ca, Na, K . Выделяются распространенные минералы.
Остаточная кристаллизация (телокристаллизация) приводит к образованию кислых пород, обогащенных редкими элементами и летучими компонентами.
07-3. Литогенез, осадочная химическая дифференциация вещества по Л.В. Пустовалову
Литогенез- совокупность природных процессов образования и последующего изменения осадочной горной породы Химическая дифференциация - это разделение вещества, приносимого в бассейн в
растворах или коллоидах, в зависимости от смены окислительной среды на восстановительную и смены солености бассейна.
В открытых морях и в изолированных бассейнах, расположенных в гумидном климате, т. е. при избытке влаги, реализуется лишь часть ряда.В аридном климате в изолированных бассейнах, соленость которых возрастает во времени по мере усыхания, реализуется ряд изменений солевого состава хемогенных осадков: от известняка, отлагающегося в бассейне с нормальной соленостью, до сульфатов и хлоридов. Таким образом, в отличие

vk.com/club152685050 | vk.com/id446425943
от дифференциации механической, которая реализуется в бассейне осадконакопления единовременно, схема химической дифференциации в целом релизуется не только в пространстве - в разных участках бассейна, но и во времени, по мере измения окислительно-восстановительной обстановки, кислотно-щелочного потециала и солености воды .
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 8
08-1. Геохимическая классификация химических элементов по В.И.Вернадскому
после того как Земля сформировалась в виде отдельного тела и разогрелась за счет гравитационного сжатия и других факторов, началось ее расслоение, дифференциация на отдельные оболочки. Этот процесс, как считает А. П. Виноградов, определялся выплавлением и дегазацией легкоплавких и летучих веществ. В ходе такой «зонной плавки» вещество верхней мантии расщепилось на легкоплавкую и тугоплавкую составляющие. Первая из них поднялась вверх и дала начало первичной базальтовой коре, причем это «всплывание» относительно легких
vk.com/club152685050 | vk.com/id446425943
веществ сопровождалось выделением паров и газов, из которых затем сформировались гидросфера и атмосфера Земли. Наиболее тяжелые вещества опустились в недра Земли, образовав ее внутреннюю мантию и ядро.
С течением времени возникла первичная атмосфера планеты. Ее состав вначале был совершенно непохож на современный: преобладали водород, азот, углекислый газ. Постепенно деятельность растений и процессы образования карбонатных осадочных пород уменьшили количество углекислоты, растения обогатили нижние слои атмосферы кислородом, воздух Земли оказался состоящим из азота и кислорода. На изменение состава атмосферы неоднократно оказывала влияние и вулканическая деятельность. Водяной пар и газы, выделившиеся из магмы, пополняли
воздушную оболочку Земли, изменяя ее состав.
08-3. Диагенез и геохимические фации. Эпигенез.
Диагенез — совокупность процессов преобразования рыхлых осадков в осадочные горные породы. Происходит в верхних слоях земной коры. Различают два этапа диагенетичного минералообразования: окислительный и восстановительный.
Фа́ция (в геохимии) — совокупность физико-химических условий среды, определяющих характер седиментации (осаждения) и диагенеза осадков.
Основные характеристики фаций:рН,еН, Т,минерализация и солевой состав вод,концентрация органического вещества в осадках.
Фации делят на континентальные и морские.
ЭПИГЕНЕ́З- различные природные (вторичные) изменения осадочных горных пород после их образования. Приводит к образованию эпигенетических месторождений , наиболее характерных для руд радиоактивных, цветных и редких металлов.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 9
09-1. Происхождение химических элементов. Большой взрыв. Взрыв сверхновой.
Для объяснения распространенности в природе различных химических элементов и их изотопов в 1948 году Гамовым была предложена модель Горячей Вселенной. По этой модели все химические элементы образовывались в момент Большого Взрыва. все химические элементы образовались в течение нескольких минут из сверхплотной материи при расширении Вселенной путем ядерных реакций между элементарными частицами: протонами, нейтронами, электронами, позитронами,мезонами. Однако это утверждение впоследствии было опровергнуто. Доказано, что только легкие элементы могли образоваться в момент Большого Взрыва, а более тяжелые возникли в процессах нуклеосинтеза. Самые тяжелые ядра, как предполагают ученые, возникают при вспышке Сверхновой звезды, в которую превращается старая звезда,
когда после выгорания топлива (образования всех легких элементов- Н,Не,С,О,Ne,Si,Fe)внутри нее падает давление.
09-2. Химический состав магматических пород, парагенезы в них химических элементов.
Список элементов, которые можно встретить в том или ином количестве в магматических породах, довольно обширен, в них содержатся практически все химические элементы. Главными являются: кислород, кремний, алюминий, железо, кальций, магний, натрий, калий, титан и водород, но самый распространенный из них — кислород — составляет в среднем половину веса магматических пород. Химический состав горных пород выражают окислами соответствующих химических элементов: SiO2, Al2O3, Fe2O3, FeO, MgO, CaO, Na2O и K2O. Химический состав пород не соответствует химическому составу магмы, из которой они образовались, так как многие составные части магмы (вода, углекислота, соединения Cl, F и другие летучие соединения) при застывании выделяются из нее. За основу классификации принято содержание кремнезема(SiO2), который и служит критерием разделения пород на группы (ультраосновные(30-45%-пр.-дунит), основные(45-55)габбро, средние(55-65)трахит, кислые(65-78)гранит, ультракислые(>78)пегматит.
ПАРАГЕНЕЗ - совместное нахождение, являющееся результатом определенной последовательности образования, связанной с развитием единого процесса.
