
- •Хлор. Электронное строение атома, молекулы. В природе. Получение и применение. Химические свойства (примеры реакций с водой, металлами и неметаллами). Соляная кислота.
- •Взаимодействие с водой:
- •Общая характеристика элементов via группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ.
- •Кислород. Нахождение в природе, получение и применение. Озон. “Озоновый щит”.
- •Кислотные и окислительно-восстановительные свойства, получение и применение серной кислоты.
- •Строение молекулы, физические и химические свойства, получение и применение аммиака. Свойства гидроксида и солей аммония.
- •Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV).
- •Углеводороды. Нахождение в природе (газовые гидраты), а также получение и применение.
- •Карбонаты в природе. Получение и применение оксида углерода (IV). Сода.
- •Оксид кремния (IV). Кремниевая кислота. Силикагель. Гидролиз силикатов. Выветривание. Применение в промышленности (строительные материалы).
- •Алюминий. Нахождение в природе. Получение и применение.
- •Алюминий. Кислотно-основные свойства оксида и гидроксида, их применение.
- •Общая характеристика элементов iia группы. Положение в периодической системе, строение и размер атомов, физические и химические свойства простых веществ.
- •Жесткость воды. Цели и методы ее устранения. Образование сталактитов и сталагмитов. Опреснение морской воды (промышленные методы).
- •Первый ряд переходных элементов (3d-элементы). Строение атомов и проявляемые валентности. Примеры реакций получения простых веществ.
- •Гидроксиды 3d-элементов в состояниях высшей степени окисления (кислотно–оснόвные и окислительно-восстановительные свойства).
- •Железо. Строение атома и проявляемые валентности. В природе. Получение.
- •Железо. Строение атома. Оксиды и гидроксиды железа (II) и (III). Получение и свойства.
- •Взаимодействие с гироксидом натрия:
- •Взаимодействие с гидроксидом натрия:
- •Viiв группа. Строение атомов и проявляемые степени окисления. Сравнение с элементами viiа группы.
- •Оксиды и гидроксиды марганца (кислотно-оснόвные и окислительно-восстановительные свойства).
- •Viв группа. Строение атома, проявляемые степени окисления хрома. Гидроксиды (кислоты и основания) хрома.
- •Нахождение в природе элементов iia группы. Получение оксидов магния и кальция. Кислотно-основные характеристики и взаимодействие с водой оксидов и гидроксидов.
- •Iв группа. Строение атомов, проявляемые степени окисления. Сравнение свойств простых веществ с элементами iа группы в реакциях с водой и кислотами. Соединения меди (I), (II).
Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV).
А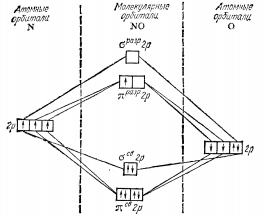 зот
образует с кислородом ряд оксидов: все
они могут быть получены из азотной
кислоты или ее солей.
зот
образует с кислородом ряд оксидов: все
они могут быть получены из азотной
кислоты или ее солей.
Оксид азота (II) –
окись азота, NO представляет
собой бесцветной трудно сжижаемый газ.
Жидкий азот кипит при температурах выше
-150С. По химическим свойствам оксид азота
относят к безразличным оксидам. NO
термодинамически не устойчив, но при
комнотной температуре не разлагается
из за прочности его молекул. Оксид азота
можно получить из простых вещест при
температурах 3000-4000С. В лабароториях
получают:
 .
Для NO характерна
окислительно-востановительная
двойственность. Под действием сильных
окислителей он окисляется, а в присутствии
сильных восстановителей – восстанавливается.
В природе образуется при грозовом
разряде:
Применяют
для получения азотной кислоты. Играет
активную роль в разрушении озонового
слоя (
.
Для NO характерна
окислительно-востановительная
двойственность. Под действием сильных
окислителей он окисляется, а в присутствии
сильных восстановителей – восстанавливается.
В природе образуется при грозовом
разряде:
Применяют
для получения азотной кислоты. Играет
активную роль в разрушении озонового
слоя ( )
)
Оксид азота (IV)
– двуокись азота, - бурый ядовитый газ,
обладающий характерным хапахом. Легко
сгущается в красноватую жидкость,
которая при охлаждении светлеет и при
-11С замерзает, обеспечивая бесцветную
кристалическую массу. Диоксид азота –
очень энергичный окислитель. Диоксид
серы окисляется им в триоксид на чем
основан нитрозный метод получения
серной кислоты. Пары бурого газа ядовиты.
Играет важную роль формировании
почвенного покрова. В лаборатории
 получают воздействием концентрированной
азотной кислоты на медь:
получают воздействием концентрированной
азотной кислоты на медь:
 .
Лисий хвост – выбросы в атмосферу
на химических предприятиях. Применяют
в качестве окислителя в жидком ракетном
топливе и для иззготовления азотной
кислоты.
.
Лисий хвост – выбросы в атмосферу
на химических предприятиях. Применяют
в качестве окислителя в жидком ракетном
топливе и для иззготовления азотной
кислоты.
Азотная кислота. Получение и применение. Взаимодействие с металлами и неметаллами (на примере меди, железа, фосфора).
Азотная кислота – бесцветная жидкость, при -42С застывающая в прозрачную кристаллическую массу. Азотная кислота – очень сильная, но неустойчивая. Является очень сильным окислителем.
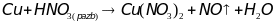
 ,
,


Получение азотной кислоты -
 .
Азотную кислоту применяют в ювелирном
деле, в производстве минеральных
удобрений.
.
Азотную кислоту применяют в ювелирном
деле, в производстве минеральных
удобрений.
Фосфаты в природе. Получение и свойства фосфорной кислоты. Применение фосфорной кислоты и ее соединений (в связи со свойствами).
Фосфаты – соли и эфиры фосфорных кислот. В природе фосфаты встречаются в виде апатитов, вивианитов а та же в горной породе фосфорит.
Фосфорные кислоты – соединения фосфора
в степени окисления имеющие общую
формулу
 .
При взаимодействии высшего оксида на
холоде получается метафосфорная
кислота. При разбавлении ее водой
получается ортофосфорная кислота:
.
При взаимодействии высшего оксида на
холоде получается метафосфорная
кислота. При разбавлении ее водой
получается ортофосфорная кислота:
 При нагревании до 200-250 С ортофосфорная
кислота обезвоживается, и образуется
пирофосфорная кислота
При нагревании до 200-250 С ортофосфорная
кислота обезвоживается, и образуется
пирофосфорная кислота
 ,
в результате дальнейшей дигидрации
которой при 400-500С вновь образуется
метафосфорная кислота:
,
в результате дальнейшей дигидрации
которой при 400-500С вновь образуется
метафосфорная кислота:
 .
Из всех фосфорных кислот наибольшее
значение имеет ортофосфорная кислота
которая иногда называется просто
фосфорной.
.
Из всех фосфорных кислот наибольшее
значение имеет ортофосфорная кислота
которая иногда называется просто
фосфорной.
Фосфорная кислота
 -
бесцветные кристаллы при стандартных
условиях. Очень хорошо растворима в
воде, и по хорошему фосфорной кислотой
называется 85% раствор (бесцветная
сиропообразная жидкость без запаха)
-
бесцветные кристаллы при стандартных
условиях. Очень хорошо растворима в
воде, и по хорошему фосфорной кислотой
называется 85% раствор (бесцветная
сиропообразная жидкость без запаха)
Фосфорную кислоту получают из фосфорита:
 Применяется
в пищевой промышленности как регулятор
кислотности, в сельском хозяйстве, в
стоматологии. Гидрофосфаты кальция
кладут в хлебопекарные порошки. Соли
ортофосфорной кислоты применяют в
промышленности. Особое место занимают
такие соединения как экстрагенты и
абсорбенты (в холодильных установках)
Применяется
в пищевой промышленности как регулятор
кислотности, в сельском хозяйстве, в
стоматологии. Гидрофосфаты кальция
кладут в хлебопекарные порошки. Соли
ортофосфорной кислоты применяют в
промышленности. Особое место занимают
такие соединения как экстрагенты и
абсорбенты (в холодильных установках)
Общая характеристика элементов IVA группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ. Нахождение в природе.
Главную подгруппу четвертой группы
периодической системы образуют элемнты:
Углерод, крмений, германий, олово и
свинец. При переходе от углерода к свинцу
размеры атомов возрастают (от 0.077нм),
способность к присоединению, а значит
и неметаллические свойства, ослабевают.
Таким образом углерод и кремний –
неметаллы, германий и металл, и неметалл,
олово и свинец – металлы. Для УКГОС (по
первым буквам) характерны степени
окисленности +2 и +4. Общая структурная
формула валентных оболочек - Обладают
4 электронами на внешнем электронном
слое. Атомы
гибридизированы. Не отличаются особой
активностью. Стоит отметить что
большинство этих элементов великолепные
полупроводники. Элементы за исключением
углерода( в некторых его модификациях)
устойчивы к воде и воздуху. Окисляются
только под воздействием температур. В
природе углерод находят в виде алмазов,
в чистом виде и в залежах угля. Кремний
находят в виде кремнезема, песка и
кварца. Германий находят в виде германита
и аргиродит. Олово находят в виде
касситерита. Свинец – находят в
гидротермальных образованиях и в
пегматитах и в галенитах.
Обладают
4 электронами на внешнем электронном
слое. Атомы
гибридизированы. Не отличаются особой
активностью. Стоит отметить что
большинство этих элементов великолепные
полупроводники. Элементы за исключением
углерода( в некторых его модификациях)
устойчивы к воде и воздуху. Окисляются
только под воздействием температур. В
природе углерод находят в виде алмазов,
в чистом виде и в залежах угля. Кремний
находят в виде кремнезема, песка и
кварца. Германий находят в виде германита
и аргиродит. Олово находят в виде
касситерита. Свинец – находят в
гидротермальных образованиях и в
пегматитах и в галенитах.
