
- •Хлор. Электронное строение атома, молекулы. В природе. Получение и применение. Химические свойства (примеры реакций с водой, металлами и неметаллами). Соляная кислота.
- •Взаимодействие с водой:
- •Общая характеристика элементов via группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ.
- •Кислород. Нахождение в природе, получение и применение. Озон. “Озоновый щит”.
- •Кислотные и окислительно-восстановительные свойства, получение и применение серной кислоты.
- •Строение молекулы, физические и химические свойства, получение и применение аммиака. Свойства гидроксида и солей аммония.
- •Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV).
- •Углеводороды. Нахождение в природе (газовые гидраты), а также получение и применение.
- •Карбонаты в природе. Получение и применение оксида углерода (IV). Сода.
- •Оксид кремния (IV). Кремниевая кислота. Силикагель. Гидролиз силикатов. Выветривание. Применение в промышленности (строительные материалы).
- •Алюминий. Нахождение в природе. Получение и применение.
- •Алюминий. Кислотно-основные свойства оксида и гидроксида, их применение.
- •Общая характеристика элементов iia группы. Положение в периодической системе, строение и размер атомов, физические и химические свойства простых веществ.
- •Жесткость воды. Цели и методы ее устранения. Образование сталактитов и сталагмитов. Опреснение морской воды (промышленные методы).
- •Первый ряд переходных элементов (3d-элементы). Строение атомов и проявляемые валентности. Примеры реакций получения простых веществ.
- •Гидроксиды 3d-элементов в состояниях высшей степени окисления (кислотно–оснόвные и окислительно-восстановительные свойства).
- •Железо. Строение атома и проявляемые валентности. В природе. Получение.
- •Железо. Строение атома. Оксиды и гидроксиды железа (II) и (III). Получение и свойства.
- •Взаимодействие с гироксидом натрия:
- •Взаимодействие с гидроксидом натрия:
- •Viiв группа. Строение атомов и проявляемые степени окисления. Сравнение с элементами viiа группы.
- •Оксиды и гидроксиды марганца (кислотно-оснόвные и окислительно-восстановительные свойства).
- •Viв группа. Строение атома, проявляемые степени окисления хрома. Гидроксиды (кислоты и основания) хрома.
- •Нахождение в природе элементов iia группы. Получение оксидов магния и кальция. Кислотно-основные характеристики и взаимодействие с водой оксидов и гидроксидов.
- •Iв группа. Строение атомов, проявляемые степени окисления. Сравнение свойств простых веществ с элементами iа группы в реакциях с водой и кислотами. Соединения меди (I), (II).
Кислотные и окислительно-восстановительные свойства, получение и применение серной кислоты.
Серная кислота – очень сильная
кислота и довольно сильный окислитель.
При окислении металлов, кислота
восстанавливается до
,
а наиболее сильными восстановителями
до
 и S.
и S.
 частично восстанавливается водородом.
Разбавленная
взаимодействует со всеми металлами,
находящимися в электрохимическом ряду
напряжений левее водорода. Окислительны
свойства для разбавленной
нехарактерны. Серную кислоту можно
получить из железного купороса
термическим разложением сульфата железа
с последующим охлаждением смеси:
частично восстанавливается водородом.
Разбавленная
взаимодействует со всеми металлами,
находящимися в электрохимическом ряду
напряжений левее водорода. Окислительны
свойства для разбавленной
нехарактерны. Серную кислоту можно
получить из железного купороса
термическим разложением сульфата железа
с последующим охлаждением смеси:
 .
Серная кислота применяется для
производства минеральных удобрений,
как электролит в свинцовых аккумуляторах,
для дегидрации.
.
Серная кислота применяется для
производства минеральных удобрений,
как электролит в свинцовых аккумуляторах,
для дегидрации.
Общая характеристика элементов VA группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ. Нахождение в природе. Получение азота и фосфора.
К VA группе принадлежат:
азот, фосфор, мышьяк, сурьма, висмут. Эти
элементы имеют 5 электронов в наружном
слое атома, и характеризуются как
неметалы ( ).
Но способность к присоединению электронов
выражена слабее чем у соотвествующих
элементов VI и VII
групп. Высшая положительная окисленность
элементов этой подгруппы равна +5, а
отрицательная -3. Водородные соединения
АФМСВ (по первым буквам) не обладают
кислотными свойствами.
).
Но способность к присоединению электронов
выражена слабее чем у соотвествующих
элементов VI и VII
групп. Высшая положительная окисленность
элементов этой подгруппы равна +5, а
отрицательная -3. Водородные соединения
АФМСВ (по первым буквам) не обладают
кислотными свойствами.
Физические и химические свойства АФМСВ изменяются с увеличением порядкового номера в таблице менделеева - увеличиваются радиусы атомов (от 0,071 нм), уменьшается электроотрицательность, ослабевает оксилителная способность элементов и увеличиваетсяя проявление металлических свойств. В природе: азот находяиться в свободном состоянии в воздухе и в виде натривой силитры. Фосфор в природе находят в виде минерала фосфарита. МСВ – так же виде различных минералов.
Азот получают из воздуха. В лабараториях
получают азот из нитрита аммония ( )
который разлагается при сравнительно
небольшом нагревании:
)
который разлагается при сравнительно
небольшом нагревании:

Фосфор получают следующим образом:
Природный фосфорит или апатит измельчают,
смешивают с песком и углем и накаливают
в печах с помощью электрического тока
без доступа воздуха:
 Фосфор
выделяется в виде паров, которые
конденсируются в приемнике под водой.
Фосфор
выделяется в виде паров, которые
конденсируются в приемнике под водой.
Строение молекулы, физические и химические свойства, получение и применение аммиака. Свойства гидроксида и солей аммония.
Азот образует несколько соединений с водородом: из них наибольшее значение имеет аммиак.
Аммиак – бесцветный газ, с характерным
запахом. В лабаратории аммиак получают
нагреванием хлорида амония с гашеной
известью:
 Выделяющийся
аммиак сожержит пары воды, для осушения
его пропускают через смесь едкого натра
с известью. Аммиак значительно легче
воздуха. При охлождении до -33 С аммак
превращается в прозрачную жидкость.
Затвердевающую при -78 С.
Выделяющийся
аммиак сожержит пары воды, для осушения
его пропускают через смесь едкого натра
с известью. Аммиак значительно легче
воздуха. При охлождении до -33 С аммак
превращается в прозрачную жидкость.
Затвердевающую при -78 С.
При образовании молекулы аммиака
происходит
 гибридизация
атомных орбиталей азота. Из четырех
электронных пар три участвуют в
образовании связей H-N,
а одна остается неподеленной. В жидком
аммиаке молекулы
гибридизация
атомных орбиталей азота. Из четырех
электронных пар три участвуют в
образовании связей H-N,
а одна остается неподеленной. В жидком
аммиаке молекулы
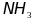 связаны между собой водородными связями,
что обуславливает его сравнительно
высокую температуру кипения. Аммиак
очень хорошо растворим в воде. Раствор
аммиака называют нашатырным спиртом.
Аммиак довольно активен, он вступает
во взаимодействие со многими веществами.
Азот в аммиаке имееи степень окисленности
-3. Поэтому аммиак обладает только
восстановительными свойсствами. Аммиак
не обладает кислотными свойствами. Если
аммиак взаимодействует с ионом водорода
то образуется ион аммония:
связаны между собой водородными связями,
что обуславливает его сравнительно
высокую температуру кипения. Аммиак
очень хорошо растворим в воде. Раствор
аммиака называют нашатырным спиртом.
Аммиак довольно активен, он вступает
во взаимодействие со многими веществами.
Азот в аммиаке имееи степень окисленности
-3. Поэтому аммиак обладает только
восстановительными свойсствами. Аммиак
не обладает кислотными свойствами. Если
аммиак взаимодействует с ионом водорода
то образуется ион аммония:
 Аммиак проявляет свойства основания.
Реагируя с кислотами, аммиак нейтрализует
их образуя соли аммония. Например:
Аммиак проявляет свойства основания.
Реагируя с кислотами, аммиак нейтрализует
их образуя соли аммония. Например:
 .
Водные растворы аммиака обладают
щелочной реакцией. Однако по установившейся
традиции водный раствор аммиака
обозначают формулой
.
Водные растворы аммиака обладают
щелочной реакцией. Однако по установившейся
традиции водный раствор аммиака
обозначают формулой
 и
называют гидроксидом аммония. Аммиак
– слабое основание. Большинство солей
аммония бесцветны и хорошо растворимы
в воде, по некоторым свойствам они
подобны солям щелочных металлов. Соли
аммония термически неустойчивы, при
нагревании они разлагаются. Гидроксиды
аммония обладают резким запахом.
и
называют гидроксидом аммония. Аммиак
– слабое основание. Большинство солей
аммония бесцветны и хорошо растворимы
в воде, по некоторым свойствам они
подобны солям щелочных металлов. Соли
аммония термически неустойчивы, при
нагревании они разлагаются. Гидроксиды
аммония обладают резким запахом.
Жидкий аммиак применяют в различных холодильных устройствах. Водные растворы применяются в химических лабораториях и производствах как слабое легколетучее основание, их используют в медицине и быту. Основная область применения аммиака – производство азотной кислоты.
