
- •Хлор. Электронное строение атома, молекулы. В природе. Получение и применение. Химические свойства (примеры реакций с водой, металлами и неметаллами). Соляная кислота.
- •Взаимодействие с водой:
- •Общая характеристика элементов via группы. Положение в периодической системе, строение и размер атомов, физические и химические (окислительно-восстановительные) свойства простых веществ.
- •Кислород. Нахождение в природе, получение и применение. Озон. “Озоновый щит”.
- •Кислотные и окислительно-восстановительные свойства, получение и применение серной кислоты.
- •Строение молекулы, физические и химические свойства, получение и применение аммиака. Свойства гидроксида и солей аммония.
- •Оксиды азота. Получение и свойства, образование в атмосфере и экологическая роль оксидов азота (II) и (IV).
- •Углеводороды. Нахождение в природе (газовые гидраты), а также получение и применение.
- •Карбонаты в природе. Получение и применение оксида углерода (IV). Сода.
- •Оксид кремния (IV). Кремниевая кислота. Силикагель. Гидролиз силикатов. Выветривание. Применение в промышленности (строительные материалы).
- •Алюминий. Нахождение в природе. Получение и применение.
- •Алюминий. Кислотно-основные свойства оксида и гидроксида, их применение.
- •Общая характеристика элементов iia группы. Положение в периодической системе, строение и размер атомов, физические и химические свойства простых веществ.
- •Жесткость воды. Цели и методы ее устранения. Образование сталактитов и сталагмитов. Опреснение морской воды (промышленные методы).
- •Первый ряд переходных элементов (3d-элементы). Строение атомов и проявляемые валентности. Примеры реакций получения простых веществ.
- •Гидроксиды 3d-элементов в состояниях высшей степени окисления (кислотно–оснόвные и окислительно-восстановительные свойства).
- •Железо. Строение атома и проявляемые валентности. В природе. Получение.
- •Железо. Строение атома. Оксиды и гидроксиды железа (II) и (III). Получение и свойства.
- •Взаимодействие с гироксидом натрия:
- •Взаимодействие с гидроксидом натрия:
- •Viiв группа. Строение атомов и проявляемые степени окисления. Сравнение с элементами viiа группы.
- •Оксиды и гидроксиды марганца (кислотно-оснόвные и окислительно-восстановительные свойства).
- •Viв группа. Строение атома, проявляемые степени окисления хрома. Гидроксиды (кислоты и основания) хрома.
- •Нахождение в природе элементов iia группы. Получение оксидов магния и кальция. Кислотно-основные характеристики и взаимодействие с водой оксидов и гидроксидов.
- •Iв группа. Строение атомов, проявляемые степени окисления. Сравнение свойств простых веществ с элементами iа группы в реакциях с водой и кислотами. Соединения меди (I), (II).
Кислород. Нахождение в природе, получение и применение. Озон. “Озоновый щит”.
Кислород – самый распрастраненный
элемент земной коры. В свободном состоянии
находится в атмосферном воздухе, в
связанном виде входит в состав воды,
минералов. Горных пород и всех веществ,
из которых построены организмы растений
и животных. Массовая доля кислорода в
земной коре 47%. Природный кислород
состоит из 3х стабильных изотопов:
 ,
,
 ,
,
 .
.
Кислород – бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха. Кислород образует 2х атомные молекулы, характеризующиеся выскокой прочностью. Он обладает магнитными свойствами, которые указывают на наличие двух неспаренных электронов. Кислород образует соединения со всеми химическими элементами кроме гелия, неона и аргона. Зарактерной особеностью многих реакций соединения с кислородом является выделение теплоты и света (горение)
В настоящее время в промышленности кислород получают из воздуха. В лабараториях кислород получают электролизом водных растворов щелочей.
Кислород играет исключительно важную роль в природе – при его участии происходит процеес ддыхания. Так же кислород участвует в процессах тления и гниения погибших организмов, тем самым обеспечивая круговорот органических веществ в природе.
Кислород применяют для интенсификации химических процессов на многих производствах (серная кислота). Кислород используют для получения высоких температур, в медицине.
Озон – вещество образующееся при пропускании электрических искр черещ кислород или воздух. Обладает специфическим запахом. Озон состоит из трех молекул кислорода. Для получения озона используют электрический ток. При обычных условиях озон – ядовитый газ. Озон – не устойчивое вещество, но очень сильный окислитель. Он окисляет все металлы кроме золота и платиновыз металлов. Он переводит низшие оксиды в высшие. Его применяют для обеззараживания воды и для дезинфекции воздуха.
Озоновый щит – озоновый слой – часть стратосферы на высоте от 12 до 50 км, в которой под воздействием ультрафиолетового излучения Солнца молекулярный кислород диссоциирует на атомы, которые образуют озон. Озоновый слой защищает все живущее на суше от губительного воздействиясолнечного ультрафиолета.
Оксиды неметаллов. Классификация. Получение и применение (по 3 примера оксидов каждого класса). Отношение к воде выбранных Вами оксидов.
Оксид неметалла – результат взаимодействия
кислорода и неметалла.Оксиды неметаллов
делятся на кислотные (которым
соответствубт кислоты ( ))
и несолеобразующие (которые не имеют
своих гидроксидов и не вступают в реакции
обмена
))
и несолеобразующие (которые не имеют
своих гидроксидов и не вступают в реакции
обмена
 )).
)).
1)
 - получают из печных газов, продуктов
разложения природных карбонатов.
Получают из воздуха. В лабораторных
условиях небольшие количества получают
взаимодействием карбонатов и
гидракарбонатов с кислотами (мрамор+соляная
кислота). Используют в пищевой
промышленности (газированная вода). В
пожаротушении, в качестве защиной среды
при сварке проволокой. При взаимодействии
с водой растворяется в ней образуя
угольную кислоту.
- получают из печных газов, продуктов
разложения природных карбонатов.
Получают из воздуха. В лабораторных
условиях небольшие количества получают
взаимодействием карбонатов и
гидракарбонатов с кислотами (мрамор+соляная
кислота). Используют в пищевой
промышленности (газированная вода). В
пожаротушении, в качестве защиной среды
при сварке проволокой. При взаимодействии
с водой растворяется в ней образуя
угольную кислоту.
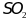 - получают сжиганием серы или обжигом
пирита:
- получают сжиганием серы или обжигом
пирита:
 Q.
В лабаратория получают действием
концентрированной серной кислоты на
малоактивные металлы при нагревании:
Q.
В лабаратория получают действием
концентрированной серной кислоты на
малоактивные металлы при нагревании:
 .
Применяют для производства серной
кислоты, для консервации слабоалкогольных
напитках. При взаимодействии с водой
растворяется в ней с образованием
сернистой кислоты.
.
Применяют для производства серной
кислоты, для консервации слабоалкогольных
напитках. При взаимодействии с водой
растворяется в ней с образованием
сернистой кислоты.
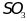 - получают оксиляя
кислородом воздуха при нагревании в
присутствии катализатора:
- получают оксиляя
кислородом воздуха при нагревании в
присутствии катализатора:
 или взаимодействием
c озоном:
или взаимодействием
c озоном:
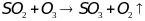 .
Применяют для производства серной
кислоты. При взаимодействии с водой
образуется едкая серная кислота.
.
Применяют для производства серной
кислоты. При взаимодействии с водой
образуется едкая серная кислота.
2) NO – получают
непосредственно из свободных элементов
соединением азота с кислородом при
выскоих температурах или электрическом
разряде. В природе образуется при
грозовом разряде:
 Применяют
для получения азотной кислоты. В воде
растворим плохо
Применяют
для получения азотной кислоты. В воде
растворим плохо
CO – получают при
горении углерода или соединений на его
основе в условии недостатка кислорода:
 или при разложении жидкой муравьиной
кислоты под дейсвтием горячей
концентрированной серной кислоты:
или при разложении жидкой муравьиной
кислоты под дейсвтием горячей
концентрированной серной кислоты:
 .
Применяется для обработки мяса
животных придовая им красный цвет и вид
свежести не изменяя их вкуса. В воде
растворим плохо.
.
Применяется для обработки мяса
животных придовая им красный цвет и вид
свежести не изменяя их вкуса. В воде
растворим плохо.
SiO – получают нагревая
крмений в недостатке кислорода выше
400 С:
 Применяют в технике, волоконной
оптике, полупроводниковых устройствах.
С водой взаимодействует при выскоих
температурах.
Применяют в технике, волоконной
оптике, полупроводниковых устройствах.
С водой взаимодействует при выскоих
температурах.
Оксиды металлов (металлические, ионные). Кислотно–оснόвные свойства. Получение и применение (по 2 примера). Отношение к воде выбранных Вами оксидов.
Оксид металла – результат
взаимодействия кислорода и металла.
Оксиды металлов бывают основными
(
 ),
кислотными (
,
)
и амфотерными (
),
кислотными (
,
)
и амфотерными ( ).
).
Кислотные свойства оксидов при движении по периоду слева направо возрастают, а основные ослабевают. При движении сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают.
1)
-
получают взаимодействием металлического
лития с кислородом:
 .
С водой образует щелочь
.
С водой образует щелочь
 .
Применяют как компонент специальных
стекол, глазурей и эмалей.
.
Применяют как компонент специальных
стекол, глазурей и эмалей.
- получают взаимодействием
металлического натрия с кислородом:
 .
C водой образует щелочь -
.
C водой образует щелочь -
 .
Применяется как реактив для синтеза
других веществ.
.
Применяется как реактив для синтеза
других веществ.
2) - получают из печных газов, продуктов разложения природных карбонатов. Получают из воздуха. В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидракарбонатов с кислотами (мрамор+соляная кислота). Используют в пищевой промышленности (газированная вода). В пожаротушении, в качестве защиной среды при сварке проволокой. При взаимодействии с водой растворяется в ней образуя угольную кислоту.
- получают оксиляя кислородом воздуха при нагревании в присутствии катализатора: или взаимодействием c озоном: . Применяют для производства серной кислоты. При взаимодействии с водой образуется едкая серная кислота.
3)ZnO – существует как природный минерад цинкит. В воде растворим плохо. Применяют как катализатор синтеза метанола, в медицине
SnO – получают из диоксида
олова,
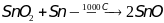 .
В воде не растворим. Применяют для
синтеза других соединений олова.
.
В воде не растворим. Применяют для
синтеза других соединений олова.
Пероксиды. Окислительно-восстановительные свойства, получение и применение пероксида водорода. Взаимодействие пероксидов и надпероксидов с углекислым газом.
Пероксиды
– сложные вещества в которых атомы
кислорода соединены друг с другом.
Пероксиды бывают – перекисями
(сложные вещества содержащие пероксокруппу
–О-О- # ),
надпероксидами
(неорганические соединения, содержащие
анион
),
надпероксидами
(неорганические соединения, содержащие
анион
 #
# )
и озонидами
( неорганические соединения содержащие
ион
)
и озонидами
( неорганические соединения содержащие
ион
 или продукты непредельных органических
соединений с озоном).
или продукты непредельных органических
соединений с озоном).
Перекись водорода обладает как осиклительными (более характерно), так и восстановительными свойствами.
Перекись в качестве
окислителя:
 Перекись в качестве восстановителя:
Перекись в качестве восстановителя:

Если сложить
уравнения, отвечающие восстановлению
пероксида водорода и его окислению, то
получиться уравнение
самоокисления-самовосстановления
пероксида водорода (уравнение процесса
разложения перекиси водорода):
 Пероксид
водорода получают анодным окислением
растворов серной кислоты с последующим
гидролизом образующейся при этом
кислоты:
Пероксид
водорода получают анодным окислением
растворов серной кислоты с последующим
гидролизом образующейся при этом
кислоты:

Перекись водорода
применяют для отбелки тканей и мехов,
в медицине, в пищевой промышленности и
для обновления старых картин, написаных
масляными красками и потемневших от
времени свинцовых белил:

