
Ароматические углеводороды
это углеводороды, в молекулах которых содержаться одно или несколько бензольных колец, особая циклическая группировка из шести атомов углерода.
Классификация аренов
♦ моноциклические(одноядерные) ♦ полициклические
•конденсированные •неконденсированные




 бензол нафталин
дифенил
бензол нафталин
дифенил


 монозамещенные:
дизамещенные:
монозамещенные:
дизамещенные:




 СН3
СН3
антрацен
СН2
СН3
СН3
антрацен
СН2
дифенилметан
м-ксилол
толуол
СН3
Бензол
 Н
Н





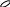 Н
С Н С(3σ – 3е)
угол
= 120
Н
С Н С(3σ – 3е)
угол
= 120




 ПСМ - плоскостное
ПСМ - плоскостное

 С С
С*…
Lc_c
= 0,140 нм
С С
С*…
Lc_c
= 0,140 нм
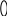


 С С S
+ 2P
SP
С С S
+ 2P
SP


 Н
С Н + 2 3
Н
С Н + 2 3
Н
CnH2n-6, n ≥ 6 СН3 С2Н5 СН3
 C6H6
C7H8
C8H10
СН3
C6H6
C7H8
C8H10
СН3
C6H5- CH3 C6H5- C2H5
метилбензол C6H4- (CH3) 2 этилбензол 1,2-диметилбензол
(толуол)
У гомологов и производных бензола – изомерия взаимного положения (о-ксилол) заместителей (число и строение заместителей)
СН3 СН3 СН3 C8H10 С2Н5 СН3
СН3
этилбензол 1,3-диметилбензол 1,2-диметилбензол СН3 1,4-диметилбензол
м-ксилол о-ксилол n-ксилол
tкип = 139 tкип = 141 tкип = 136
tпл = -54 tпл = -27 tпл = +15
Физические свойства :
C6H6 - б/ц жидкость с характерным запахом, нерастворим в воде, растворяется в полярных растворителях : спирт, хлороформ. Огнеопасен, токсичен.
tкип = 81,1
tпл = 5,53
Химические свойства :
I. р. Окисления
1) Горение
t
2C6H6 + 15О2 → 12O2↑ + 6Н2О - горит коптящим пламенем
2) Отношение к окислителям: при н.у. с KMnO4, Br2 не взаимодействует. В жестких условиях идет окисление О2 воздуха в присутствии V2O5 при t = 350 – 400, при этом образуется малеиновый ангидрид.


 V2O5
HC
C
O
V2O5
HC
C
O
 +
4,5О2
→
O
+ 2CO2↑
+ 2H2O
+
4,5О2
→
O
+ 2CO2↑
+ 2H2O
t HC C O
малеиновый ангидрид
Легче окисляются гомологи бензола, окислению подвергается боковая цепь, бензольное кольцо устойчиво к окислению (н.у)
 О
О
СН3 + 3[О] → С + H2O
 KMnO4
ОН
KMnO4
ОН
Бензойная кислота
II. р. Замещения (Механизм – Se – электрофильное замещение)

 А
– В ↔ А + В
А
– В ↔ А + В




 +А
А H
H
A
+А
А H
H
A
 → → A
A
→
→ → A
A
→
![]() -комплекс
σ –комплекс -
H
-комплекс
σ –комплекс -
H
1) Галогенирование
AlCl(FeBr3)
C6H6 + Cl2 → C6H6Cl + HCl
25
III. р. Нитрования
t
C6H6 + НО-NO2 → C6H5-NO2 + H2O
Н2SO4 (к) (нитробензол)
МЕХАНИЗМ
NO2 – О[H + HO] SO3H → NO2 – O – SO3H + H2O
нитросерная
NO2 – O – SO3H ↔ [NO2] + [HSO4]
NO2 H NO2
+ NO2 → → NO2 → + H , HSO4 + H → H2SO4
-комплекс σ –комплекс
1) Сульфирование
t
C6H6 + НO – SO3H(дым) → C6H5 – SO3H
-H2O сульфобензол (бензолсульфокислота)
600
C6H6 + 6Cl2 → C6Cl6 + 6HCl
 AlCl3
гексахлорбензол
AlCl3
гексахлорбензол
IV. р. Алкилирования (по Фриделю-Крафтса) - взаимодействие с алкенами или галогеноалканами в присутствии AlCl3 , t = 600 – 700
CH3 → Сl + AlCl3 → CH3[AlCl4]
CH3[AlCl4] + C6H6 → C6H5 – CH3 + HCl + AlCl3
CH

 AlCl3
СН3
HC
CH AlCl3
CH2
CH3
AlCl3
СН3
HC
CH AlCl3
CH2
CH3
+CH3→Сl → + HCl + H2C=CH2 →
600 метилбензол HC CH 700 этилбензол
CH
V. р. Присоединения
 CH
CH
1) Гидрирование HC CH W
HC CH + 3H2 → циклогексан
CH 150 - 160
Cl
 2) Присоединение
Cl2.
hv
Cl
Cl
2) Присоединение
Cl2.
hv
Cl
Cl
+ 3Cl 2 → гексахлорциклогексан
Cl Cl (гексахлоран)
Cl
