
- •Органика
- •Теория химического строения органических соединений Бутлерова. Ее современная трактовка. Виды и природа химических связей. Взаимное влияние атомов в молекуле и его приода.
- •Алканы. Строение, изомерия, номенклатура, физ. Свойства. Способы и источники получения алканов. Химические свойства алканов.
- •Полимеризация алкенов. Виды и механизмы цепной полимеризации. Полиэтилен. Полипропилен. Стереорегулярные полимеры.
- •Алкины. Строения, изомерия, номенклатура, способы получения, физические свойства. Промышленное получение ацетилена. Химический свойства алкинов. Реакции присоединения, их промышленное значение.
- •Алкадиены. Изомерия, номенклатура, получение, физические свойства. Сопряженные диены. Свойства сопряженных π-связей.
- •Химические свойства сопряженных диенов. Реакции присоединения. Полимеризация и сополимеризация. Натуральный и синтетический каучук.
- •Арены для бензола. Изомерия, номенклатура, природные источники и методы получения. Физические свойства и строение. Химические свойства аренов. Правила замещения в бензольном ядре.
- •Галогенпроизводные углеводородов. Химические свойства галогеналканов. Реакции замещения и отщепления. Правило Зайцева.
- •Полигалогеналканы. Получение, номенклатура. Физические и химические свойства. Области применения.
- •Галогеналкены. Получение, номенклатура. Физические и химические свойства. Поливинилхлорид, фторопласт.
- •Галогенарены. Получение, номенклатура. Физические и химические свойства.
- •Многоатомные спирты. Гликоли. Классификация, номенклатура, свойства. Получение и применение этиленгликоля и глицерина.
- •Фенолы. Изомерия, номенклатура, методы получения. Физические и химические свойства. Полифенолформальдегидные пластмассы.
- •Альдегиды и кетоны. Классификация, изомерия, номенклатура, способы получения. Химические свойства карбонильных соеднинений.
- •Монокарбоновые кислоты. Классификация и номенклатура. Промышленные и лабораторные методы получения. Физический свойства и строение. Водородная связь.
- •Непредельные кислоты. Способы получения, свойства. Акриловая и метакриловая кислоты, полимеры на их основе.
Алкины. Строения, изомерия, номенклатура, способы получения, физические свойства. Промышленное получение ацетилена. Химический свойства алкинов. Реакции присоединения, их промышленное значение.
Алки́ны — углеводороды, содержащие тройную связь между атомами углерода, с общей формулой CnH2n-2.
Логично, что для ненасыщенных связей характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода.
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Согласно
номенклатуре ИЮПАК при построении
названий алкинов в названиях соответствующих
полностью насыщенных углеводородов
суффикс -ан заменяется суффиксом -ин:
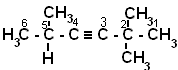 2, 2, 5- триметилгексин-3
2, 2, 5- триметилгексин-3
Углеводороды две или больше тройных связей, называются алкадиинами, алкатриинами и т. д.Углеводороды, содержащие одновременно двойные и тройные связи, называются алкенинами, алкадиенинами, алкендиинами и т. д. в соответствии с числом двойных и тройных связей. Углеродные атомы с кратными связями должны иметь наименьшие номера.
Способы получения.
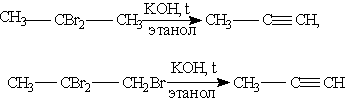
1.
Общим способом получения алкинов
является реакция дегидрогалогенирования
- отщепления двух молекул галогеноводорода
от дигалогензамещенных алканов, которые
содержат два атома галогена либо у
соседних атомов углерода (например,
1,2-дибромпропан), либо у одного атома
углерода (2,2-дибромпропан). Реакция
происходит под действием спиртового
раствора гидроксида калия:
2.
Важнейший из алкинов — ацетилен —
получают в промышленности путем
высокотемпературного крекинга метана:
![]()
В
лаборатории ацетилен можно получить
гидролизом карбида кальция:
![]()
Физические свойства
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению
В промышленности ацетилен часто[1] получают действием воды на карбид кальция (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Химический свойства
Химические свойства. Тройная связь образуется двумя атомами углерода в sp-гибридном состоянии. Две s -связи расположены под углом 180°, а две p -связи расположены во взаимно перпендикулярных областях. Наличие p -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что p -электронная плотность тройной связи расположена более комплексно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1.
Галогенирование. Галогены присоединяются
к алкинам в две стадии. Например,
присоединение брома к ацетилену приводит
к образованию дибромэтена, который, в
свою очередь, реагирует с избытком брома
с образованием тетрабромэтана:
![]()
2.
Гидрогалогенирование. Галогеноводороды
присоединяются к тройной связи труднее,
чем к двойной. Для активации галогеноводорода
используют АlСl3 — сильную кислоту
Льюиса. Из ацетилена при этом можно
получить винилхлорид (хлорэтен), который
используется для получения важного
полимера — поливинилхлорида;
![]()
3.
Гидратация. Присоединение воды к алкинам
катализируется солями ртути (П) (реакция
Кучерова):
![]()
На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом p -связь между атомами углерода разрывается и образуется p -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С == О по сравнению с двойной связью С == С.
В
результате реакции гидратации только
ацетилен превращается в альдегид,
гидратация гомологов ацетилена протекает
по правилу Марковникова, и образующиеся
енолы изомеризуются в кетоны. Так, пропин
превращается в ацетон:
![]()
4.
Кислотные свойства. Особенностью
алкинов, имеющих концевую тройную связь,
является их способность отщеплять
протон под действием сильных оснований,
т, е, проявлять слабые кислотные свойства.
Возможность отщепления протона
обусловлена сильной поляризацией s
-связи º С¬ Н. Причиной поляризации
является высокая электроотрицательность
атома углерода в sp-гибридном состоянии.
Поэтому алкины, в отличие от алкенов и
алканов, способны образовывать соли,
называемые ацетиленидами.
![]()
Ацетилениды
серебра и меди (I) легко образуются и
выпадают в осадок при пропускании
ацетилена через аммиачный раствор
оксида серебра или хлорида меди (I). Эта
реакция служит для обнаружения алкинов
с тройной связью на конце цепи:
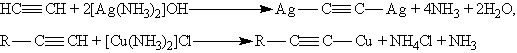
Ацетилениды
серебра и меди как соли очень слабых
кислот легко разлагаются при действии
хлороводородной кислоты с выделением
исходного алкина:
![]()
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, давая винилацетилен:
![]()
Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
![]()
При
пропускании ацетилена над активированным
углем при 600 °С происходит тримеризация
ацетилена с образованием бензола:
![]()
6.
Реакции окисления и восстановления.
Алкины окисляются различными окислителями,
в частности перманганатом калия. При
этом раствор перманганата калия
обесцвечивается, что служит указанием
на наличие тройной связи. При окислении
обычно происходит расщепление тройной
связи и образуются карбоновые кислоты:
![]()
В
присутствии металлических катализаторов
алкины восстанавливаются путем
последовательного присоединения молекул
водорода, превращаясь сначала в алкены,
а затем в алканы:
![]()
Способы получения
Имеющий важнейшее промышленное значение ацетилен получают в настоящее время частичным термическим разложением метана:
При этом важную роль играет практически мгновенное охлаждение продуктов — иначе процесс пойдет дальше и получатся углерод и водород.
Ранее в промышленности (а сейчас в полевых условиях и в лаборатории) ацетилен получается действием воды на карбид кальция (который, по сути дела, представляет собой ацетиленид кальция):
СаС2+2Н2О=Са(ОН)2+C2H2
Общим методом получения алкинов в лаборатории является дегидрогалогенирование дигалогеналканов:
При этом атомы галогена должны располагаться при одном атоме углерода. Получение алкина возможно также из виц-дигалогенида (атомы галогена расположены при соседних атомах углерода), если структура молекулы исключает возможность образования сопряженного диена (иначе получится именно он!).
