
- •Хром. Теоретическая часть
- •Марганец. Теоретическая часть
- •Медь. Теоретическая часть
- •Цинк, кадмий, ртуть. Теоретическая часть.
- •Практическая часть
- •Опыт № 12 Получение и свойства гидроксида цинка. К раствору соли цинка (II) добавим гидроксида натрия до получения осадка. Осадок разделим на три части:
- •Контрольные вопросы
Практическая часть
Опыт № 6. Получение и свойства гидроксида хрома (III)
К раствору соли хрома (III) добавим по каплям раствор гидроксида натрия. Полученный осадок разделим на две пробирки: а) к первой добавим избыток кислоты: б) ко второй - избыток едкого натра.

Опыт № 11 Влияние карбоната натрия на гидролиз соли хрома (III)
К раствору соли хрома (III) добавляем равный объем раствора карбоната натрия Na2CO3. Наблюдаем образование осадка Cr(OH)3.
![]()

H2O CO2
Опыт № 13 Получение гидроксида марганца и изучите его свойств.
К раствору соли марганца (II) добавляем избыток раствора щелочи. Разделим осадок на две пробирки.
а) Осадку в первой пробирке даем постоять 5-10 мин. Осадок постепенно темнеет, так как гидроксид марганца (II) на воздухе окисляется до оксид-гидроксида марганца (II).
![]()
б) К осадку гидроксида марганца (II) во второй пробирке добавляем бромную воду.
![]()
Вывод: Mn(OH)2 легче окисляется на воздухе в присутствии бромной воды.
Опыт № 3 Получение и свойства гидроксида меди (II).
К раствору соли меди (II) добавим щелочи до получения осадка. Осадок разделим на три части:
а) к одной части добавим избыток щелочи;
б) ко второй части - кислоту;
в) третью оставим для следующего опыта.

Вывод: гидроксид меди (II) проявляет незначительную амфотерность.
Опыт № 4 Непрочность гидроксида меди (II)
Осадок гидроксида меди (II), полученный в опыте 3, нагреем на небольшом пламени горелки. Осадок изменяет цвет.
![]()
Вывод: При нагревании гидроксид меди (II) переходит в оксид.
Опыт № 5 Характерная реакция на ион Cu2+
К раствору соли меди (II) добавим по каплям раствор аммиака. Затем добавим избыток аммиака. Осадок растворяется, раствор меняет цвет.
![]()
Опыт № 9 Образование карбоната гидроксомеди (малахита) при совместном гидролизе солей меди (II) и карбоната натрия.
К раствору меди добавим равный объем карбоната натрия.
![]()
Опыт № 12 Получение и свойства гидроксида цинка. К раствору соли цинка (II) добавим гидроксида натрия до получения осадка. Осадок разделим на три части:
а) к первой части полученного осадка добавим избыток раствора едкого натра до образования прозрачного раствора;
б) ко второй – раствор HCl до образования прозрачного раствора;
в) к третьей - раствор аммиака до полного растворения.

Вывод: Zn(OH)2 – амфотерен.
Опыт № 15 Получение и свойства гидроксида кадмия (II).
К раствору соли кадмия добавим гидроксида натрия до получения осадка. Осадок разделим на три части:
а) к первой части полученного осадка добавим избыток раствора едкого натра. В отличие от гидроксида цинка гидроксид кадмия не растворяется в избытке щелочи;
б) ко второй - раствор соляной кислоты;
в) к третьей - раствор аммиака до полного его растворения
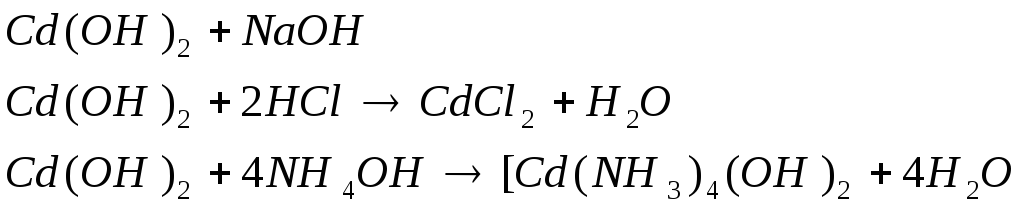
Вывод: Cd(OH)2 проявляет основные свойства.
Контрольные вопросы
1.
-
Формула гидроксида
Цвет осадка
Отношение к кислоте
Отношение к щелочи
Характер
Al(OH)3
Белый
Осн.
К-ное
Амфотерен
Pb(OH)2
Белый
Осн.
К-ное
Амфотерен
3. Al+NaOH=[Al(OH)4(H2O)2]
Гидроксид алюминия амфотерен, поэтому необходимо сильное основание, например NaOH.
4. NaCH3COO – смещение вправо
HCl – влево (кислый р-р замедляет гидролиз)
Na2CO3 – вправо (CO2(газ) + H2O) гидролиз усиливается.
6. Т.к р-р щелочи растворяет оксидную пленку на поверхности алюминия.
Стр. 31
4.

Стр. 50
6.
![]()
