
- •Вода. Полимеры.
- •Влияние температуры на направление реакции. Энергия Гиббса.
- •Коллоидные системы – это высокодисперсные гетерогенные системы, характеризующиеся сильно развитой поверхностью раздела фаз
- •Электроотрицательность (э.О.) – способность атома притягивать или отталкивать электронные пары химической связи.
- •Комплексные соединения.
- •Химическая кинетика изучает скорость и механизм протекания химических процессов, а так же их зависимость от различных факторов.
Комплексные соединения.
Комплексные соединения – сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму.
Комплексообразователь – центральный атом, нейтральный атом или ион. d и f металлы.
Лиганды – анионы (F‾, Cl‾, SO4І‾), нейтральные молекулы имеющие неподеленные электронные пары. Если лиганд занимает одно место около центра, т.е. обладает одной общей парой, то он называется монодентатным (NH3, Cl‾, SO4І‾,Н2О). Бидентатный лиганд может занимать и одно место (SO4І‾,СО3І‾). Полидентатный – 3...8 донорных атомов.
Координационное число – число мест вокруг комплексообразователя, занятых лигандами.
Поведение КС в водном р-ре: диссоциирует:
Как сильный электролит → на внутр. и внешн. сферы
Как слабый электролит → внутр. сфера
Диссоциация внутр. сферы – процесс равновесный и характеризуется Кр или Кн. Чем меньше Кн, тем прочнее комплекс.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Химическая кинетика изучает скорость и механизм протекания химических процессов, а так же их зависимость от различных факторов.
Скоростью химических реакций называется изменение концентрации за единицу времени. Т.к. концентрация непрерывно меняется во времени, то и скорость непрерывно меняется во времени.
Факторы, влияющие на скорость реакции:
Природа реагирующих веществ. Необходимым, но недостаточным условием осуществления химического взаимодействия между частицами является их столкновение. Взаимодействие происходит лишь в том случае, если частицы приближаются на расстояние, на котором становится возможным перераспределение электронной плотности. Следовательно частица должна обладать некоторой энергией для преодоление энергетического барьера другой частицы, которая называется энергией активации Ea. Для атомов – это энергия отталкивания между электронными облаками, для молекул – энергия разрыва связей. Однако для большинства молекул реакция протекает через образование так называемого активированного комплекса. При обычных условиях достаточно быстро протекают реакции с Ea<100 кДж.
Химическая кинетика изучает скорость и механизм протекания химических процессов, а так же их зависимость от различных факторов.
Скоростью химических реакций называется изменение концентрации за единицу времени. Т.к. концентрация непрерывно меняется во времени, то и скорость непрерывно меняется во времени.
Факторы, влияющие на скорость реакции:
Природа реагирующих веществ. Необходимым, но недостаточным условием осуществления химического взаимодействия между частицами является их столкновение. Взаимодействие происходит лишь в том случае, если частицы приближаются на расстояние, на котором становится возможным перераспределение электронной плотности. Следовательно частица должна обладать некоторой энергией для преодоление энергетического барьера другой частицы, которая называется энергией активации Ea. Для атомов – это энергия отталкивания между электронными облаками, для молекул – энергия разрыва связей. Однако для большинства молекул реакция протекает через образование так называемого активированного комплекса. При обычных условиях достаточно быстро протекают реакции с Ea<100 кДж.
ЗДМ в кинетике: скорость реакции в каждый момент времени пропорциональна произведению концентрации реагирующих частиц, возведенных в некоторую степень.
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
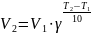
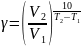
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции k от температуры T.
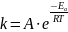
Здесь A характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная.
Молекулярность реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Влияние температуры на направление реакции. Энергия Гиббса.
Суммарное влияние энергетических и энтропийных факторов при постоянном давлении и температуре отражает изменение изотермического потенциала, который называется изменением свободной энергии Гиббса: ∆G=∆H-T∆S. Свободной энергией Гиббса называется энергия, складываемая из энергий химических связей. Знак ∆G есть критерий термодинамической вероятности самопроизвольного протекания процесса в данных условиях (p,T=const). При данных условиях могут самопроизвольно протекать только те процессы ∆G для которых меньше 0. Из уравнения видно, что можно определить направление процесса при любой температуре, но данный расчет приблизителен, т.к. не учитывается температурная зависимость энтальпии и энтропии. При низких температурах протекают главным образом экзотермические реакции. При высоких температурах главную роль играет энтропийный член уравнения, что видно на примере того, что реакции разложения сложных веществ на простые в основном протекают при высокой температуре.
Стандартной энергией Гиббса вещества называется энергия получения данного вещества при стандартных условиях. Стандартных условий на практике не существует, поэтому все расчеты с применением стандартных значений – приблизительные.
Электронная формула — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Принцип минимума энергии – последовательное заполнение электронов в атоме должно отвечать как минимуму энергии самого электрона, так и минимуму энергии атома в целом.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
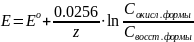
Раствор – это многокомпонентная гомогенная система переменного состава.
Концентрация: величина, характеризующая количественный состав раствора.
Способы выражения концентрации:
Массовая доля:
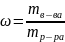
Мольная доля:

Моляльная доля:
