
- •3. Газовые законы. Закон объемных отношений Гей-Люссака.
- •Молярный объём газа – это объем газа в котором содержится 1 моль частиц этого газа
- •7. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы. Изотопы.
- •8. Квантово-механическая модель атома.
- •15. Типы химических связей.
- •17. Метод валентных связей. Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул. Пространственное строение молекул bf3, h2o, ch4.
- •20. Металлическая связь. Понятие электронного газа. Проводники, полупроводники, диэлектрики.
- •24. Понятие о координационном числе центрального атома и дентатности лигандов. Хелаты.
- •23. Диссоциация комплексных соединений. Ступенчатая диссоциация комплексных ионов. Общая (полная) константа нестойкости комплексных ионов как мера их устойчивости.
- •22. Комплексные соединения. Структура. Классификация. Номенклатура.
- •46. Степень окисления элементов и правила её определения. Примеры определения степени окисления в соединениях, содержащих более двух различных элементов.
- •Ряд активности металлов.
- •34. Понятие об энергии активации. Уравнение Аррениуса. Катализаторы.
- •30. Оксиды, их классификация. Виды связей. Химические свойства.
- •Основные химические свойства:
- •35. Общие представления о растворах. Растворимость газа в жидкости, растворимость жидкости в жидкости. Растворимость твердого тела в жидкости.
- •40. Труднорастворимые электролиты. Равновесие раствор-осадок. Произведение растворимости. Связь растворимости и произведения растворимости на примере BaSo4.
- •39. Ионное произведение воды. Водородный показатель. Определение pH водных растворов сильных и слабых электролитов.
- •45. Способы выражения количественного состава растворов.
Ряд активности металлов.
Металлы, которые вытесняют водород из кислот |
Металлы, которые не вытесняют водород из кислот |
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb |
Cu Hg Ag Pt Au |
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части таблицы. Под силой кислоты понимают ее способность отдавать ионы водорода H+.
С точки зрения электролитической диссоциации, все общие характерные свойства кислот (кислый вкус, изменение цвета индикатора, взаимодействие с основаниями, основными оксидами, солями) обусловлены ионами водорода H+, точнее, ионами гидроксония H3O+
Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при нагревании
4HNO3 –t°,hn® 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
4. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) ® H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 ® H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O ® 5NO + 3H3P+5O4



28. Основания, их классификация. Амфотерные основания. Химические свойства на основе представлений об электролитической диссоциации.
Основания — электролиты, при диссоциации которых образуется только один вид
анионов — гидроксид-ионы.
![]()
Классификация оснований
1. Растворимые в воде (щелочи) — гидроксиды металлов главных подгрупп I
и II групп.
![]()
2. Нерастворимые в воде — гидроксиды остальных металлов.
![]()
Химические свойства. Щелочи изменяют окраску индикаторов (лакмус
становится синим, фенолфталеин – малиновым).
Взаимодействие с кислотами:
![]()
Взаимодействие с кислотными оксидами:
![]()
Растворы щелочей вступают в реакции ионного обмена с растворами солей, если
образующийся при этом гидроксид нерастворим в воде:
![]()
При нагревании слабые основания разлагаются на оксиды металлов и воду:
![]()
Получение оснований. Щелочи получают электролизом растворов солей.
Электролиз раствора хлорида натрия. Процессы на катоде и аноде:
![]()
Уравнение реакции:
![]()
Нерастворимые в воде основания получают реакцией обмена со щелочами:
34. Понятие об энергии активации. Уравнение Аррениуса. Катализаторы.
Уравнение
Аррениуса.
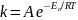 ,
где А – предэкспоненциальный множитель,
,
где А – предэкспоненциальный множитель,
 – энергия активации реакции; Т –
абсолютная температура.
– энергия активации реакции; Т –
абсолютная температура.
В химической кинетике часто пользуются уравнением Аррениуса в логарифмической форме:

Из уравнения следует, что зависимость константы скорости химической реакции от температуры линейна
Энергия активации равна разности между средней энергией реагирующих частиц и энергией активированного комплекса. Энергия активации является характеристикой каждой реакции и определяет влияние на скорость химической природы реагирующих веществ.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется ЭНЕРГИЕЙ АКТИВАЦИИ (кДж/моль) данной реакции. Молекулы, обладающие такой энергией, называются активными молекулами. Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или ослабления связей между атомами в молекулах исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Вещества, не расходующиеся в результате протекания химической реакции, но влияющие на её скорость, называются КАТАЛИЗАТОРАМИ. Биологические катализаторы белкового происхождения называются ферментами. УРАВНЕНИЕ АРРЕНИУСА описывает зависимость константы скорости от температуры: κ(T)=A·e-E/(RT) где А- постоянная, зависящая от природы реагирующих веществ.
