
- •3. Газовые законы. Закон объемных отношений Гей-Люссака.
- •Молярный объём газа – это объем газа в котором содержится 1 моль частиц этого газа
- •7. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы. Изотопы.
- •8. Квантово-механическая модель атома.
- •15. Типы химических связей.
- •17. Метод валентных связей. Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул. Пространственное строение молекул bf3, h2o, ch4.
- •20. Металлическая связь. Понятие электронного газа. Проводники, полупроводники, диэлектрики.
- •24. Понятие о координационном числе центрального атома и дентатности лигандов. Хелаты.
- •23. Диссоциация комплексных соединений. Ступенчатая диссоциация комплексных ионов. Общая (полная) константа нестойкости комплексных ионов как мера их устойчивости.
- •22. Комплексные соединения. Структура. Классификация. Номенклатура.
- •46. Степень окисления элементов и правила её определения. Примеры определения степени окисления в соединениях, содержащих более двух различных элементов.
- •Ряд активности металлов.
- •34. Понятие об энергии активации. Уравнение Аррениуса. Катализаторы.
- •30. Оксиды, их классификация. Виды связей. Химические свойства.
- •Основные химические свойства:
- •35. Общие представления о растворах. Растворимость газа в жидкости, растворимость жидкости в жидкости. Растворимость твердого тела в жидкости.
- •40. Труднорастворимые электролиты. Равновесие раствор-осадок. Произведение растворимости. Связь растворимости и произведения растворимости на примере BaSo4.
- •39. Ионное произведение воды. Водородный показатель. Определение pH водных растворов сильных и слабых электролитов.
- •45. Способы выражения количественного состава растворов.
17. Метод валентных связей. Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул. Пространственное строение молекул bf3, h2o, ch4.
Метод валентных связей.
А) химическая связь между двумя атомами возникает как результат перекрытия АО с образованием электронных пар.
Б) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.
В) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с разными спинами.
Г) характеристики химической связи (энергия, длина, полярность) определяются типом перекрывающихся АО.
Метод валентных связей. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Гибридизация атомных орбиталей – изменение формы некоторых атомных орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа.
Наиболее распространены следующие типы гибридизации:
sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые гибридные орбитали, оси которых расположены под углом 109,50 друг к другу. sp3-гибридизация имеет место в молекулах NH3, Н2О и во всех предельных углеводородах.
sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые гибридные орбитали, оси которых расположены под углом 1200 друг к другу. sp2-гибридизация имеет место в молекулах BF3, AlCl3, а также во всех этиленовых и ароматических углеводородах.
sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые гибридные орбитали, оси которых расположены под углом 1800 друг к другу. sp-гибридизация имеет место в молекулах BeH2, BeF2, CO2, а также во всех ацетиленовых углеводородах.
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
18. Метод молекулярных орбиталей. Порядок и энергия связи. Применение ММО для описания ковалентной связи в гомоядерных двухатомных молекулах элементов второго периода периодической системы на примере О2.
ММО – квантово-химический метод описания химической связи, рассматривающий молекулу и любую многоатомную систему как «многоядерный атом», в котором электроны заселяются по молекулярным орбиталям. Основные положения:
Основные положения ММС: 1) рассматривается деколализация только валентных электронов ns (n-2)d np 2) рассматривают фолновые ф-ции электронов в поле нескольких центров, имеющих определённые эффективные заряда. Эти волновые ф-ции-молекулярные орбитали (МО) 3) МО рассматриваются как результат комбинации волновых ф-ций электронов сближающихся атомов.
. В молекуле О2 в образовании хим.связей принимают участие по четыре 2p-электрона каждого атома. Шесть электронов занимают три связывающих МО, а два размещаются на разрыхляющих МО π разр 2p. Здесь избыток числа связывающих электронов над разрыхляющими равен 4, а кратность связи 2. В молекуле О2 имеются два неспаренных электрона, следовательно, она является парамагнетиком. При образовании иона О2+ из молекулы О2 удаляется электрон, находящийся на разрыхляющей орбитали, т.е. электрон обладающий максимальной энергией. Отсюда увеличивается кратность связи и образуется более прочная молекула.
Порядок
и энергия связи.
В методе МО вместо кратности связи
вводится понятие порядок связи n,
который равен половине разности числа
электронов на связывающих
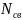 и разрыхляющих
и разрыхляющих
 МО
МО
 .
.
Если
число
 ,
то n=0
и молекула не образуется. С увеличением
n
в однотипных молекулах растет энергия
связи.
,
то n=0
и молекула не образуется. С увеличением
n
в однотипных молекулах растет энергия
связи.
В отличие от ВС в методе МО допускается, что химическая связь может быть образована не только парой, но и одним электроном и соответственно порядок связи может быть не только целым, но и дробным числом: n=1/2, 1, 3/2, 2, 5/2, 3…
