
- •Основные типы структур неорганических соединений. Вещества с молекулярной и немолекулярной структурой. Атомные, молекулярные, ионные и металлические кристаллические решетки .
- •Строение электронных оболочек атома. Волновая теория строения атома. Понятие об электронном облаке.
- •Квантовые числа как характеристика состояния электрона в атоме. Физический смысл квантовых чисел. Энергетический уровень, подуровень. Атомная орбиталь. Форма и ориентация электронных облаков.
- •Принцип Паули и емкость электронных оболочек. Правило Хунда. Порядок заполнения атомных орбиталей. Правила Клечковского. Строение электронных оболочек атомов химических элементов.
- •Химическая связь. Основные типы химической связи. Полярность связи как функция разности электроотрицательностей химических элементов.
- •Количественные характеристики химической связи: энергия связи, длина, валентный угол. Полярность связи и полярность молекулы в целом, дипольный момент молекулы.
- •Ковалентная связь. Основные положения метода валентных связей .Спиновая теория валентности. Обменный и донорно-акцепторный механизм образования ковалентной связи.
- •3) Химическая связь в методе вс является двухцентровой и локализована в области между ядрами двух атомов ее образующих.
- •Валентность и степень окисления химических элементов в их соединениях.
- •Одиночные и кратные связи. Сигма- и пи- связи.
- •Ионная связь. Простые и сложные ионы. Ионные кристаллические решетки. Концепция поляризации ионов.
- •Металлическая связь .Металлические кристаллические решетки .
- •Водородная связь. Природа и механизм образования водородной связи
- •Зависимость физических свойств веществ с молекулярной структурой от характера межмолекулярного взаимодействия. Влияние водородной связи на свойства веществ.
- •Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). Ориентационное, индукционное и дисперсионное взаимодействие.
- •Химические реакции. Классификация химических реакций. Основные задачи химической кинетики и химической термодинамики.
- •Химическая система. Функция состояния системы. Работа и теплота. Изменение внутренней энергии системы в ходе химических превращений
- •Первое начало термодинамики. Энтальпия. Изменение энтальпии в ходе химического процесса. Закон Гесса, следствие из закона Гесса. Стандартная энтальпия образования вещества
- •Катализ и катализаторы. Гомогенные и гетерогенные катализаторы. Влияние катализаторов на величину энергии активации и константу скорости реакции.
- •Растворы. Классификация дисперсных систем: истинные растворы, коллоидные растворы, грубодисперсные системы.
- •Растворимость веществ. Влияние природы растворяемого вещества и растворителя, температуры и давления на растворимость газов, твердых и жидких веществ.
- •Сильные и слабые электролиты. Степень диссоциации. Равновесие в растворах слабых электролитов. Константа диссоциации. Связь константы диссоциации со степенью диссоциации и концентраци
- •Реакции ионного обмена в растворах. Обратимые и необратимые реакции, признаки необратимости реакций
- •Труднорастворимые электролиты. Равновесие между осадком и насыщенным раствором. Произведение растворимости и растворимость веществ
- •Константа гидролиза. Степень гидролиза, связь степени гидролиза с константой гидролиза и концентрацией раствора. Факторы, определяющие глубину гидролиза солей. Совместный гидролиз.
- •Окислительно-восстановительные реакции (овр). Основные типы овр. Типичные окислители и восстановители. Составление уравнений овр методом электронного и ионно-электронного баланса.
- •Классификация и номенклатура комплексных соединений. Основные типы комплексных соединений.
- •2) По типу лигандов комплексные частицы делятся на:
- •Кислоты и основания. Влияние положения элемента в периодической системе и степени окисления элемента на состав и кислотно-основные свойства гидроксидов элементов
- •Классификация реакций органических соединений по характеру химических превращений
- •Конформация
- •Методы масс-спектрометрии
- •Инфракрасные (ик) спектры и комбинационное рассеяние света
- •Спектроскопия в видимой и ультрафиолетовой (уф) областях
- •Рентгеновские методы исследования
- •Метод ямр
- •Общая характеристика титриметрический (объемный) метод анализа
- •Кислотно-основное титрование (метод нейтрализации) Общая характеристика метода
- •Перманганатометрия
- •Комплексонометрия Общая характеристика метода
- •Условия проведения комплексонометрического титрования
- •Гравиметрический (весовой) метод анализа
- •Электрохимические методы анализа
- •Фотометрический метод анализа Основные законы и формулы
Атомно-молекулярная теория. Атом, молекула. Химический элемент. Простое и сложное вещество. Аллотропия. Основные современные положения атомно-молекулярной теории:
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при химических - разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Атомами называются мельчайшие, химически неделимые частицы, из которых состоят молекулы. Атом - это наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами.
При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ.
Молекула - это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, различное у разных веществ. Молекулы любого вещества находятся в непрерывном движении.
Химический элемент - это общее понятие об атомах с одинаковым зарядом ядра и химическими свойствами. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя.
Простые вещества - это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
Аллотропия - свойство некоторых химических элементов, позволяющее им существовать в двух или более различных физических формах. Каждая форма (называемая аллотропом) может иметь различные химические свойства, но способна превратиться и в другой аллотроп, если будут созданы соответствующие условия. Примеры: молекулярный кислород и озон, белый и желтый фосфор, графит и алмаз (уголь).
Относительная атомная и молекулярная масса. Моль как единица количества вещества. Химический эквивалент. Относительной атомной массой химического элемента называется величина, показывающая во сколько раз масса данного атома больше 1/12 массы атома углерода. Она обозначается буквой Аr.
Относительной молекулярной массой вещества называется величина, показывающая во сколько раз масса молекулы больше 1/12 массы атома углерода. Она обозначается Мr
Моль — это количество вещества, масса которого, выраженная в граммах, численно равняется его молекулярной массе.
M = m/n
Вещества реагируют между собой в эквивалентных количествах.
Эквивалент - это реальная или условная частица вещества, которая эквивалентна: а) одному иону Н+ или ОН- в данной кислотно-основной реакции; б) одному электрону в данной ОВР (окислительно-восстановительной реакции); в) одной единице заряда в данной реакции обмена, г) количеству монодентатных лигандов, участвующих в реакции образования комплекса. Молярной массой эквивалента (Mэкв.) вещества называется выраженная в граммах масса одного моля эквивалента этого вещества, т.е. это масса количества вещества эквивалентов равного числу Авогадро (6,02 . 1023).
Молярный объем эквивалента газа – объем одного моля эквивалентов газа при нормальных условиях (н.у.)
Химическое количество эквивалентов вещества – количество молярных масс эквивалентов вещества (nэкв.) равно массе вещества (m) деленной на молярную массу эквивалентов этого вещества (Mэкв) или объему газа (V) деленному на молярный объем эквивалентов газа (Vэкв.): nэкв. = m/Mэкв. = V/Vэкв. (моль.экв.).
Фактор эквивалентности fэкв. — это число, которое обозначает, какая доля реальной частицы эквивалентна одному иону Н+ в данной кислотно-основной реакции, одному электрону в данной ОВР или одной единице заряда в данной реакции обмена. Фактор эквивалентности – это число, на которое необходимо умножить молярную массу вещества, чтобы получить молярную массу эквивалента этого вещества: Мэкв. = М . fэкв.
Число
эквивалентности
– величина обратная фактору
эквивалентности: z
= 1/fэкв.
На практике число эквивалентности –
это число на которое необходимо разделить
молярную массу вещества чтобы получить
его молярную массу эквивалента: Мэкв.
=
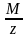 (г/моль.экв.) или число на которое
необходимо разделить молярный объем
газа чтобы получить молярный объем
эквивалентов газа: Vэкв.
= VM/Z
(л/моль.экв.) или при нормальных условиях:
Vэкв.=
22,4/Z
(г/моль.экв.) или число на которое
необходимо разделить молярный объем
газа чтобы получить молярный объем
эквивалентов газа: Vэкв.
= VM/Z
(л/моль.экв.) или при нормальных условиях:
Vэкв.=
22,4/Z
Основные типы структур неорганических соединений. Вещества с молекулярной и немолекулярной структурой. Атомные, молекулярные, ионные и металлические кристаллические решетки .
Неорганические вещества классифицируются по составу и по химическим свойствам. По составу неорганические вещества делятся на бинарные – состоящие только из двух элементов, и многоэлементные – состоящие из нескольких элементов.
Оксидами называются бинарные соединения, содержащие кислород в степени окисления -2 . По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие . Солеобразующие, в свою очередь, делятся на основные , кислотные и амфотерные .
Соли можно рассматривать как продукт взаимодействия основания и кислоты. При этом может происходить как полное, так и неполное замещение ионов водорода в кислоте катионами металла (или аммония) или гидроксильных групп в основании кислотными остатками.
Гидроксидами металлов называются вещества, содержащие ион металла и одну или несколько гидроксильных групп.
Гидроксиды делятся на основные (основания) и амфотерные. Основные гидроксиды, в свою очередь, делятся на сильные основания – щелочи, и слабые основания.
С молекулярной: большинство простых веществ неметаллов: O2, S8, P4, H2, N2, Cl2; соединения неметаллов друг с другом (бинарные и многоэлементные): NH3, CO2, H2SO4.
С немолекулярной: простые вещества металлы и их сплавы: Na, Cu, Fe, ...; соединения металлов с неметаллами: NaH, Na2SO4, CuCl2, Fe2O3; неметаллы: бор, кремний, углерод (алмаз), фосфор (чёрный)
Атомная: В узлах атомной кристаллической решетки находятся атомы, связанные прочными ковалентными связями в протяженную пространственную сеть. В этом случае структура отличается таким внутренним единством, что можно сказать, что весь кристалл представляет одну молекулу.
Молекулярная: У веществ с молекулярным строением в узлах кристаллической решетки находятся молекулы с прочными ковалентными связями между атомами. В то же время отдельные молекулы взаимосвязаны гораздо слабее, что делает молекулярный кристалл довольно непрочным.
Ионная: У веществ с ионной решеткой в узлах расположены разноименно заряженные ионы, удерживаемые силами электростатического притяжения.
Металлическая: Этим типом кристаллической решетки обладают металлы с металлической химической связью.
Химические газовые законы .Закон Авогадро .Молярный объем.
1. Закон Авогадро. В одинаковом объеме любого газа при одинаковой температуре и давлении содержится одинаковое количество молекул, т.е. m/M=const при P,V,T=const для любого газа.
2. Закон Бойля-Мариотта. При постоянной массе газа и постоянной температуре давление газа обратно пропорционально занимаемому им объему, т.е. Р•V= const при Т, m=const
3. Закон Гей-Люссака. При постоянных массе газа и давлении объем, занимаемый газом, прямо пропорционален его температуре, то есть v — = const при P, m=const
4. Закон Шарля. При постоянных массе газа и его объеме давление газа прямо пропорционально температуре, то есть
P/T=const при V, m=const ;NA=6,022...×1023
МОЛЯРНЫЙ ОБЪЕМ , объем, занимаемый одним МОЛЕМ вещества. Он примерно одинаков для всех газов и при СТАНДАРТНОМ ДАВЛЕНИИ и ТЕМПЕРАТУРЕ составляет 22,414 литра.
Основные стехиометрические законы. Закон эквивалентов. Закон постоянства состава Нестехиометрические соединения.
Зак.ЭКВИВАЛЕНТОВ Во всех химических реакциях взаимодействие различных веществ друг с другом происходит в соответствии с их эквивалентами, независимо от того, являются ли эти вещества простыми или сложными.
Зак.Пост.Состава: Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав. Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Нестехиометрические соединения, химически индивидуальные вещества переменного состава. Относятся полевые шпаты, цеолиты, шпинели и др. Н. с. обозначают тильдой перед стехиометрической формулой или чертой над ф-лой. Многочисленные случаи образования бертоллидов открыты в металлических системах, а также среди оксидов, сульфидов, карбидов, гидридов и др.
