
- •1.Предмет физики. Методы физ. Исследования . Механика .Три раздела механики.
- •Закон изменения момента импульса.
- •20.Консервативные и неконсервативные силы.
- •26.Закон сохранения импульса. Абсолютно неупругий удар.
- •27.Абсолютно упругий удар
- •28.Закон сохранения момента импульса. Законы сохранения в механике
- •36.Вязкость . Ламинарное и турбулентное движение жидкости.
- •37.Формула Пуазейля.
- •38.Молекулярная физика. Статические и термодинамические методы методы исследования .Термодинамические параметры.
- •39.Уравнение состояния идеального газа. Закон Дальтона.
- •40.Молекулярно-кинетическая теория газов (мкт) .Уравнение мкт идеального газа.
- •41.Закон равномерного распределения энергии по степеням свободы.
- •42.Внутренняя энергия системы.
- •43.Первое начало термодинамики.
- •44. Работа газа при изменение его объема.
- •45. Классическая теория теплоемкости газа.
- •52.Круговой процесс. Цикл Карно. Прямой и обратный цикл Карно.
39.Уравнение состояния идеального газа. Закон Дальтона.
![]() для
одного моля газа.
для
одного моля газа.
Используя зависимость давления идеального газа от его температуры и концентрации молекул p = nkT ,
можно
найти связь между основными макроскопическими
параметрами газа — объемом V,
его давлением p и
температурой T.
Концентрация n молекул
газа равна
![]() ,
(26.1)
,
(26.1)
где N —
число молекул газа в сосуде объемом V.
Число N можно
выразить как произведение количества
вещества ![]() на
постоянную Авогадро NA:
на
постоянную Авогадро NA:
![]() .
(26.2)
.
(26.2)
Из
выражений (25.9), (26.1) и (26.2) получаем
![]() .
(26.3)
.
(26.3)
Произведение
постоянной Авогадро NA на
постоянную Больцмана k называется молярной
газовой постоянной R.
Молярная газовая постоянная равна
![]() .
(26.4)
.
(26.4)
Используя
молярную газовую постоянную, выражение
(26.3) преобразуем в уравнение![]() .
(26.5)
.
(26.5)
Количество
вещества
можно
найти, зная массу вещества m и
его молярную массу M:![]() ,
(26.6)
,
(26.6)
поэтому
уравнение (26.5) можно записать в такой
форме:![]() .
(26.7)
.
(26.7)
Законы Дальтона — два физических закона, определяющих суммарное давление и растворимость смеси газов. Сформулированы Джоном Дальтоном в начале XIX века.
![]()
![]()
40.Молекулярно-кинетическая теория газов (мкт) .Уравнение мкт идеального газа.
Задача молекулярно–кинетической теории – вывести все свойства вещества из его молекулярно-кинетической модели. Модель эта содержит представления о свойствах молекул вещества, их движении и взаимодействии. Представления, естественно, уточняются с развитием науки, поэтому уточняется и модель.
Основные положения этой модели следующие:
газ состоит из молекул (мельчайших частиц, размеры которых ˜ 10-10м.)
молекулы газа находятся в непрерывном хаотическом движении.
молекулы сталкиваются друг с другом. Столкновения бывают упругими (низкие температуры) и неупругими (высокие температуры)
в промежутке между соударениями молекулы движутся прямолинейно
молекулы на малых расстояниях отталкиваются, а на больших притягиваются друг к другу.
Следует заметить, что внутренняя структура самой молекулы описывается квантовой физикой. Включение в описание явлений внутреннего строения молекул, является дальнейшим уточнением модели.
которое
выглядит так: ![]() ,
где р — давление идеального газа, m0 —
масса молекулы,
,
где р — давление идеального газа, m0 —
масса молекулы, ![]() среднее
значение
среднее
значение
МКТ
идеального газа в виде: ![]()
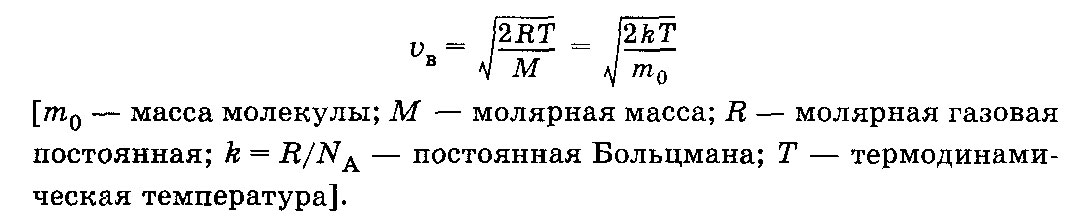
кв.
скорость=корень из(3RT/M)
![]()
41.Закон равномерного распределения энергии по степеням свободы.
Согласно
молекулярно-кинетической теории газов
движение молекул носит беспорядочный
характер; эта беспорядочность относится
ко всем видам движения молекулы. Ни один
из видов движения не имеет преимущества
перед другим. При статистическом
равновесии движений энергия в среднем
распределяется равномерно между всеми
видами движения. Закон равномерного
распределения энергии по степеням
свободы молекул можно сформулировать
следующим образом: статистически в
среднем на каждую степень свободы
молекул приходится одинаковая энергия.
Поступательное движение молекул
характеризуется средней кинетической
энергией, равной ![]() .
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
.
Так как поступательному движению
соответствует 3 степени свободы, то в
среднем на одну степень свободы движения
молекул приходится энергия
![]() В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
В
однородном газе, молекулы которого
имеют любое число степеней свободы i,
каждая молекула в среднем обладает
энергией движения, равной
|
