
- •1) Создание нового метода анализа
- •2) Совершенствование методов, расширении сферы методов.
- •3) Ах конкретных объектов-использует методы ах для решения конкретных задач (производство, медицина).
- •3. На чем основано разделение катионов по аммиачно-фосфатной и кислотно-щелочной схемам анализа. Предложите наиболее рациональную схему анализа смеси катионов Al Zn Mn Mg Cu Cd.
- •4. Химическое равновесие в гомогенных растворах. Константы равновесия. Факторы, влияющие на химическое равновесие.
- •5. Взаимодействие между растворенным веществом и растворителем. Ионная сила раствора; активность и коэффициент активности; их взаимосвязь.
- •7. Современные представления о кислотах и основаниях. Кислотно-основные сопряжённые пары. Равновесие в системе кислота- сопряжённое основание. Константы кислотности и основности.
- •Примеры:
- •8. Влияние природы растворителя на силу кислот и оснований. Сильные и слабые протолиты. Нивелирующий и дифференцирующий эффект растворителя.
- •Протонные (протолитические) растворители:
- •1.Кислотные(протогенные) 2.Основные(протофильные) 3.Амфипротные(амфотерные)
- •9. Амфолиты. Реакция автопротолиза. Константа автопротолиза. Водородный показатель.
- •16. Механизм реакции комплексообразования. Равновесие в р-рах комплексных соединений, константа равновесия. Факторы влияющие на устойчивость комплексов.
- •1. Строение и свойства цик.
- •2. Катионы с недостр. D-оболочкой(V,Cr,Mn,Co.Pt-мет.,Ni,Cu и др.)Для кс,образованных этими эл-ми хар-но преобладание доли ков. Связи Me-l.
- •3. Влияние pH
- •17. Окислительно восстановительные реакции. Стандартные потенциалы. Реальные потенциалы. Направление реакции окисления-восстановления.
- •1.) Разделения 3)в колич. Анал.(титрование)
- •2) Определения
- •18 Факторы влияющие на величину равновесного электродного потенциала
- •2)Влияние комплексообразования
- •3)Влияние ионной силы
- •19 Особенности анализа анионов. Классификация анионов. Предложите анализ смеси анионов so42- , po43- , SiO32- .Приведите ур-е р-й.
- •3)Обнаружение po43-
- •4)Осадочная- в основе принцип последовательного осаждения малораств-х соед-й.
По
характеру участия протонно
донорно-акцепторного взаимодействия
в зависимости от химической природы
растворителя делятся : протолитические(протонные)
и непротолитические(апротонные). Молекулы
апротонных растворителей не способны
к отщеплению( присоединению) p+,
они неионизированы , поэтому растворённые
в апротонных растворах(растворителях)
не способны к диссоциации. Это происходит,
т.к. апротонные растворители индивидуальными
веществами характеризующимися по
сравнению с водой низкой диэл.
проницаемостью. В
апротонных растворителях растворяются
кислоты и основания, но кислотно-основное
взаимодействие в их среде протекает с
образованием – ассоциатов. При низких
значениях диэл.проницаемости образование
ионных диссоциатов ведёт к уменьшению
силы кислот.
Важным
фактором является то, что сильные в
воде кислоты в апротонных растворителях
становятся слабыми. К числу апротонных
растворителей относятся бензол, CCl4,
хлороформ, хлорбензол, циклогексан,
н-гексан, CS. Индивидуальные
химические соединения, проявляющие
явно выраженные кислотные свойства;
т.е. отщеплять р+.
По сравнению с водой,NH2
,NH3,
спирты и др, они имеют меньшее сродство
к р+. Их
молекулы склонны к взаимодействию с
основаниями, оказывают существенное
влияние на их силу(диссоц. основание
увеличивается, сила кислот изменяется
незначительно).
К
протонным растворителям относятся
безводная укс.,серная к-ты. При смешение
раствороителей серная ведёт себя как
протогенный растворитель, уксусная
будет является основанием. протогенные
растворители следуем рассматривать
как группу имеющую более выраженные
кислотные свойства, чем другие
растворители по отношению к ней(
безводные серн. и укс.) CH3COOH
относится к H2SO4
как основание.
К таким
протонным растворителям относятся
жидкий HCl,
HBr,
HJ,
безвод. CH3COOH
и H2SO4,
HCOOH,
CH2ClCOOH
,CHCl2COOH,
CCl3COOH
,CJ3COOH,
гликоли, глизоли. Взаимодействие
кислоты с протогенным растворителем
можно рассматривать: A+
SH
↔ ASH(сольват)
↔ AH+*S-(
ионные пары)↔ AH+
+
S- CH3COOH+
H2SO4↔
CH3COOH*
H2SO4↔
CH3C(OH)2+*
HSO4-↔
CH3C(OH)2+
+
HSO4- B+SH↔
BSH↔ BH+*S-↔
BH+
+
S- (CH3)N
+CH3COOH↔(CH3)N
*CH3COOH↔(CH3)NH+
*CH3COO-
↔(CH3)NH+
+ CH3COO-
Протогенный
растворитель отличается повышенной
протонно-донорной
характер
по сравнению с водой. Его молекулы
проявляют основынй характер, у которых
протонно-донорной характер проявляется
сильней. Понятие протогенный относится
к растворителям только в отношении
определённого партнёра, принимающего
участие в процессе кислотно-основного
взаимодействия.
Основные(протофилные)
растоврители- индивидуальные орг. или
неорг. вещества, проявляющие ярко-выраженный
основный характер, т.е. способность
присоединять p+.
Они по сравнению с водой, спиртом,
CH3COOH(безводн)
и др. имеют более высокое протонное
сродство. Склонны к реакциям взаимодействия
с кислотами, диссоциация кислот
усиливается. Поведение основных
растоврителей по сравнению к растворённым
кислотам и основаниям аналогично
протогенным растворителям, но различны
по свойствам. К
протофильным относятся: ацетамид
CH3CONH2,
формамид HCONH2,
метилформамид CH3HCONH2,этилендиамин
(CH2)2NH2,
триэтиламид (C2H5)3N,
жидкий NH3,
(C2H5)2NH CH3CONH2
+
NH3(жидк)
↔ CH3CONH2
NH3↔
CH3CONH-
+
NH4+ Молекулы
основного растоврителя могут проявлять
кислотные свойства с партнером,
проявляющим более сильные протонные
свойства. Протофильный
или основный растовритель обладает
более сильным сродством к p+,
по сравнению с
партнёром.
Его молекулы проявляют
кислотный
характер по сравнению(не закончено)
Нивелирующий
и дифференцирующий эффекты р-лей. Растворители,
в которых сила кислот(оснований)
уравнивается наз-ся Нивелирующими. Эти
р-ли в среде которых не проявляется
значительное различие в силе протолитов
и в среде которых протолиты различной
природы не изменяют соотношений в своей
силе, характерные для водных растворов. В
воде сила не уравнялась, т.к. они перешли
в H3O+.
Вода обладает Нивелирующим фактором
. Чем сильнее основные св-ва у р-ля, тем
больше кислот выравнивается в нём по
силе. Протогенный
р-ль(безвод. CH3COOH)
будет невелирующим по отношению к
сильным основаниям. Амины
являются сильными основаниями в воде.
Самой сильной к-ой является ион лиония,
а основанием – ион лиата. Дифференцирующее
действие на силы кислот. Р-ли в среде
которых проявляются значительные
различия в силе кислот(оснований). Дифф.
действие р-ля в отношении кислот ↑ с ↑
протогенного
характера р-ля. Чем более протогенный
р-ль, тем меньше число к-от проявляет
кислотные св-ва в его среде, происходит
невелирование силы оснований. Р-ль с
хар. выраж. осн. св-ми явл. диф-м в отн.
оснований. Диф.
р-лем явл. диполярные апротоныые р-ли
для к-ых характерны спец.
взаимодействия(межмолек, ион-дипольн.,дон-акц)
– метилэтилкетон, диметилкетон.
Амфипротные
расторители(амфотерные)- индивидидуальные
вещества, молекулы которых в одинаковой
степени склонны к отщеплению(
присоеденинию) p+(вода,
эт. мет. спирт). В результате происходит
реакция автопротолиза: 1)CH3OH
+CH3OH
↔ CH3OH2+
+CH3O- 2)
A+
SH
↔ SH2++B В
амфипротонных растворителях диссоциируют
кислоты и основания. При растворении
в амфипротонных растворителях кислоты
и основания вступают в протолитическое
взаимодействие растворителей, в этом
8. Влияние природы растворителя на силу кислот и оснований. Сильные и слабые протолиты. Нивелирующий и дифференцирующий эффект растворителя.
Протонные (протолитические) растворители:
1.Кислотные(протогенные) 2.Основные(протофильные) 3.Амфипротные(амфотерные)
9. Амфолиты. Реакция автопротолиза. Константа автопротолиза. Водородный показатель.
случае
есть две возможности для переноса
p+-1.между
молекулами растворителя;2.между
кислотой(основанием) и растворителем 3)
B+
SH
↔ A+S- Если
энергия, нужная для 2) меньше чем для
1), то молекула кислоты поведёт себя как
кислота→изменится конц. лиония(увел)→
увеличится кислотность раствора.
Если
энергия, нужная для 1) меньше чем для
2), то конц. ионов лиония не изменится,
растворённый протолит не изменит
кислотных свойств. При растворении
кислот и оснований в амфипротных
растворителях, изменится Ph
растворов, концентрации кислот и
оснований , отличающихся от нейтральных.
К.
протолитической пары АВ в растворителе
SH А
+SH↔
B
+SH2+
Kaкис-ты
протолитической пары в растворителе
SH А
+SH↔
B+H3O+
KaAB
в SH Kaкис-ты
связана
с Kaосновв
растворителе. KaAB
в SH=
(B)
(SH2+)/
А=(B)
(H+)
*
SH2+/A
(H+)=
KaAB(кис-ты)
Kв
в SH(осн) Чем
более основный характер носит
растворитель, тем более кислотные
свойства проявляет растворённый в
растворителе протолит и наоборот. B
+SH↔
A
+S-
KBAB
в SH=
KBAB
в SH*
Ka
SH
сила основания будет зависеть от природы
растворителя. Между
конст. кислоты и основания существует
связь с конст. автопротолиза. K
SH=
KBAB
в
SH
*KaAB
в
SH=(SH2+)(B)/(A)
* (A)(S-)/(B)
= (SH2+)(S-) KH2O=
(H3O+)(OH-) pKa
+pKb=pK
SH для
водных растворов Kaкис-ты
совпадает с Кдисс.
Чем
сильнее кислота, тем слабее сопряжённое
с ней основание. Если для оценки
используется pKa,
то можно сказать, что с ↑pK
сила кислоты↓, а сила оснований↑. В
качестве стандартной кислоты и основания
используют растворитель. Сильная
к-та , т.е. pKa<0,
Ka>1 Сильное
основание, т.е. pKb<0,
Kb>1
; pKa
>pK
SH(раств-ля),
если выражаем через сопряжённую кислоту При
растворении сильных кислот, к-та
превращается в ион лиония. В амфипротном
р-ле самая сильная кислота ионы лиония
или ионы гидроксония в водном растворе.
Самое сильное основание переходит в
ионы лиата, для водных растворов- OH-.
Слабые к-от и осн. частично переходят
в ион лиония и лиата.
0<
pKa<
pK
SH Самая
сильная кислота в водном р-ре -
H3O+(протонированный
р-ль) Водородный
показатель pH=-lg[H+] для
NH4Cl
[H+]=√(Kw*Cсоли/Kосн.) для
CH3COONa
[H+]=√(Kw*
Kк-ты/
Cсоли.)
для
CH3COONH4
[H+]=√(Kw*
Kк-ты/
Kосн.)
10.С
позиции протолитической теории обьясните
гидролиз реактива (NH4)2S.
Взаимодействие его с солями Al3+;
использование гидролиза для отделения
Al3+
от других катионов по ходу анализа. (NH4)2S
→ 2NH4+
+ S2- H2O
↔H+ + OH- NH4+
+ OH-
↔ NH4OH S2-
+ H+
↔ HS- HS-
+ H+
↔ H2S (NH4)2S
+ 2H2O
↔2NH4OH
+ H2S
pH=7, среда
нейтральная. Из
водного раствора сульфид аммония
осаждает катионы Al3+
в виде гидроксида за счет происходящей
реакции гидролиза: 2Al3+
+
3S2–
+
6H2O↔2Al(OH)3+
3H2S Сульфид
аммония осаждает Al3+
и
их сульфиды, гидролизуясь переходят в
нерастворимый гидроксид.
11.
Буферные растворы, их свойства и
применение. Буферная емкость. Факторы
влияющие на величину буферной емкости.
расчёт pH
буферных растворов.
Многие
реакции в растворе протекают в желаемом
направлении только при определённых
условиях, а изменение их часто приводит
к перемене направления реакции и к
появлению новых продуктов взаимодействия.
Заланные условия могут поддерживаться
благодаря буферным системам. В самом
широком смысле буферными называют
системы, поддерживающие определённое
значение какого-либо параметра при
изменении состава. Буферные растворы
могут быть:
-кислотно-осноdными(pH)
-окислительно-восстановительными(поддерж.потенциал)
-металлобуферные
и др.
Буферный
раствор предсталяет собой сопряжённую
пару; в частности, кислотно-основные-сопряжённую
кислотно-основную пару. Пример: ацетатный
– CH3COOH
и CH3COONa,
фосфатный – из NaH2PO4
и NaHPO4,
аммиачный – NH4OH
и NH4Cl,
бензоатный – C6H5COOH
и C6H5COONa/
Способность
буферных смесей поддерживать практически
постоянный pH
основана на том, что отдельные компоненты
их связывют ионы лиония или лиата кислот
или основания. Также, значение pH
остаётся неизменным и при разбавлении,
поскольку соотношение концентрации
компонентов буфера постоянно. И лишь
при очень больших разбавлениях (>10-4)
автопротолиз может вызвать изменение
pH
в пределах 0,5-1.
В
буферном растворе, содержащем сопряжённую
пару, устанавливается равновесие:
HA+H2O↔
H3O++A- оба
равновесия сильно сд-
A-+H2O↔
HA
+OH- винуты
влево, т.к в растворе находятся достаточные
концентрации как HA.
так и A-.
Тогда константа равновесия будет
опрделятся константой кислотности:
будем
считать, что [HA]≈CHA
и [A]
≈ CA-
,поэтому
При
этом мы не учитываем H+,
полученные при автопротолизе воды,
считая его подавленным в присутствии
HA
и A-.
Всякая
буферная смесь практически сохраняет
постояноство значения pH
лишь до прибавления некоторого
определённого количества кислоты или
щелочи, т.е. обладает определённым
параметром, называемым буфёрной емкостью
– это то предельное количество кислоты
или основания опред. конц., которе можно
добавлять к буферному раствору, чтобы
его значение pH
изменилось не более чем на 1.
т.е
зная значение буферной емкости можно
найти изменение pH
при добавлении кислоты иил основания,
а также определить состав буферной
смеси и решить др. вопросы.
В
случае растоворов сильных кислот и
оснований, сопряжёнными будут являтся
H30+
/ H20(для
кислот) и OH-‑/
H20(для
осн.) И буферная емкость будет вычислятся
как: П=2,3[H+]
(кислота) П=2,3[OH-]
(основ.)
Таким
образом, можно сделать вывод о буферной
емкости:
- БЁ
тем выше, чем выше концентрация
компонентов буферной смеси;
-БЁ
зависит от pH;
-по
мере добавления к буферному раствору
кислоты или основания устойчивость
раствора к изменению pH
постепенно снижается
-чтобы
действие буфера было достаточноэффективно,
т.е. чтобы буферная ёмкость изменялась
не очень сильно, концентрация одного
ихз компонентов не должна превышать
концентрацию другого больше, чем в 10
раз, т.к. это вызовет ΔpH
на 1.
-максимальное
значение буферной емкости наблюдается
в растворах, содержащих равные
концентрации компонентов.
Постоянство
значения pH
буферных растворов имеет важное значение
для анал. химии, а также играет большую
роль в жизнедеятельности живых
организмов: кислотность крови и
растительных соков поддерживается
постоянной из-за буферного действия
содержащихся в них частей
12.
Равновесие в системе раствор-твердая
фаза. Конст. растворимости. Условия
смещения равновесия. На примере
взаимодействия катиона бария с
дихроматом калия покажите условия
смещения равновесия в нужном направлении.
Условия выпадения осадка.
Упрощенную
схему равновесий между осадком AmBn
и его насыщенным р-ром можно представить
в виде
т.к.
активность твердого соединения
постоянна, принимаем ее =1, тогда
термодинамическая конст. равн. принимает
вид
В
реальных системах, вместо активности
удобно использовать концентрации.
Соотв. вместо

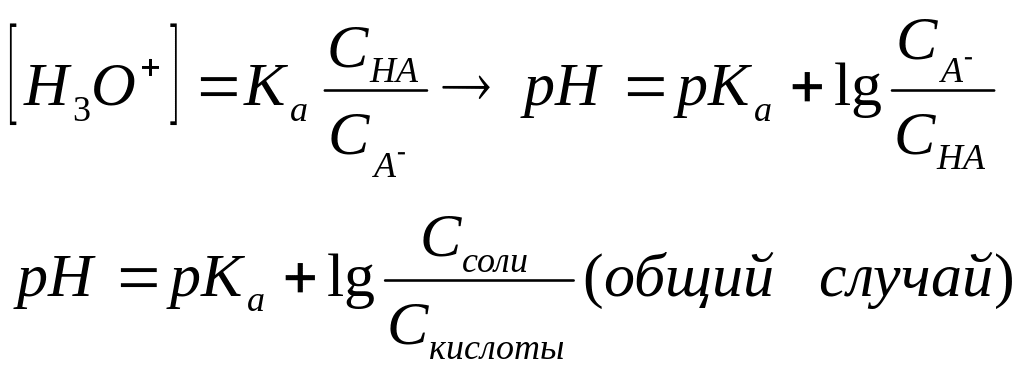
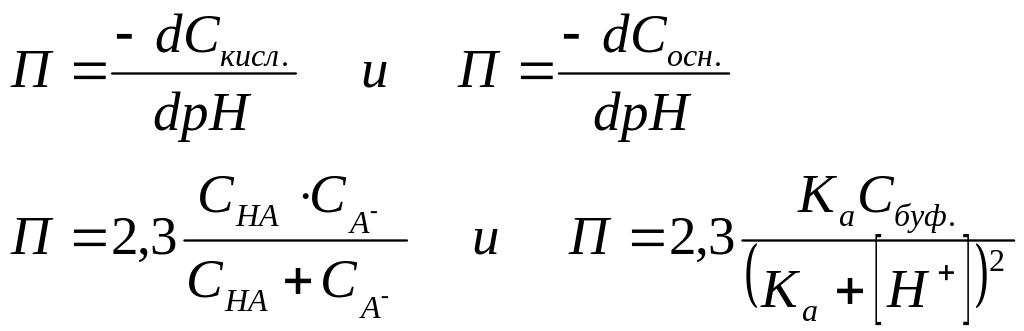
![]() ,
где 1 преобладает для в-в с ионной крист.
решеткой, 2 – с молекулярной. Количественно
равновесие может быть охаракт. конст.
равновесия К=
,
где 1 преобладает для в-в с ионной крист.
решеткой, 2 – с молекулярной. Количественно
равновесие может быть охаракт. конст.
равновесия К=![]()
![]() .
От сюда следует правило произведения
растворимости: произведения активности
ионов в степенях, равных стехеометрическим
коэфф. в насыщенном р-ре малораств.
электр-ита есть величина постоянная
для данного растворителя, температ.,
давления.
.
От сюда следует правило произведения
растворимости: произведения активности
ионов в степенях, равных стехеометрическим
коэфф. в насыщенном р-ре малораств.
электр-ита есть величина постоянная
для данного растворителя, температ.,
давления.![]() исп.
концентрационные ПР- реальные(!)
исп.
концентрационные ПР- реальные(!)![]()
J≠0,
побочные р-ии отсутствуют.
KS
связана
с величиной J
выражением:
и
условное
Связь
между различными ПР можно выразить
формулой:
взаимодействие
бария с бихроматом калия:
В
рез-те этой реакции мы получаем оскадок
хромата бария желтого цвета. В р-ре
будут существовать равновесия:
1.
Повышение pH
раствора(увеличение конц. H)
При
этом будет наблюдаться сдвиг равновесия
в сторону образования бихромат-иона,
что будет способствовать уменьшению
иона осадителя CrO4,
а значит будет образовываться меньше
осадка BaCrO4.
2.
Избыток иона Cr2O7
приведет к образованию большого числа
иона осадителя CrO4,
а значит равновесие сместиться в сторону
образования осадка.
13.
Растворимость осадков. Факторы, влияющие
на растворимость.
Раств.
называется общая концентрация в-ва в
его насыщенном растворе. Молярная
раств.-конц. нейтр. молекул в р-ре. Ионная
раств.-конц. ионов в труднораств.
р-ре(катионов в насыщенном р-ре его
соли).
В
насыщенном р-ре раств. соедю AmBn
составляет S
моль/л и конц. ионов в этом р-ре будет
равна [A]=mS
[B]=nS,
тогда
B:
1) Если
J
можно считать =0, γ=1,
2) При
J≠0,
но в отсутствие конкурир. р-ий (α=1), то
используем KS.
3) При
J≠0
и конкур. р-иях , исп.
В
отсутствие одноименного иона для
расчета общей растворимости, необходимо
суммировать ионную растворимость и
молекулярную
Чтобы
рассчитать р-сть малораств. комплекса,
можно воспользоваться равновесием:
для
малораств. кислот
Факторы,
влияющие на р-сть:
1.
Увеличение конц. одноименного иона
понижает раств. (эффект одноименного
иона) Этот вывод можно сделать исходя
из формул вычисления растворимости.
Однако при очень большом избытке
одноименного иона может наблюдаться
повышение растворимости в рез-те:
-в
рез-те хим. взаимодействий образуются
раств. соед: комплексы. т.е. р-ии
комплексообразования повышают
растворимость осадков.
-вследствие
солевого эффекта, обусловленного
повышением ионной силы р-ра. Эффект
всегда наблюдается при увеличении
конц. электр-ита в р-ре молекулярного
соед.
2.Влияние
pH.
Взаимодействие сильной кислоты с
анионом слабой HA+X-↔HX+A-.
Если X-
анион малорастворимой соли, то в
результате такого взаимодействия
начнется растворение осадка,
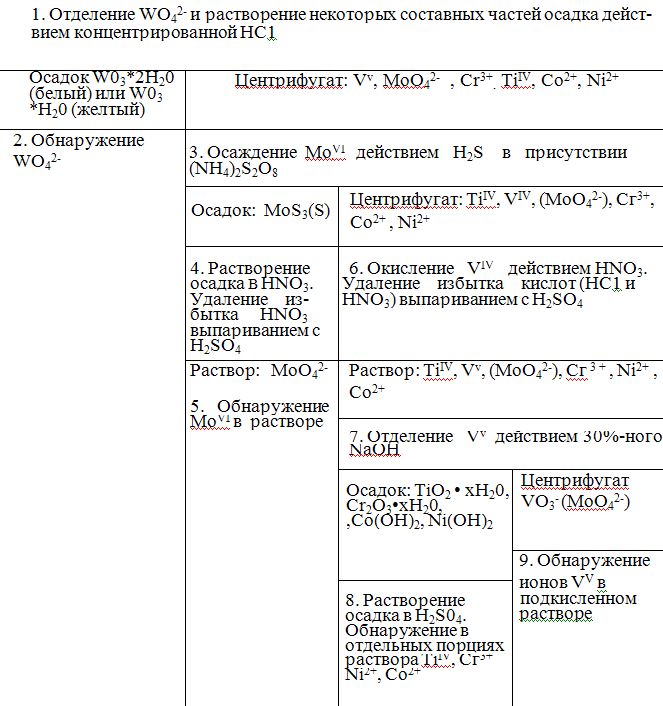
14.
Дробный анализ. Анализ смеси
Cr(3),Co(2)/Ni(2),Ti(4),VO3-,WO42-,,MoO2-4.Привести
уравнения реакций.
Метод
дробного обнаружения основан на
приминениии специфических и селективных
реагентов на группы. Мешающее влияние
сопутсвующих ионов устраняют, используя
приёмы маскирования, а также применяя
более селективные и спец. реагенты.
Возможности дробного открытия были
существенно расширены благодаря
приминению органических реагентов,
для повышения селективности реакций
обнаружения. Широкие возможности
орг.реагентов связаны с их многообразием,
и следовательно выбором подходящего
реагента, и с разнообразием свойств
образуемых ими комплексов.
В
частности на таком методе анализа
основано определение ионов
Cr(3),Co(2)/Ni(2),Ti(4),VO3-,MoO2-4
так называемых спец. элементов. Уникальные
свойства этих элементов создают
трудности при отнесении к одной из
аналитических групп, поэтому они
отнесены к разряду «спец.».Так например
тяжело определить принадлежности
VO3-,MoO2-4
,WO42-,которые
под действием (NH4)2S
не осаждаются ,однако образуют тиосоли.
2.ОбнаружениеWO42-
.К осадку прибавляют 1—2 капли
концентрированной НС1 и действуют
кусочком металлического цинка или 2—3
каплями раствора SnCl2
и оставляют на некоторое время.
Образование «вольфрамовой сини»
указывает на присутствие WO42-.
5.Обнаружение
МоО42-.
На полоску фильтровальной бумаги
наносят по одной капле кислого раствора
SnCl2,
исследуемого
раствора и раствора NH4SCN.
Появление красной окраски вследствие
образования [MoO(SCN)5]2-
указывает на присутствие МоО42-.
С другой каплей раствора можно проделать
реакцию на МоО42-
с ксантогенатом калия.
8.1Ион
TiIV.
К 3 каплям полученного раствора осторожно
по стенкам пробирки добавляют несколько
капель Н2О2,
так, чтобы Н2О2
по возможности не смешивалась с
исследуемым раствором. Появление на
границе соприкосновения растворов
желтого или оранжевого кольца
пероксисоединения титана указывает
на присутствие TiIV
Можно
также обнаружить TiIV
капельной реакцией с хромотроповой
кислотой.
8.2Ион
Сг3+.
Обнаруживают реакцией образования
Сг2O72-
действием КМnO4
в присутствии HNO3
с последующим превращением в
надхромовую кислоту и другими реакциями
с предварительным окислением СгIII
до CrVI.
8.3Ион
Ni2+.
Обнаруживают капельной реакцией с
диметилглиоксимом на подстилке Na2HP04.
8.4Ион
Со2+.
Прибавляют к 2 каплям раствора 8 капель
насыщенного раствора NH4SCN
(или твердой соли) добавляют несколько
капель амилового спирта (или смесь
амилового спирта с эфиром) и взбалтывают
(экстракция).
Синяя окраска спиртового слоя указывает
на присутствие Со2+.
9.
Ион VO3-.
К 6—8 каплям слабокислого раствора
осторожно прибавляют по стенке
несколько капель Н2O2
так, чтобы слои растворов по возможности
не смешивались. Образование
красновато-бурого кольца пероксосоединений
Vv
указывает на присутствие VO3-.
Можно, смешав каплю раствора с каплей
6 н. раствора HNO3,
обнаружить в полученной смеси VO3-
капельной реакцией с анилином.
15.
Комплексные соединения. Определение
понятий. Типы комплексных соединений,
используемых в качественном и
количественном анализе. На примере
анализа катионов 5 и 3 группы покажите
использование КС с неорганическими и
органическими лигандами для их разделения
и определения.
Свойтсва
КС(устойчивость, окраска, р-сть , летучесть
и др.) широко используются для получения
информации о качествонном и количественном
составе пробе, лежат в основе многих
хим. рекций методов анализа. В самом
широком смысле под КС понимают сложную
частицу, состоящую из компонентов,
способных к автономному существованию.
КС присущи признаки, позволяющие
выделить их в особый класс
соединений:-способность частиц к
автономному сущ-ию,-особый сложный
состав, -наличие устойчивой пространственной
геометрии. КС –относительно устойчивые
как в растворах, так и в кристаллах
сложные соединения в образовании
которых участвует дон-акц. связь
Типичный
ЦИК – переходные Ме: Ti,V,Mn,Fe,Co,Ni,Mo…с
d-незав.
орбиталью.
Атомы
лигандов посредством котрых осуществляется
связь с ЦИК-донорные(O,N,S,P,Se,As
и др.) Важной хар-ой КС является КЧ,
показывающее число атомов
илиилиилиилиатомных группировок
или
атомных группировок, связанных с ЦИК
непосредственно. Различают
характеристическое КЧ (число связей,
образуемых лигандами опред. типа) и
максимальное КЧ – максимально возможное
число связей, х-ых для данного типа ЦИК,
не зависящее от природы лиганда.
Дентантность – число донорных атомов
лиганда, образующих координационные
связи с ЦИК. Моно – вода, Hal,
CN-
b др.
Бидентантные:
КС с
полидентантными лигандами, образующие
циклы с ЦИК – хелаты.
Внутрикоплексное
соединение –это хелат, в к-м замыкание
цикла сопровождается вытеснением
одного или нескольких H+
из кисл.функц. групп металлом
Типы
КС:
-поли-
и многоядерные(число ЦИК); поли-: гомо-
и гетерополиядерные
-внутри
и внешнесферные; внутри: однородно- и
смешаннолигандные, хелаты
-лабильные
и инертные (скор.образ)
-заряженные
и незаряженные внутрисф.
Реакции
с участием КС.
3
группа:
Al3+
+ ализарин→ализариновый лак(красный);
Zn2++дитизон+CCl4→
малино-красное
Zn+(NH4)2[Hg(SCN)4]
→ Zn[Hg(SCN)4]+
NH4Cl
Na3AsO4+(NH4)2MoO4+HNO3→+(NH4)3H4[As(Mo2O7]↓+NaNO3
+ NH4NO3+вода
[Fe(CN)6]4-+Sn2+
+Fe3+→
Sn4++Fe4[Fe(CN)6]3
синий
1
группа:
Cd(NO)3+KCN→
Cd(CN)2↓
Cd(CN)2+KCN→K2[Cd
(CN)4]
б/у
Cu(NO3)2+NH4OH→Cu2(OH)2(NO3)2↓
+NH4OH
Cu2(OH)2(NO3)2+NH4OH+
NH4
NO3→
[Cu (NH3)4]
(NO3)2+
вода
Cu(NO3)2+CH2OH-
CHOH- CH2OH+NaOH→
→
HgJ2+KJ→K2
[HgJ4]
NiCl2+C4H8N2O2(чугаева)
→алокрасный
CoCl2+NH4OH→
[Co(NH3)6]Cl2желт.
CoCl2+NH4SCN→(NH4)
2
[Co(SCN)6]
роз.
CoCl2+(NH4)2[Hg(SCN)4]
→Co [Hg(SCN)4]
↓синий+
NH4Cl![]()
![]() (протекает
побочная р-ия)
(протекает
побочная р-ия)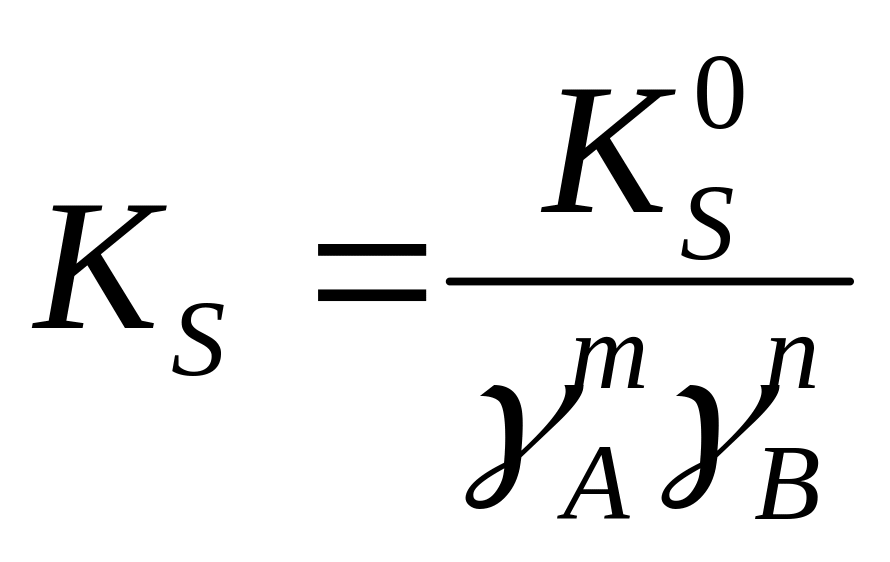
![]()
![]()
![]() ,
откуда
,
откуда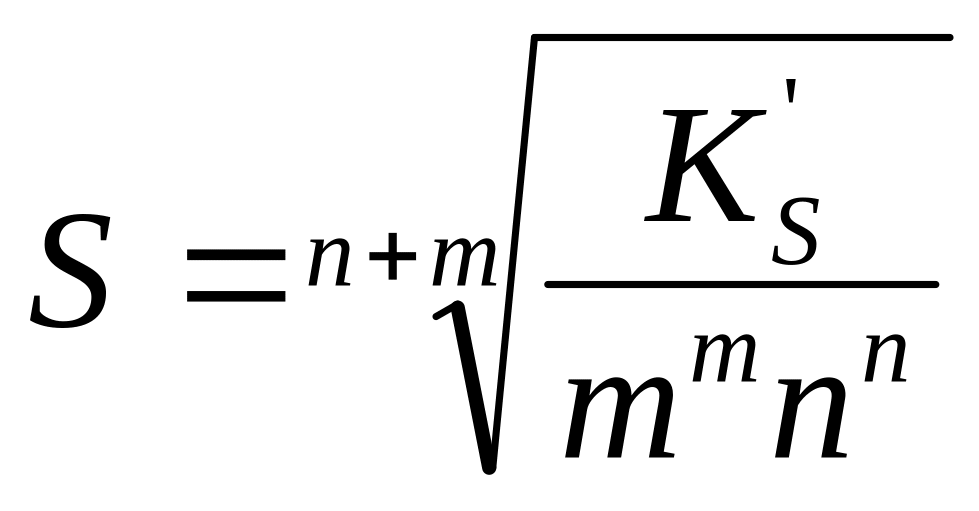 .
В присутствии избытка одноименного
иона:
A
: nS=CB
и
.
В присутствии избытка одноименного
иона:
A
: nS=CB
и
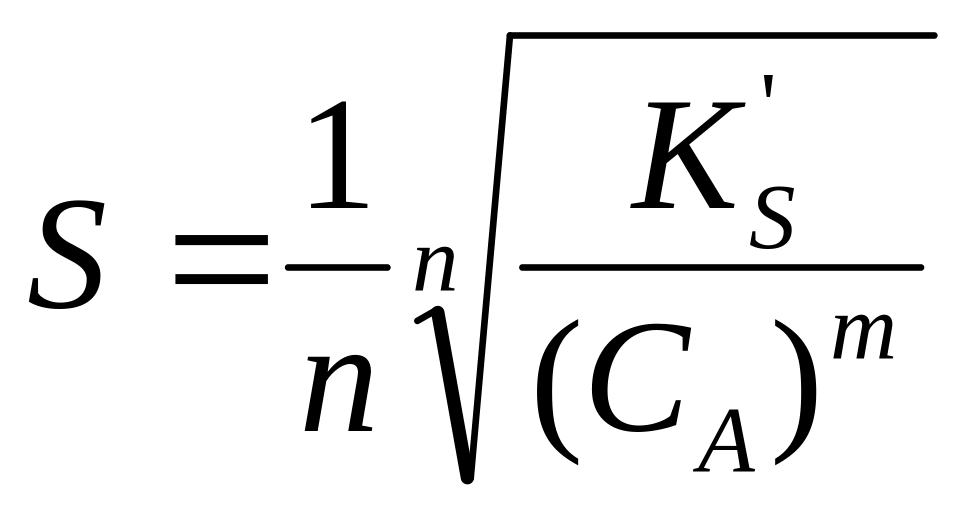
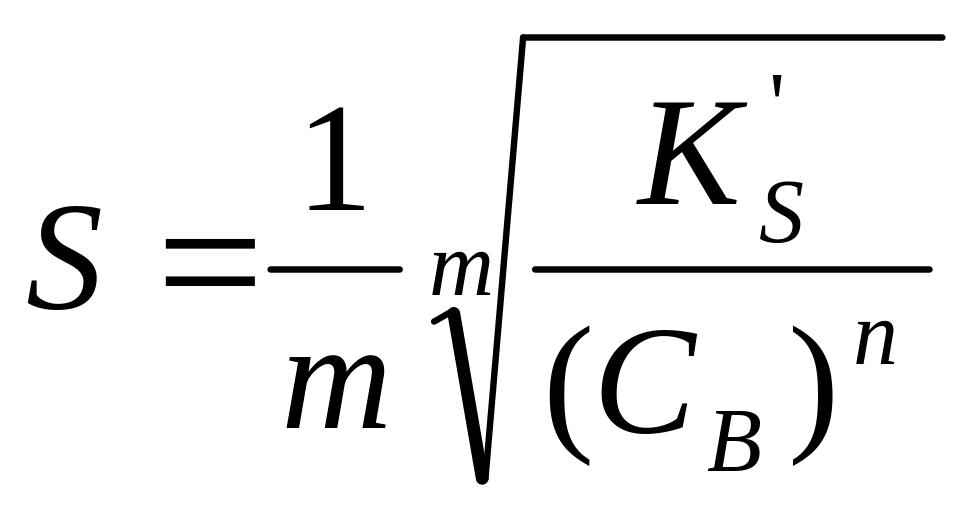 .
Если m=n,
т.е. бинарное соед, то
.
Если m=n,
т.е. бинарное соед, то
![]() (J=0)
(J=0)![]() ,
то равновесная конц. = активности, след.
можно использовать для расчетов K0
,
то равновесная конц. = активности, след.
можно использовать для расчетов K0![]()
![]() .
.![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
