
- •1) Создание нового метода анализа
- •2) Совершенствование методов, расширении сферы методов.
- •3) Ах конкретных объектов-использует методы ах для решения конкретных задач (производство, медицина).
- •3. На чем основано разделение катионов по аммиачно-фосфатной и кислотно-щелочной схемам анализа. Предложите наиболее рациональную схему анализа смеси катионов Al Zn Mn Mg Cu Cd.
- •4. Химическое равновесие в гомогенных растворах. Константы равновесия. Факторы, влияющие на химическое равновесие.
- •5. Взаимодействие между растворенным веществом и растворителем. Ионная сила раствора; активность и коэффициент активности; их взаимосвязь.
- •7. Современные представления о кислотах и основаниях. Кислотно-основные сопряжённые пары. Равновесие в системе кислота- сопряжённое основание. Константы кислотности и основности.
- •Примеры:
- •8. Влияние природы растворителя на силу кислот и оснований. Сильные и слабые протолиты. Нивелирующий и дифференцирующий эффект растворителя.
- •Протонные (протолитические) растворители:
- •1.Кислотные(протогенные) 2.Основные(протофильные) 3.Амфипротные(амфотерные)
- •9. Амфолиты. Реакция автопротолиза. Константа автопротолиза. Водородный показатель.
- •16. Механизм реакции комплексообразования. Равновесие в р-рах комплексных соединений, константа равновесия. Факторы влияющие на устойчивость комплексов.
- •1. Строение и свойства цик.
- •2. Катионы с недостр. D-оболочкой(V,Cr,Mn,Co.Pt-мет.,Ni,Cu и др.)Для кс,образованных этими эл-ми хар-но преобладание доли ков. Связи Me-l.
- •3. Влияние pH
- •17. Окислительно восстановительные реакции. Стандартные потенциалы. Реальные потенциалы. Направление реакции окисления-восстановления.
- •1.) Разделения 3)в колич. Анал.(титрование)
- •2) Определения
- •18 Факторы влияющие на величину равновесного электродного потенциала
- •2)Влияние комплексообразования
- •3)Влияние ионной силы
- •19 Особенности анализа анионов. Классификация анионов. Предложите анализ смеси анионов so42- , po43- , SiO32- .Приведите ур-е р-й.
- •3)Обнаружение po43-
- •4)Осадочная- в основе принцип последовательного осаждения малораств-х соед-й.
1.
АХ-наука
о способах идентефикации хим. соед., о
принципах и методах опред. хим. сост.
в-в и их хим. структ.
Задача:
получение информации о составе и
строении мат. объектов (изучение способов
идентефикации).
Структура:
выделяют 3 основных направления
-разработка
общих теоретических основ АХ – включает
теорию об отборе проб, составление
схемы анализа и изучает пути автомат.
анализа, применение ЭВМ.
-Разработка
методов анализа состоит из:
Цель:
в зависимости от задачи обеспечить
высокую точность инадежность результатов.
В
зависимости от цели анализ делят на
качественный(обнаружение и идентефикация
компонентов в-ва) и количественный(определение
их конц. или масс).
Методы:1)Пробоотбора
2)Разложения 3)Разделение 4) Обнаружение
и определение 5) Гибридные методы(дробный,
специф. р-ии). Методы определения делятся
на химические, физ.,биолог. Все хим. и
физ-хим методы базируются на р-иях:
кислотно-основных, ОВР, комплексообразования.
Методы разделения:осаждение, экстракция.
Анал.
р-ии-р-ии, которые сопровождаются
характерным
внешним эффектом. Р-ии с внешним эффектом,
характерным только для одного иона
называются специфическими. Их немного.
Чаще р-ии селективны-дают эффект,
характерный для нескольких ионов или
соед. Анал. р-ии можно выполнять сухим
и мокрыми путями. При мокром пути р-ии
протекают в р-ре, обычно между ионами.
Этот способ имеет более широкое
применение , чем сухой, т.к. большинство
р-ий протекают в р-рах между ионами. При
сухом пути в-во подвергают
обработке(нагревание, растирание) в
твердом виде. Систематический ход
анализа обычно проводят мокрым путём
в растворе исследуемого в-ва.
2.
Систематический анализ. На чем основано
разделение катионов по сероводородной
схеме. На примере смеси катионов Cr Co Ni
Cu Cd Sn(II IV) As (III V). Покажите возможность
разделения и анализ по сероводородной
схеме.
Систематический
анализ –анализ, по которому предварительно
проводиться разделение всех элементов
на отдельные группы, а обнаружение того
или иного элемента с помощью характ.
р-ий осуществляется в присутствии
ограниченного числа других элементов.
Сероводородная
схема основана на обработке р-ра
(предварительно удалив HCl
ом Ag
Pb
Hg)
H2S
в сильнокислой среде.
Групповые
реактивы H2S,
HCl,
(NH4)2CO3
разделяют 5 групп по образованию
катионами хлоридов, сульфидов и
карбонатов. Cr
Co Ni Cu Cd Sn(II, IV) As(III,V).
Данный
р-р вначале обрабатывают H2S
в кислой среде, получают осадок сульфиды
Cu
Cd
As(III,V)
и Sn(II,
IV).
Сульфиды As
и Sn
растворимы в полисульфиде аммония
(NH4)2Sn,
а сульфиды Cu
и Cd
нерастворимы(т.к.) относятся к разным
подгруппам. Катионы Cr
Co
Ni
находятся в р-ре полученном после
обработки сероводородом в кислой среде.
Кислотно-основный
метод основан на различном отношении
катионов к кислотам (соляной и серной)
и основаниям (NaOH
KOH
и NH4OH)
и различной растворимости хлоридов,
сульфатов и гидроксидов в воде, щелочах,
кислотах, и р-ре аммиака. По отношению
к групповым реагентам все катионы
делятся на 6 групп.
Аммиачно-фосфатный
метод основан на различной растворимости
фосфатов в воде, кислотах(уксусной,
азотной, соляной), щелочах и водном р-ре
аммиака.
Все
катионы делятся на 5 групп. Выгоден тем,
что фосфат-ионы не мешают ходу анализа
т.к. в нейтральной и щелочной средах
образуются малорастворимые фосфаты .
Для
данной смеси катионов более рациональный
метод-кислотно щелочной, т.к. анализ
идет по трем аналитическим группам, а
не по двум как в аммиачно-фосфатном, и
также менее трудоемко.
Хим.
равновесие устанавливается в рез-те
обратимой реакции aA+bB↔cC+dD
ΔG=0
Формула
соответствует закону действующих
масс-для идеальных систем в состоянии
хим. равновесия отношение произведений
активности продуктов р-ии в степенях
равных стехиометрическим коэфф. к
произведению активности исх. в-в, в
степенях, равных стехеометр. коэфф.,
есть величина постоянная при данных t
P
и в данном растворителе.
Кинетически,
химическое равновесие – состояние
динамического равновесия, при котором
каждый компонент создается с той же
скоростью, что и расходуется
Дифференцируя
ур-ие по T
для
экзотермических пр-ов (ΔH0<0)
величины K
с ростом Т убывают, а для эндотермических
возрастают.
На
поведение исх. в-в и продуктов влияют
посторонние в-ва – конкурирующие р-ии.
При этих р-иях при электростатическом
взаимодействии исп. условную K
равн.
[A]=αCa
Ca
– общая концентрация, α
– коэфф. пропорциональности.
Если
посторонние в-ва не вступают во
взаимодействие и отклонение от ЗДМ
обусловлено электростатическим
взаимодействием то Кравн выражают
через равновесные концентрации.
На
химическое равновесие также влияет
сольватационный эффект(взаимодействие
молекул растворителя с частицами
растворенного в-ва) т.е. это и конкурирующая
р-ия и электростатическое взаимодействие
одновременно)
Взаимодействие
между растворенным в-вом и растворителем
называют сольватацией. В водных р-рах
называется гидратацией. Сольватационные
эффекты являются частично электростатическими
и частично химическими. Сольватациия
р-ре не велика если в-во в виде молекул.
Если в-во в виде ионов то сальватация
больше, т.к между ионами действуют
электростатич. силы. Из за водородных
связей, взаимодействия между частицами
слабые. Физ. сольватация наблюдается
для молекул, а также ионов, недостаточно
склонных к образованию координационных
связей (Na
K
Ca
Ba).
Химическая сольватация обусловлена
образованием координационных связей
между молекулами растворителя и
частицами в-ва.
Активность
– это концентрация, которую имел бы
компонент идеального раствора,
обладающего теми же термодинамическими
свойствами, что и данный реальный
раствор. размерность: моль/л.
использовано в
законе действия масс.
Активность
иравновесная концентрация связаны:
фи
– коэффициент активности, хар-ет степень
отклонения системы от идеальной, за
счет электростатических взаимодействий
с посторонними ионами, и своими, если
С велика.
для
систем, близких к идеальной, γ(фи)≈1,
I
- величина, численно равная ½ сумме
произведений квадратов заряда каждого
из ионов на его концентрацию:
Зависимость
γ, заряда иона и I
выражают уравнением Дебая-Хюккеля
А и В
– константы, зависят от Т и диэлектрической
проницаемости растворителя. a
– максимальное расстояние сближения
ионов. γ индифидуально для иона не
определяют. определяюс средн. γ :
γ±(AmBn)
1) Создание нового метода анализа
2) Совершенствование методов, расширении сферы методов.
3) Ах конкретных объектов-использует методы ах для решения конкретных задач (производство, медицина).

3. На чем основано разделение катионов по аммиачно-фосфатной и кислотно-щелочной схемам анализа. Предложите наиболее рациональную схему анализа смеси катионов Al Zn Mn Mg Cu Cd.
4. Химическое равновесие в гомогенных растворах. Константы равновесия. Факторы, влияющие на химическое равновесие.
 константа
равновесия.
константа
равновесия.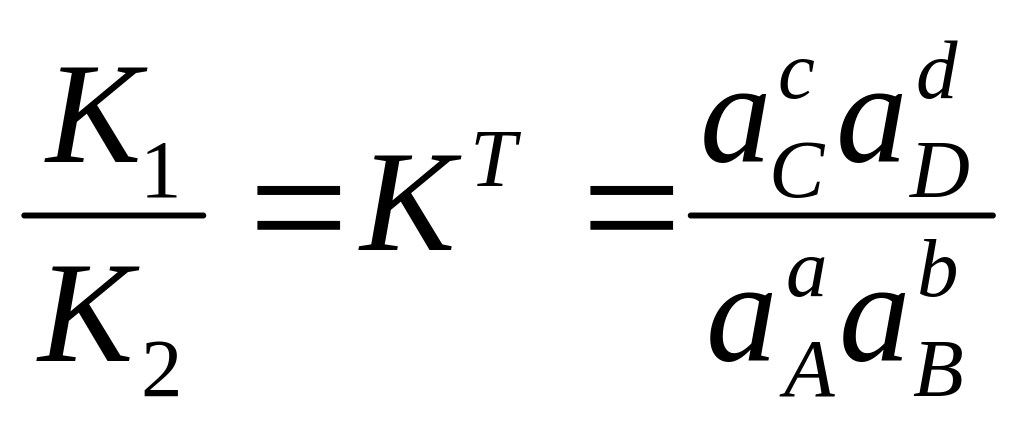 конст. равн-ия (V1=V2).
К позволяет определить направление и
глубину протекания хим. р-ии. K>1
благоприятствует протекание прямой
реакции, K<1
– обратной.
конст. равн-ия (V1=V2).
К позволяет определить направление и
глубину протекания хим. р-ии. K>1
благоприятствует протекание прямой
реакции, K<1
– обратной.![]() следовательно,
протеканию прямой р-ии (K>1,
lnK>1)
способствует выделение теплоты(ΔH0<0)
и увеличение энтропии(ΔS0>0)
системы.
следовательно,
протеканию прямой р-ии (K>1,
lnK>1)
способствует выделение теплоты(ΔH0<0)
и увеличение энтропии(ΔS0>0)
системы.
![]()
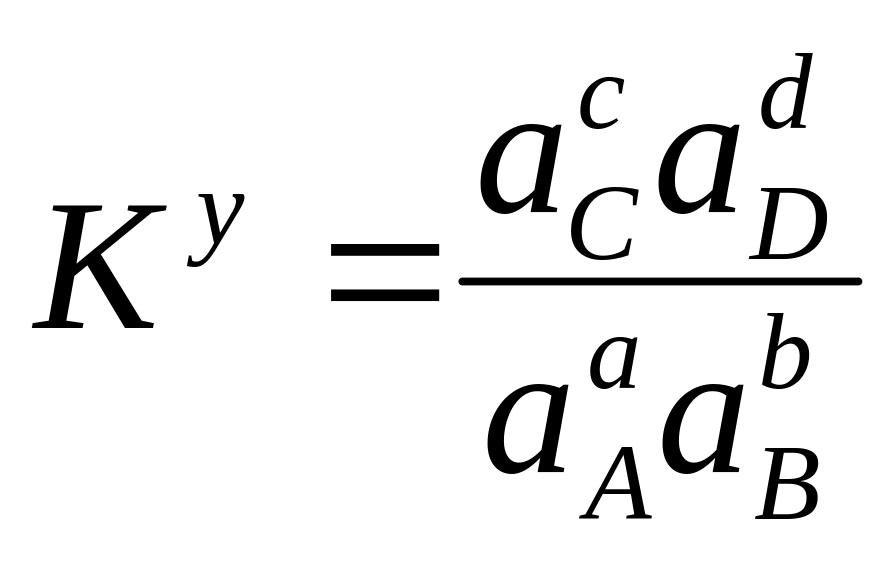
![]() γ-коэфф. активности.
γ-коэфф. активности.
![]() [A]-равновесная.
[A]-равновесная.5. Взаимодействие между растворенным веществом и растворителем. Ионная сила раствора; активность и коэффициент активности; их взаимосвязь.
![]() .
Коэфф. зависит от заряда иона и от ионной
силы р-ра, которая является мерой
электростатического взаимодействия
в р-ре (I)
.
Коэфф. зависит от заряда иона и от ионной
силы р-ра, которая является мерой
электростатического взаимодействия
в р-ре (I)![]() .
.![]() ,
когда I≤0.01M
,
когда I≤0.01M![]() ,
когда
I=0.01
– 0.1M
,
когда
I=0.01
– 0.1M![]()
