
- •Лабораторная работа №5
- •Опыт № 1 Нингидриновая проба.
- •Опыт 2 Обнаружение серосодержащих α -аминокислот (реакция Фоля)
- •Опыт №3 Амфотерные свойства α-аминокислот
- •Опыт №4 Реакция глицина с формальдегидом
- •Опыт №5 Обнаружение пептидной связи и образование комплексной соли глицина
- •Опыт №6 Осаждение белка концентрированными минеральными кислотами (проба Геллера)
- •Опыт №7 Разделение белковых фракций методом высаливания
- •Опыт №8 Коацервация растворов биополимеров
- •Опыт № 2 Обнаружение липидов в биоматериале по реакции с фосфорно-ванилиновым реактивом
- •Опыт № з Эмульгирование жиров
- •Опыт № 4 Омыление жиров
- •Опыт № 5 Выделение, омыление и обнаружение лецитина
- •Опыт № 6
- •Опыт № 7
- •Опыт № 8 Обнаружение карбонильных соединений в маслах и жирах по реакции с 2-тиобарбитуровой кислотой
- •Опыт № 9 Обнаружение двойных связей в высших жирных кислотах, их эфирах и липидах
- •Лабораторная работа 7 Тема: обнаружение углеводов в растворах и их выявление в биологических средах
- •Опыт № 1 Обнаружение углеводов (реакция Молиша)
- •Опыт № 2 Цветная реакция углеводов с серной кислотой
- •Опыт № з Реакция Толленса на пентозы
- •Опыт №4 Обнаружение альдоз (реакция Толленса)
- •Опыт №6 Обнаружение кетоз (реакции Селиванова)
Лабораторная работа №5
Тема:
РЕАКЦИИ ОБНАРУЖЕНИЯ АМИНОКИСЛОТ, БЕЛКОВ И ИХ ВЫЯВЛЕНИЕ В БИОЛОГИЧЕСКИХ СРЕДАХ
Цель:
Отработать умения экспериментально исследовать свойства аминокислот и белков.
Опыт № 1 Нингидриновая проба.
Реакция характерна для α-аминокислот и их остатков. Растворы α- аминокислот и белков при нагревании с нингидрином приобретают фиолетовое окрашивание.
Методика эксперимента
В одну из двух пробирок прилить 3—5 капель 1 % раствора яичного белка, в другую 3—5 капель 0,1 % раствора глицина. В каждую пробирку наливают по 2—3 капли 0,1 % водного раствора нингидрина. Содержимое пробирок осторожно нагреть. Описать наблюдения, сделать выводы.
Наблюдения__________________________________________
Выводы______________________________________________
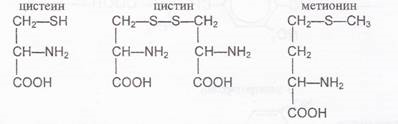
Опыт 2 Обнаружение серосодержащих α -аминокислот (реакция Фоля)
Реакция Фоля позволяет обнаружить в белке аминокислоты, содержащие слабосвязанную серу, например:
Методика эксперимента
В пробирку поместить 5—10 капель раствора яичного белка и вдвое больший объём 10 % раствора гидроксида натрия. Содержимое пробирки перемешать, нагреть до кипения (1 мин). К полученному щелочному раствору добавить 3—5 капель 10 % ацетата свинца и вновь прокипятить. Описать наблюдения.
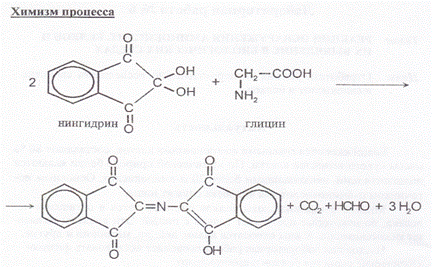
Химизм процесса
При кипячении белка со щелочью α -содержащие аминокислоты образуют сульфид натрия.

Интенсивность окраски зависит от количества серосодержащих аминокислот в белке и от концентрации белка в растворе.
Наблюдения__________________________________________
Выводы______________________________________________
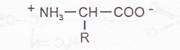
Опыт №3 Амфотерные свойства α-аминокислот
Амфотерность α-аминокислот обусловлена наличием в молекулах карбоксильной и аминогрупп, за счёт которых они образуют цвиттер-ион:
Методика эксперимента
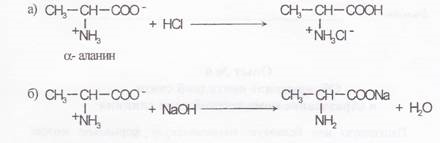
а) В одну пробирку поместить 3—5 капель 1 % раствора –α-аланина и добавить по каплям 0,1 % раствор хлороводородной кислоты, подкрашенной конго.
б) Во вторую пробирку поместить 3-5 капель 1 % раствора α -аланина и по каплям добавить 0,1 % раствора гидроксцда натрия, подкрашенного фенолфталеином. Запасать наблюдения.
Химизм процесса
Наблюдения__________________________________________
Выводы______________________________________________
Опыт №4 Реакция глицина с формальдегидом
Реакция позволяет защитить аминогруппу и используется для количественного определения карбоксильных групп в α-аминокислотах путём кислотно-основного титрования.
Методика эксперимента
В пробирку поместить 5 капель 1 % раствора глицина и добавить 1-2 капли метилового красного и 3-5 капель раствора формалина. Наблюдается изменение окраски.
Химизм процесса
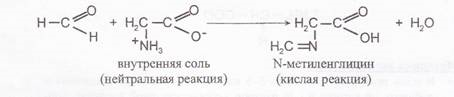
Блокируя аминогруппу формальдегид одновременно освобождает карбоксильную группу, которую далее можно анализировать методом титрования щелочью.
Наблюдения__________________________________________
Выводы______________________________________________
Опыт №5 Обнаружение пептидной связи и образование комплексной соли глицина
Пептидную или белковую макромолекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с образованием пептидной (амидной) связи между мономерными звеньями.
Методика эксперимента
В две пробирки прилить 3—5 капель 1 % раствора сульфата меди, добавить по каплям 10 % раствор гидроксида натрия до образования осадка. Далее в одну из двух пробирок приливают по каплям 1 % раствор глицина, а во вторую — раствор белка до растворения.

