
- •Окислительно-восстановительные реакции (овр).
- •1. Основные понятия и определения.
- •1. Отличительная особенность овр - конкуренция за электроны между окислителем и восстановителем *.
- •2. Отдача электронов восстановителем всегда сопровождается их одновременным присоединением к окислителю.
- •3. Протекание окислительно-восстановительных реакций сопровождается изменением степеней окисления частиц, входящих в состав реагирующих веществ.
- •2. Вычисление степеней окисления
- •3. Важнейшие окислители
- •4. Важнейшие восстановители
- •5. Вещества, проявляющие окислительно-восстановительную двойственность
- •О методе полуреакций
2. Вычисление степеней окисления
Степень окисления
атомов в молекуле обозначается арабской
цифрой (со знаком перед цифрой),
расположенной над символом элемента.
Например:
![]() ,
,![]() .
Степени
окисления элементов принимают значения
от -4 до +8.
.
Степени
окисления элементов принимают значения
от -4 до +8.
Для их определения руководствуются следующими правилами.
1. СО
элементов в простых веществах (состоящих
из одинаковых атомов), например
![]()
![]() ,
,
![]() и
др. равна нулю.
и
др. равна нулю.
2. Атомы кислорода
в соединениях проявляют главным образом
степень окисления равную
-2, например,
![]()
![]() .
Однако в
пероксидах
кислород проявляет степень окисления,
равную -1:
.
Однако в
пероксидах
кислород проявляет степень окисления,
равную -1:![]() ,
,
![]() .
В надпероксидах и озонидах степень
окисления кислорода имеет дробные
значения равные соответственно - 1/2 и -
1/3:
.
В надпероксидах и озонидах степень
окисления кислорода имеет дробные
значения равные соответственно - 1/2 и -
1/3:
![]() и
и
![]() .
Положительные
степени окисления кислород проявляет
лишь в
соединениях с фтором, например в дифториде
кислорода
.
Положительные
степени окисления кислород проявляет
лишь в
соединениях с фтором, например в дифториде
кислорода
![]() .
.
3.
Водород
в большинстве своих соединений находится
в степени
окисления,
равной +1, например,
![]() ,
.
Отрицательную степень
окисления, равную -1,
водород
проявляет в
соединениях со щелочными и щелочноземельными
металлами, например,
,
.
Отрицательную степень
окисления, равную -1,
водород
проявляет в
соединениях со щелочными и щелочноземельными
металлами, например,
![]() ,
,![]() .
.
4. Фтор в соединениях всегда проявляет только одну степень окисления, равную -1: .
5.
Щелочные
металлы (элементы группы I-а
группы) в соединениях всегда
проявляют степень окисления, равную
+1. Например,
![]() ,
,
![]() .
.
Щелочноземельные металлы (элементы группы П-а), а также цинк и кадмий в соединениях проявляют всегда степень окисления, равную +2. Например,
 ,
,
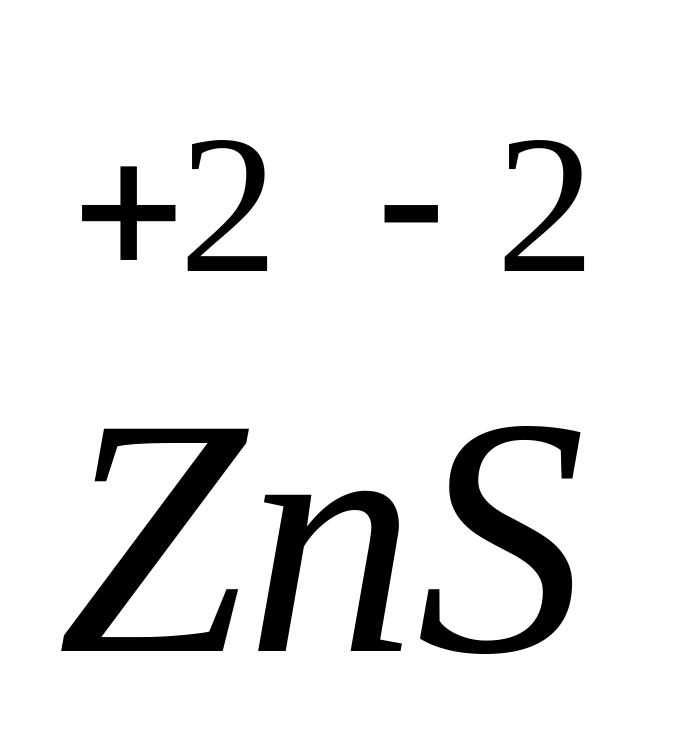 .
.Алюминий в соединениях проявляет степень окисления +3.
Степени окисления других элементов имеют переменные значения.
Сумма всех степеней окисления атомов в молекуле сложного вещества равна нулю. Так, например, в молекуле серной кислоты сумма положительных степеней окисления (+1) · 2 + (+6) = (+8) равна сумме отрицательных (-2) · 4 = (-8). Это правило можно использовать для вычисления неизвестных степеней окисления в молекулах сложных веществ. Например, в молекуле азотистой кислоты НNO2, степень окисления водорода +1, кислорода -2. Степень окисления азота примем равной х и определим из уравнения: (+1) + x + (-2) · 2 = 0. Откуда x = +3.
Сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона.
Максимальная СО элемента соответствует номеру группы, в которой расположен элемент в Периодической таблице Д.И. Менделеева.
В ходе ОВР происходит изменение СО в соответствии направлениями, показанными в таблице:
Степень окисления |
Пример |
Направление процессов |
|
+8 |
|
Окисление
У |
Восстановление
У |
+7 |
|
||
+6 |
|
||
+5 |
|
||
+4 |
|
||
+3 |
|
||
+2 |
|
||
+1 |
|
||
0 |
|
||
-1 |
|
||
-2 |
|
||
-3 |
|
||
-4 |
|
||
Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов, и какие соединения при этом образуются.
Вещества, в состав
которых входят атомы элементов в своей
максимальной (положительной) степени
окисления, например,
![]() ,
,
![]() ,
,
![]() ,
,
![]() и др. могут только восстанавливаться,
выступая в качестве окислителей.
Соединения, содержащие элементы в их
минимальной степени окисления, например,
и др. могут только восстанавливаться,
выступая в качестве окислителей.
Соединения, содержащие элементы в их
минимальной степени окисления, например,
![]() ,
,
и др. могут только окисляться и выступать
в качестве восстановителей. Вещества,
содержащие элементы в промежуточных
степенях окисления, например
,
,
и др. могут только окисляться и выступать
в качестве восстановителей. Вещества,
содержащие элементы в промежуточных
степенях окисления, например
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,![]()
![]() и др. обладают окислительно-восстановительной
двойственностью.
В зависимости от партнера по реакции
такие вещества способны как принимать,
так и отдавать электроны.
и др. обладают окислительно-восстановительной
двойственностью.
В зависимости от партнера по реакции
такие вещества способны как принимать,
так и отдавать электроны.

 величение
степени окисления
величение
степени окисления меньшение
степени окисления
меньшение
степени окисления