
 Содержание:
Содержание:
Стр.
Введение…………………………………………………………………………...1
1 Первый закон термодинамики……...……..…………………………………...2
1.1 Исследование……...……………….…….…………..…………………..........6
1.2 График в PV-координатах…………......………………………………..........9
1.3График в TS-координатах………………..………………………………….10
2 Второй закон термодинамики……………………………….………………..11
2.1 Циклы и их роль в технике……………………….………………………....11
2.2.1 Простейший цикл ГТУ…………………………….…………………...…12
2.2.2 Сложный цикл ГТУ……………….……………………………………….13
2.3 Расчёт……………………………….…………………...……………………14
2.4 Графики…………………….…….…………………………………….…….18
 Введение
Введение
Термодинамика – наука, занимающаяся установлением связей между теплотой, работой и изменением состояния системы тел.
Термодинамика подразделяется на:
-
Техническая термодинамика (общая теория тепловых машин и апаратов)
-
Химическая термодинамика
-
Физическая термодинамика
Техническая термодинамика:
-
Тепловые двигатели: а) Двигатели внутреннего сгорания б) Газотурбинные двигатели в) Паротурбинные двигатели
-
Холодильные машины
-
Тепловые насосы
Основная задача технической термодинамики решить вопрос о получении наибольшей работы за счет заданного количества теплоты.
КПД тепловых двигателей рассчитывается по формуле:
![]()
Где: L – механическая работа. Q – теплота. Для холодильных машин:
![]() Где:
Где:
![]() - холодильный коэффициент.
Для тепловых
машин:
- холодильный коэффициент.
Для тепловых
машин:
![]() Где:
Где:
![]() – отопительный коэффициент.
Рабочее
тело – вещество с помощью которого
совершаются процессы совершения работы
и переноса теплоты. Рабочими телами
являются газы и пары.
– отопительный коэффициент.
Рабочее
тело – вещество с помощью которого
совершаются процессы совершения работы
и переноса теплоты. Рабочими телами
являются газы и пары.
Термодинамическая система – рабочее тело рассматриваемое в определенных границах. Все тела за пределами этих границ являются окружающей средой. Если рабочее тело рассматривается во взаимодействии с окружающей средой, то система называется расширенной. В технической термодинамике системы подразделяются на:
-
Изолированные – система через границу которой не передается ни теплота, ни работа, не масса рабочего тела.
-
Закрытые - система через границу которой может передаваться теплота и работа, а масса рабочего тела границ не пересекает.
-
Открытая - система через границу которой может передаваться теплота, работа и масса рабочего тела.
Термодинамическое свойство – любая физическая величина изменения которой зависят только от начального и конечного состояния системы. Термодинамические свойства подразделяются на:
-
 Интенсивные
– не зависящие от массы рабочего тела.
Интенсивные
– не зависящие от массы рабочего тела. -
Экстенсивные – зависящие от массы рабочего тела.
Термодинамический процесс – изменение состояния системы заключающиеся в последовательном прохождении ее через рад состояний.
Процессы бывают:
-
Обратимые.
-
Не обратимые.
Термодинамический процесс называется обратимым если он может быть проведен в прямом и обратном направлении и при этом все изменения системы происходящие в прямой части в точности обращаются в обратной части, а в окружающих систему телах нет никаких изменений.
Причины необратимости термодинамических процессов:
-
Самопроизвольный переход теплоты от тел более нагретых к телам менее нагретым.
-
Неупругий удар и трение.
-
Самопроизвольный переход жидкостей или газов из области более высокого давления в область более низкого давления без совершения механического движения.
-
Самопроизвольная диффузия газов.
Обратимость – критерий совершенства термодинамического процесса.
Энергия – мера количественной оценки различных форм движения материи.
Виды энергии:
-
Механическая.
-
Химическая.
-
Ядерная.
-
Электромагнитная.
-
Термическая.
В закрытой системе под термической энергией понимается внутренняя энергияU[Дж]
![]() В
открытой систем под термической энергией
понимается энтальпия
В
открытой систем под термической энергией
понимается энтальпия ![]() .
.
![]()
![]()
Способы обмена энергией:
-
Совершение работы одного тела над другим
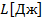 .
.
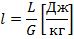
-
Теплота
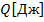 .
.

Теплоемкость – физическое свойство тела измеряемое количеством теплоты затрачиваемом на нагрев единицы количества вещества на 1 кельвин.
Теплоемкости подразделяются на:
-
Массовую теплоемкость
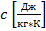
-
Объёмную теплоемкость
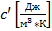
-
 Мольную
теплоемкость
Мольную
теплоемкость 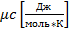
Теплоемкость зависит от:
-
Физических свойств газа.
-
Параметров состояния рабочего тела.
-
Характера протекающего процесса.
Истинная удельная теплоемкость – отношение бесконечно малого количества теплоты сообщаемого в бесконечно малом процессе.
I. Первый закон термодинамики
Первый закон термодинамики – энергия изолированной системы при любых происходящих в ней процессах может переходить одной формы в другую, но по величине остаётся неизменной.
![]()
Где: Q – теплота,
L – работа,
∆E – энергия системы;
 Базисная
формулировка первого закона термодинамики:
Теплота, сообщаемая системе расходуется
на изменение энергии системы и совершение
работы.
Базисная
формулировка первого закона термодинамики:
Теплота, сообщаемая системе расходуется
на изменение энергии системы и совершение
работы.
![]()
Где: Q - теплота,
∆Е – изменение внутренней энергии,
L – работа.
Энергия закрытой системы обусловлена исключительно внутреннем (тепловым) состоянием рабочего тела и поэтому отожествляется с понятием внутренняя энергия.
![]()
![]()
Для идеального газа ![]() ,
следовательно
,
следовательно ![]()
Работа в закрытой системе может осуществляться только за счет изменения объема, по этому она называется работой расширения.
![]()
Математическое выражение для первого закона термодинамики: Теплота, сообщаемая закрытой термодинамической системе, расходуется на изменение внутренней энергии и совершения работы расширения.
![]()
![]()
Дифференциальная форма первого закона термодинамики для идеального газа:
![]()
Р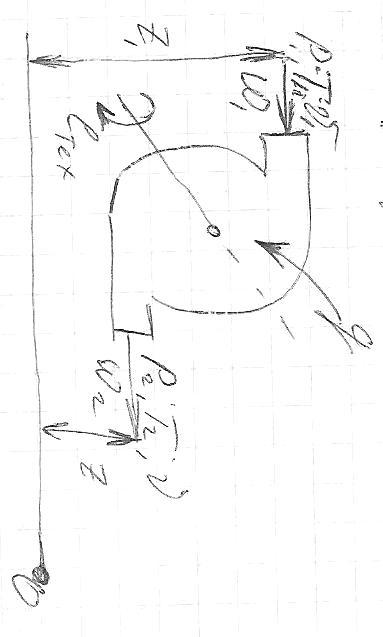 абота
процесса в открытой системе совершается
в потоке рабочего тела и называется
располагаемой работой.
абота
процесса в открытой системе совершается
в потоке рабочего тела и называется
располагаемой работой.
![]()
Располагаемая работа определяется суммой трех механических работ:
-
Работа совершаемая впереди идущим потоком.
-
Работа в потоке.
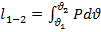
-
Работа против впереди идущего потока
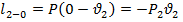
Располагаемая работа может проявить себя в виде трех механических работ:
-
Техническая работа
-
Изменение кинетической энергии рабочего тела.
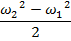
-
Изменение положения рабочего тела.
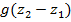
Математическое выражение первого закона термодинамики в условиях открытой системы: Теплота сообщаемая открытой термодинамической системе, расходуется на изменение энтальпии и совершение предполагаемой работы.
![]()

1.1)Расчёт:
1.1.1) Определяем температуру сжатого воздуха:
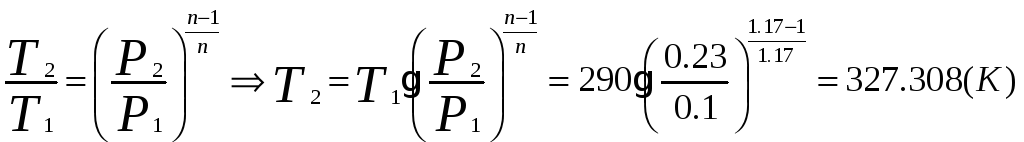
1.1.2) Определяем объёмный расход на выходе из компрессора:
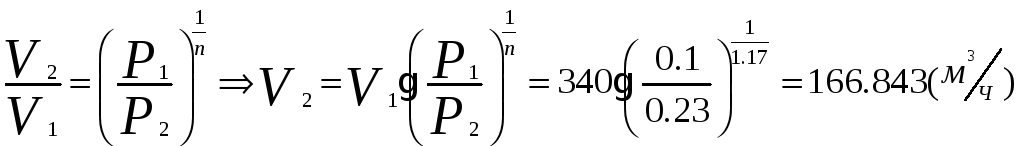
1.1.3) Определяем изменение внутренней энергии и энтальпии воздуха при сжатии:
![]()
![]()
1.1.4) Определяем затрачиваемую на сжатие работу и теоретически необходимую
мощность для привода компрессора:
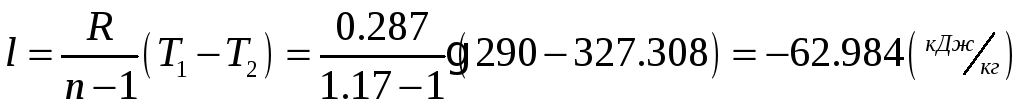
![]()
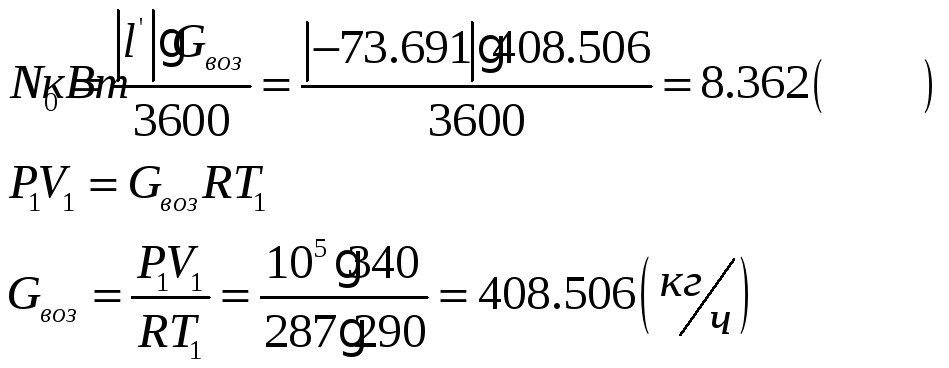
1.1.5) Определяем количество отводимой от воздуха теплоты и расход охлаждающей воды:
![]()
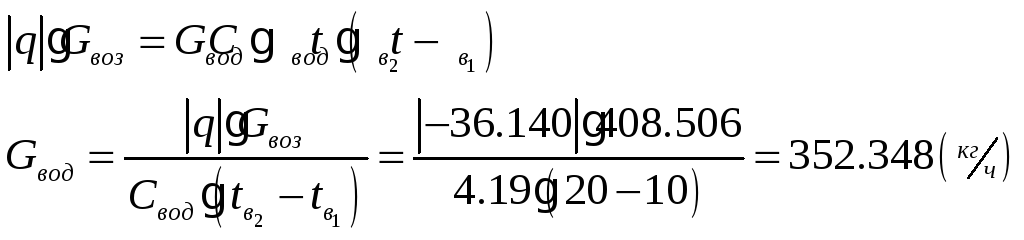
1.1.6) Определяем диаметр входа и выхода воздуховодов:
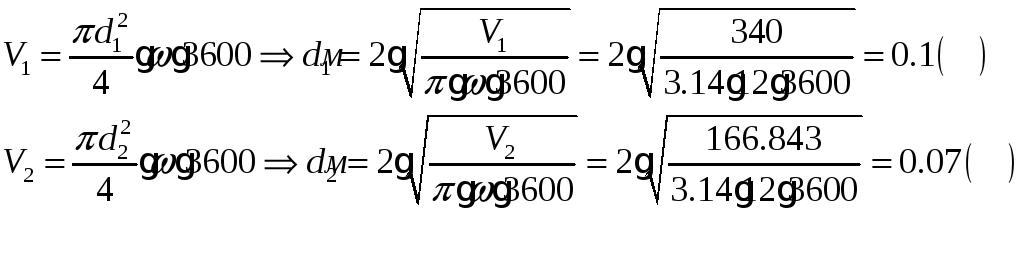
1.1.7) Составляем энергобаланс процесса:
![]()
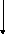

![]()
![]()
1.1 .8)
Строим график процесса в PV
координатах
.8)
Строим график процесса в PV
координатах
|
P(МПа) |
|
|
|
|
|
|
|
|
|
|
|
|
1.
![]()
2.
![]()
3.
![]()
![]()
4.
![]()
![]()
5.
![]()
![]()
Таблица №1:
|
P(МПа) |
0.1 |
0.11 |
0.122 |
0.151 |
0.23 |
|
|
0.832 |
0.76 |
0.695 |
0.582 |
0.408 |
1.1.9)Строим графики в ts координатах по точкам процесса сжатия, а так же изобар,
между которыми расположен процесс сжатия. Сделать соответствующее обозначение
площадей под кривыми.
|
T(К) |
|
|
|
|
|
|
S(кДж/кг К) |
|
|
|
|
|
![]()
1.
![]()
2.
![]()
3.
![]()
4.
![]()
5.
![]()
Таблица №1
|
T(К) |
290 |
299.327 |
308.654 |
317.981 |
327.308 |
|
S(кДж/кг К) |
0.0606 |
0.003 |
0.0003 |
-0.0286 |
-0.0564 |

Изобары:
1.
![]()
![]()
2.
![]()
![]()
3.
![]()
![]()
4.
![]()
![]()
1.1.10) В связи с изменением условий
охлаждения стенок цилиндра компрессора,
показатель политропы сжатия увеличивается
до n=1.33. Определить
для новых условий температуру воздуха
![]() С,
и количество отводимой теплоты q.
С,
и количество отводимой теплоты q.
n=1.33
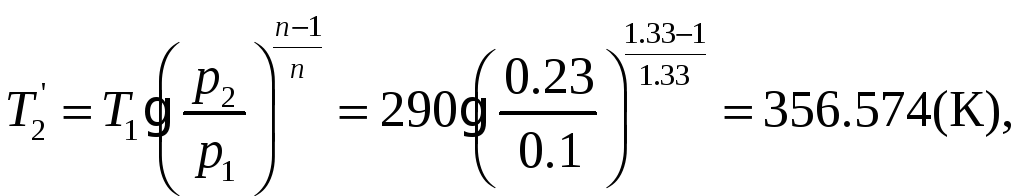
![]()
![]()
Вывод: В результате изменения условий,
температура
![]() увеличилась по отношению к температуре
увеличилась по отношению к температуре
![]() ,
количество отводимой теплоты уменьшилось
,
количество отводимой теплоты уменьшилось
![]() .
Это говорит о том, что при изменении
показателя политропы до n=1.33
процесс смещается в сторону адиабатического.
.
Это говорит о том, что при изменении
показателя политропы до n=1.33
процесс смещается в сторону адиабатического.
