- •Главное и орбитальное квантовые числа
- •Орбитальное и магнитное квантовые числа
- •Принципы заполнения электронами энергетических уровней и подуровней в атоме: принцип минимума полной энергии атома, принцип Паули, правила Гунда и Клечковского.
- •Периодический закон и периодическая система д.И. Менделеева. Периодичность изменения радиусов атомов и ионов, энергии ионизации и сродства к электрону, электроотрицательности элементов.
Электронные конфигурации атомов и периодичность свойств химических элементов
Элементарные сведения о квантово-механической модели строения атома
К началу 20 века было открыто множество явлений прямо или косвенно свидетельствующих о сложном строении атомов (фотоэффект*, радиоактивность** и т.д.). Возник вопрос: как устроен атом? Наиболее удачная модель строения атома была предложена в 1911 г английским физиком Эрнестом Резерфордом.
Фотоэффект - испускание электронов металлами и полупроводниками при их освещении.
Радиоактивность – самопроизвольный распад атомов, сопровождающийся испусканием различных частиц.
Вокруг положительно заряженного ядра, в котором сосредоточена основная часть массы атома, вращаются электроны. Подобную модель называют ядерной. Радиус атома приблизительно оценивается величиной 10-10 м, а ядра 10-15 м. Согласно классической электромагнитной теории, система, состоящая из массивного положительно заряженного ядра (1,67 ּ 10-27 кг для атома водорода) и лёгких (масса электрона 9,1 ּ 10-31 кг) отрицательно заряженных электронов (электрон в 1835 раз легче ядра), может быть устойчивой лишь при условии, если электрон находится в движении. Однако непрерывно движущийся электрон (скорость движения электрона 108 м/с) должен непрерывно излучать энергию и соответственно израсходовать её за ничтожную долю секунды. Однако атом водорода устойчив. Следовательно, такая модель неверна. В 1913 г Нильс Бор (Дания) предположил, что электрон движется не по любым, а лишь по строго определённым («разрешённым») орбитам. Энергия электрона теряется лишь при переходе между двумя «разрешённым» орбитами. Так был и заложены принципы квантования энергии электрона.
В
1924 г французский учёный Луи де Бройль
высказал предположение о волновом
характере материи. Согласно де Бройлю
материальному объекту с импульсом mv
отвечает длина волны λ![]() .
Количественная взаимосвязь между
волновыми и корпускулярными свойствами
материи выражена уравнением де Бройля:
.
Количественная взаимосвязь между
волновыми и корпускулярными свойствами
материи выражена уравнением де Бройля:
![]() , где
, где
h – постоянная Планка, равная 6,626 ּ10-34 Дж ּс,
m
и
![]() – масса и скорость частицы.
– масса и скорость частицы.
Для макрообъектов длина волны крайне мала из-за относительно большой массы. Например, для винтовочной пули массой 0,025 кг, движущейся со скоростью 9ּ102 м/с длина волны равна 2,94 ּ10-31 м. Для электрона при скорости движения 3 ּ108 м/с - 2,4 ּ10-10 м, а это уже размеры атома.
Матер. объект |
Масса, кг |
Скорость, м/с |
Длина волны, м |
Человек Винтовочная пуля |
90 0,025 |
3 9 ּ 104 |
2,4∙10-36 2,94 ּ 10-35 |
Электрон |
9,1 ּ 10-31 |
3 ּ 108 |
2,4 ּ 10-10 |
Таким образом, в макромире мы не замечаем волновых свойств материи. Электрон же можно рассматривать и как частицу, и как волну. Предположение де Бройля в дальнейшем подтвердилось – была обнаружена дифракция электронов, а впоследствии и дифракция нейтронов.
Описанием поведения микрочастиц занимается квантовая механика. В 1926 г Гейзенбергом сформулирован принцип неопределённости: невозможно одновременно с одинаково большой степенью точности указать положение микрочастицы и её импульс. В математической форме принцип неопределённости может быть выражен соотношением:
Δp ּ Δq ≥ h/2π, где
Δp – неточность измерения импульса (mv);
Δq - неточность измерения координаты частицы.
Можно оценить лишь вероятность нахождения электрона в том или ином месте пространства. Оценка этой вероятности проводится математически при помощи волнового уравнения Шрёдингера (1926 г). (Эрвин Шрёдингер – австрийский физик):
НΨ = ЕΨ, где
Н - оператор Гамильтона (математический символ, указывающий, какие действия следует осуществить над функцией, стоящей под знаком оператора);
Е – энергия электрона.
Ψ – волновая функция. Определённый физический смысл имеет её квадрат Ψ2, который характеризует вероятность нахождения электрона в данной точке атомного пространства. Величина Ψ2 ∆V представляет собой вероятность обнаружения электрона в элементе объёма ∆V (её называют орбиталью электрона).
Уравнение Шрёдингера имеет не одно, а набор решений:
Ψ1, Ψ2, Ψ3, …, которым соответствуют энергии электрона:
Е1, Е2, Е3, … , т.е. энергия электрона принимает не любые, а строго определённые значения (ряд дискретных «разрешённых» энергий). Таким образом, мы вновь говорим об энергетических уровнях, т. е. пришли к идее квантования энергии, но уже с точки зрения квантовой механики.
Ψ – волновая функция, соответствующая амплитуде трёхмерного волнового процесса Ψ = Ψ(x,y,z), где x,y,z – координаты точки. Поэтому результатом решения уравнения Шрёдингера является комбинация некоторых параметров (набор целых чисел n, l, ml), которые называют квантовыми.
Ψ
 Ψ(x,y,z)
n,
l,
ml
Ψ(x,y,z)
n,
l,
ml
Квантовые числа n, l, и ml определяют геометрические особенности электронного облака.(Электрон в атоме представляет собой трёхмерную колеблющуюся систему, ему соответствует трёхмерная стоячая волна. Очевидно, что для описания пространственного движения электрона в атоме нужны три и только три квантовых числа.).
Квантовые числа
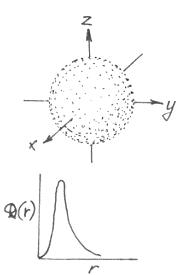
n - главное квантовое число, определяет энергию электрона и расстояние его наиболее вероятного нахождения вблизи ядра (размеры электронного облака). Принимает целочисленные значения n = 1, 2, 3,…¥
Чем больше n, тем больше энергия электрона и тем большие размеры имеет его электронное облако.
n = 1, 2, 3,…¥
э нергия
увеличение
нергия
увеличение
р азмеры электр.облака увеличение
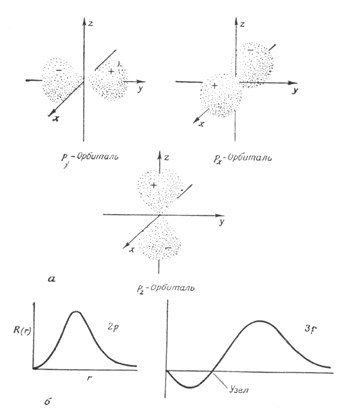
l - орбитальное квантовое число, определяет момент количества движения электрона (векторная величина). Принимает значения:
l = 0,1,2,3…(n-1);
определяет форму электронного облака (орбитали) и характеризует запас энергии электрона в энергетическом подуровне.
Для удобства вместо числовых значений l употребляются буквенные:
Значение l 0 1 2 3 4 …
Символ орбитали s p d f q …
Энергия орбиталей, которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова.
Es < Ep < Ed < Ef …
Главное и орбитальное квантовые числа
n = 1,2, 3,4… |
l от 0…до(n-1) |
Обозначение подуровня |
Число подуровней на уровне (равно n) |
Число орбиталей на уровне (равно n2) |
1 |
0 |
1s |
1 |
1 |
2 |
0 1 |
2s 2p |
2 |
4 |
3 |
0 1 2 |
3s 3p 3d |
3 |
9 |
4 |
0 1 2 3 |
4s 4p 4d 4f |
4 |
16 |
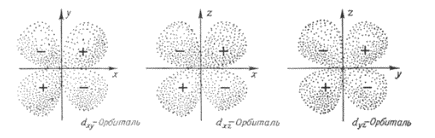
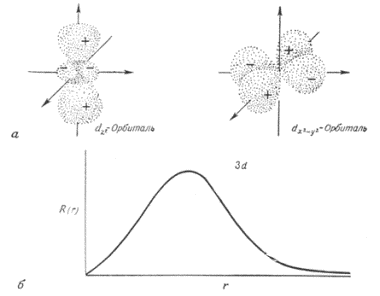
ml - магнитное квантовое число, определяет проекцию вектора момента количества движения на направление магнитного поля. Значения ml характеризуют разрешённые ориентации электронного облака в пространстве (ml = -l …0…+l).
Орбитальное и магнитное квантовые числа
l подуровень |
ml (-l…0…+l) всего 2l+1 значений |
Число АО на подуровне 2l+1 |
Графическое изображение АО |
0 (s) |
0 |
1 |
|
1 (p) |
-1,0,+1 |
3 |
|
2 (d) |
-2,-1,0,+1,+2 |
5 |
|
3 (f) |
-3,-2,-1,0,+1,+2,+3 |
7 |
|
Когда эти три квантовых числа определены, волновая функция описывает конкретный электрон и обычно называется атомной орбиталью (мы говорим, что задана орбиталь).
Форма s,p,d-орбиталей:
|
|
|
|
|
|
|
|
|
|
Изучая атомные спектры, установили, что электрон имеет еще и собственный момент количества движения, который был назван спином (to spin - вращать); квантовое число его определяющее (ms) может иметь только два значения: +1/2 и -1/2. (¯). Необходимость введения четвёртого квантового числа не связана с решением уравнения Шрёдингера.
Принципы заполнения электронами энергетических уровней и подуровней в атоме: принцип минимума полной энергии атома, принцип Паули, правила Гунда и Клечковского.
Распределение электронов в атоме, находящихся в основном состоянии, определяется зарядом ядра. При этом заполнение электронами энергетических уровней, подуровней и орбиталей происходит в той последовательности, при которой формируются электронные конфигурации, соответствующие минимуму полной энергии атома и наибольшей связи электронов с ядром.
Реализуется этот принцип, если соблюдаются принцип Паули, правило Гунда и правила Клечковского.
Принцип Паули: в системе (атоме) не может быть двух электронов, характеризующихся одним и тем же набором четырех квантовых чисел. Или: на одной орбитали могут находиться только два электрона с противоположными спинами.
+1/2 |
|
-1/2 |
неправильно |
+1/2 |
|
-1/2 |
правильно |
Правило Гунда: заполнение электронами данного энергетического подуровня происходит таким образом, чтобы суммарный спин электронов по абсолютной величине был максимальным.
Например, p – орбиталь заполняется:
px
py
pz
↓
↑
↓
↓↑
↑ px
py
pz
px
py
pz
-1/2 +1/2 -1/2 -1/2 +1/2 +1/2
Σspin = 1/2 Σspin = 1/2 неправильно
↑
↑
↑
↓
↓
↓
+1/2 +1/2 +1/2 -1/2 -1/2 -1/2
Σspin = 3/2 Σspin = 3/2 правильно
3. Последовательность заполнения электронами энергетических состояний в атоме определяется правилами Клечковского:
1) заполнение электронами орбиталей происходит в порядке возрастания суммы (n+l);
2) при равенстве суммы (n+l) - в порядке увеличения главного квантового числа n.
Орбитали |
n |
l |
n+l |
1s |
1 |
0 |
1 |
2s |
2 |
0 |
2 |
2p |
2 |
1 |
3 |
3s |
3 |
0 |
3 |
3p |
3 |
1 |
4 |
3d |
3 |
2 |
5 |
4s |
4 |
0 |
4 |
4p |
4 |
1 |
5 |
4d |
4 |
2 |
6 |
4f |
4 |
3 |
7 |
5s |
5 |
0 |
5 |
Последовательность заполнения электронами уровней и подуровней:
1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d2-106p67s26d15f146d2-107p6…
Не вдаваясь в детали:
… 6s2 4f145d106p67s25f146d107p6…
Теперь можно составлять электронные формулы любых атомов, если известно количество электронов.
Малые периоды на примере элементов ІІІ периода:
Полная электронная формула атома натрия: 11Na 1s22s22p63s1
Сокращённая: [Ne]3s1 (…3s1)
Электронные формулы других атомов: 14Si [Ne]3s23p2; 15P [Ne]3s23p3
18Ar [Ne]3s23p6
Большие периоды на примере элементов ІV периода:
19K [Ar]4s1 21Sc [Ar]4s23d1 23V [Ar]4s23d3 26Fe [Ar]4s23d6
30Zn [Ar]4s23d10 31Ga[Ar]4s23d104p1 36Kr [Ar]4s23d104p6
«Проскок» электрона»
Атом |
По положению в ПС |
С учётом «проскока» |
Cr Mo |
…4s23d4 …5s24d4 |
…4s13d5 …5s1 4d5 |
Сu Ag |
…4s23d9 …5s24d9 |
…4s13d10 …5s14d10 |
Электронно-графическая формула:
C
↑
↑
↑
↑
↑
↑
↑
 4s
3d
4p
возрастание Е
4s
3d
4p
возрастание Е
C
↑
↑
↑
↑
↑
↑
3d 4s 4p возрастание n