
Лабораторная работа № 2
Определение постоянной радиоактивного распада нестабильных изотопов.
1.Атомистические концепции строения материи.
Впервые понятия об атоме как последней и неделимой частице, а также понятие пустоты возникли в античной древней Греции в рамках натурфилософского учения и высказанные философом Левкиппом (500 – 440 до н. э.). Атомистические представления Левкиппа были дополнены и развиты другим древнегреческим философом Демокритом (460 - 370 до н. э.) и согласно гипотезе Демокрита:
1. В абсолютной пустоте существует бесконечное число атомов.
2. Атомы имеют разнообразную форму.
3. Они движутся беспорядочно в пустоте, сталкиваются и отскакивают друг от друга.
4. Атомы могут сцепляться друг с другом в разных положениях и сочетаниях, т. е. образовывают вещество с разным качеством.
Последователь школы натурфилософского учения философ Эпикур (340 – 270 до н. э.) наделил атомы свойством тяжести. Эпикур считал что атомы вечные, а вещи образованные ими гибнут. Следовательно, после гибели вещей атомы могут снова образовывать новые вещи.
Такое развитие взглядов и конкретизация свойств атомов позволили расширить представления о строении Земли, звезд и космических миров, состоящих из атомов. Современное человечество не перестает удивляться гениальности и точности предсказаний древнегреческих философов, многие из которых были доказаны спустя тысячелетия и основные мысли о строении материи стали основой атомистической концепции.
На основании существующей атомистической концепции физики и химики в конце 19 века и в начале 20 предприняли попытки модельного представления атома, и самой удачной оказалась планетарная модель атома, предложенная Э. Резерфордом (1911 г.) и затем усовершенствованная в 1913 г. Н. Бором. В настоящее время эта модель принята за основную и другой модели атома никто предложить не смог, но ученные не могли объяснить почему электроны не падают на ядро, что служило предметом многочисленных споров в науке.
Нильс Бор предложил два постулата, которые разрешали противоречия в модели самого простейшего атома, состоящего из одного электрона:
1. Среди множества орбит в атоме существуют такие, находясь на которых электроны при своем движении не излучают и не поглощают энергии. Такие орбиты назвали стационарными. С точки зрения классической физики такого быть не может, но возможно, что представления классической физики не всегда можно переносить в мир частиц.
2. При переходе между стационарными орбитами электрон излучает или поглощает квант энергии.
Свойства многоэлектронных атомов удалось установить после возникновения квантовой механики.
Древнегреческие философы все же ошибались в некоторых атомистических концепциях, в частности, атомы оказались более сложные по своему структурному строению и время жизни некоторых атомов оказалось не бесконечным. В 1923 была поставлена последняя точка в определении состава атома. В этом году английский физик Дж. Чедвик открыл частицу нейтрон, входящую в состав атома.. Теперь модель атома можно представить как совокупность электронов - отрицательно заряженных частиц, вращающихся по орбитам вокруг ядра. Ядро состоит из нейтронов и протонов. Протоны - положительно заряженные частицы, а нейтрон не имеет заряда. Вся масса атома сосредоточена в ядре т. к. один протон почти в 2000 раз тяжелее электрона, а массы протона и нейтрона почти одинаковы.
Что касается времени жизни атомов, то по мере изучения различных элементов, представленных в таблице Менделеева, оказалось что существуют ядра разных атомов живущие от 108 – 10 9 лет до нескольких долей секунды.
В настоящее время современной науке уже известны свойства и параметры более 115 атомов, хотя, в таблице Менделеева, пока мы можем видеть 104 элемента, достаточно хорошо изученных, а свойства остальных элементов уточняются. Обратите внимание на то, что атомные веса всех элементов не целые числа. Почему? Ведь в быту мы всегда говорим или имеем в виду, что атомный вес, например, атома водорода равен единице, или гелия – четырем. Уже в начале двадцатого века ученным стало известно, что ядро любого атома состоит из изотопов: т.е. ядер у которых заряд одинаковый, а масса разная. Более того, процентное содержание разных изотопов в ядре разное. Поэтому и атомные массы всех элементов не целые числа. Например, рассмотрим атом водорода. В таблице Менделеева он находится на первом месте и атом водорода, как и любой атом из таблицы схематично изображают так:
Заряд атома- 1h1.00797 – масса атома (ядра)
На самом деле в состав ядра водорода входят три изотопа 1Н1 – протий, 1Н2 – дейтерия и 1Н 3 - тритий. Первые два изотопа – стабильные и входят в состав атома в следующем процентном содержании 99.9885% : 0.0115% . Тритий – нестабильный (радиоактивен) с периодом полураспада 12.32 лет.
Второй пример – ядро кислорода. Оно состоит из трех устойчивых изотопов: 8О16 , 8О17 и 8О18 в процентном содержании 99.759% : 0.037% : 0.204% соответственно. Однако, в ядре присутствуют и нестабильные изотопы: 8О11, 8О13 , 8О14 , 8О15 , 8О19 и 8О20 . Такой сложный состав обуславливает его конечную атомную массу. Перечисленные нестабильные изотопы имеют период полураспада от 21с до 150 лет.
Периодом полураспада Т называется время, в течении которого распадается половина всех ядер. Значение периода полураспада для разных элементов очень разное и может изменяться от долей секунды до миллионов лет. Некоторые интересные данные представлены в таблице.
элемент |
период полураспада T |
Торий - 234 |
24.1 сутки |
Протакиний - 234 |
1.17 минут |
уран - 234 |
245000 лет |
торий - 230 |
8000 лет |
полоний - 214 |
0.000164 секунды |
свинец - 210 |
22.3 лет |
свинец - 214 |
26.8 секунд |
Физики и химики, исследуя свойства ядер обнаружили что, нестабильные изотопы, самопроизвольно распадаясь, превращаются в совершенно другие ядра. Например, ядро урана может превратиться в ядро плутония. Этот процесс самопроизвольного распада называется явлением естественной радиоактивности, и он сопровождается вылетом из ядра атома α – альфа частиц т.е. ядер атомов гелия 2He4 , β – бета частиц, потока электронов -1e0 и γ – гамма лучей , электромагнитных волны.
Радиоактивный распад происходит по определенному закону – экспоненциальный закон:
![]() ( 1 )
( 1 )
где N – число не распавшихся ядер к моменту времени t. N0 – число ядер в момент времени t = 0 (начало распада). λ – постоянная радиоактивного распада, индивидуальная для каждого вещества. Определим постоянную радиоактивного распада, учитывая, что t = T и за это время распадается половина ядер: N = 0.5N0. Подставив эти значения в закон радиоактивного распада ( 1 ) и решая уравнение относительно λ получим:
 (
2 )
(
2 )
Закон радиоактивного распада (1) можно представит в более простом виде, если прологарифмировать выражение:
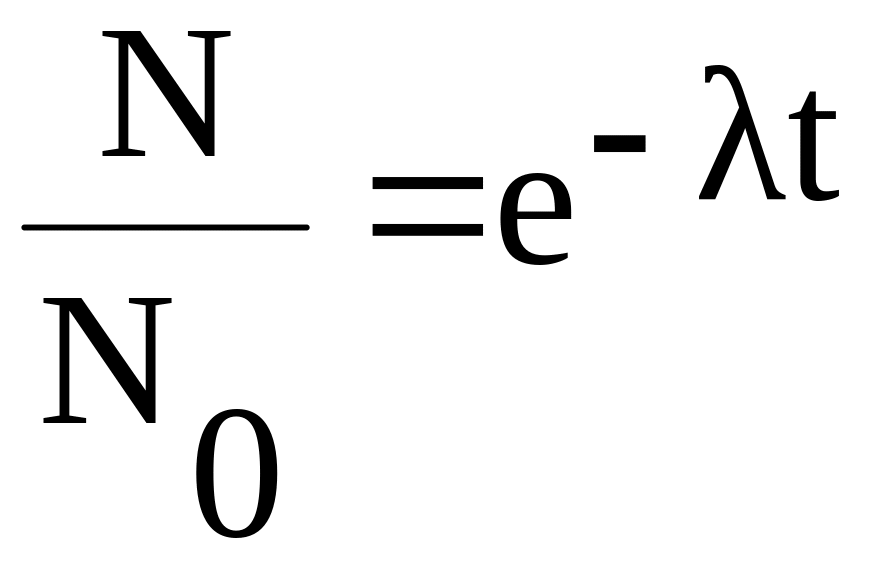
натуральным логарифмом в основании которого число e:
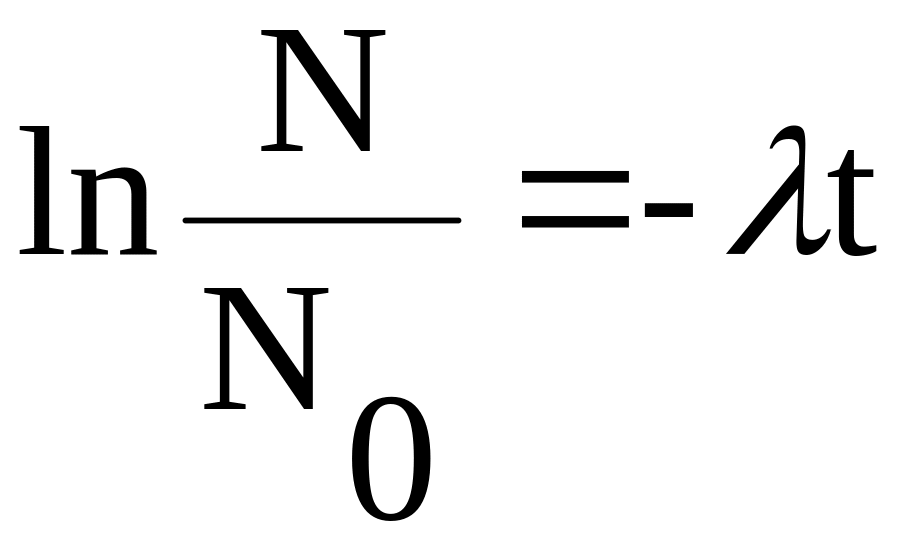 или
или
 (3)
(3)
Полученное представление закона радиоактивного распада является линейной зависимостью от времен t, а величина λ – характеризует угол наклона прямой к оси t. Такую зависимость анализировать гораздо легче и проще, чем экспоненциальную.
