
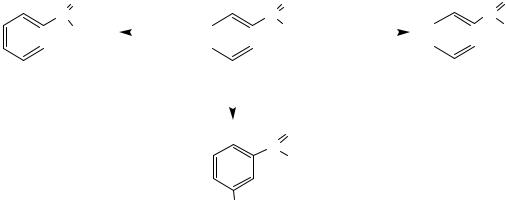
II. Реакции по ароматическому ядру
Реакции электрофильного замещения SEAr идут в мета-положение ароматического ядра в достаточно жестких условиях.
|
|
|
C O |
|
|
|
|
|
|
C O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
Cl2 |
|
|
|
|
|
|
C |
|
|||
|
|
|
OH |
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
OH |
+ HCl |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
600C |
|
|
|
|
|
|
FeCl3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
1500C, p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
олеум |
|
t0C |
|
|
|
Cl |
|
||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
м-нитробензойная кислота |
|
|
|
|
|
|
O |
|
м-хлорбензойная кислота |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C OH
SO3H
м-карбоксибензолсульфокислота, 3-сульфобензойная кислота
Бензойная кислота обладает бактериостатическими свойствами и используется в качестве консерванта (в пищевой и косметической промышленности), антисептика (в дерматологии). Бензойная кислота содержится во многих ягодах (больше всего в клюкве).
Соли натрия и аммония бензойной кислоты являются антисептиками. Сложные эфиры (метиловый, этиловый) содержатся в эфирных маслах иланг-иланга, туберозы, гвоздики, в толуанском и перуанском бальзамах. Фенилбензоат является фиксатором запаха (парфюмерные композиции), а также репеллентом.
260
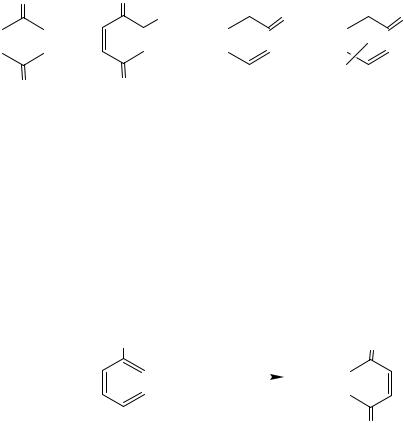
ХИНОНЫ
Хиноны – это α, β-непредельные циклические кетоны. Все хиноны являются ярко окрашенными кристаллическими веществами, что является следствием высокой степени сопряжения в их молекулах.
Номенклатура
|
|
O |
O |
|
|
O |
|
|
O |
||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
|
CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
п-бензохинон |
п-толухинон |
о-бензохинон |
о-толухиноны |
||||||||||||||||||
(золотисто-желтый) |
|
|
|
(ярко-красный) |
|
|
|
|
|
|
|
|
|||||||||
Методы получения
1.Окисление двухатомных фенолов, нафталина, антрацена, фенантрена.
2.Окисление анилина – это промышленный способ производства п- бензохинона.
NH2 |
|
O |
|||
|
|
Na2Cr2O7 |
|
|
|
|
H2SO4(p), 00C |
|
O |
||
|
|
||||
|
-H2O,-NH3 |
|
|||
Реакционная способность
Хиноны проявляют свойства α, β-непредельных кетонов, в том числе могут выступать в роли диенофилов.
261
OH |
|
|
|
|
O |
|
|
OH * |
|
|
|
|
|
OH |
|||||||||||
|
|
|
|
CH3COOH |
|
|
|
|
|
HCl |
|
|
|
|
|
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O- |
C-CH3 |
|
(через |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
промежуточное |
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||
OH O |
соединение типа ) |
O |
|
|
|
|
|
|
OH |
||||||||||||||||
|
|
|
|
|
2-хлор-1,4-диоксибензол, |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2,5-диоксифенил ацетат, |
|
|
|
|
|
|
|
|
|
|
|
|
хлоргидрохинон |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ацетоксигидрохинон |
|
CH OH |
(через промежуточное |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
3 |
|
соединение типа ) |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
OCH3
OH
2-метокси-1,4-диоксибензол, метоксигидрохинон
OH |
|
|
|
O |
|
|
|
|
|
|
NOH |
|||||||
|
|
|
H2 |
|
|
|
|
2 NH2OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 2 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
NOH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
OH |
|
|
|
|
|
|
|
|
|
|||||||||
гидрохинон |
|
|
|
|
|
|
|
|
диоксим п-бензохинона |
|||||||||
Биологически активные производные хинонов
К биологически активным производным хинонов относятся, например, витамин К1, регулирующий свертываемость крови. В мухоморах содержится мускаруфин, обеспечивающий их красный цвет мухоморов.
|
O |
|
|
|
||
O |
|
|
CH2 |
CH3 |
CH3 |
|
|
|
|||||
|
|
H |
C=C |
|
|
|
|
|
|
|
|||
|
|
|
CH2(CH2CH2 |
CH)2CH2CH2CH(CH3)2 |
||
COOH |
O |
витамин К1 |
|
|
||
CH=CH-CH=CH-COOH |
|
|
|
|
|
|
O |
|
|
|
|
|
|
COOH
мускаруфин
262

СУЛЬФОКИСЛОТЫ
В сульфокислотах ароматического ряда арен связан с сульфогруппой.
Номенклатура
O |
SO3H |
SO3H |
|
S O |
|||
OH |
|
|
|
|
CH3 |
OH |
|
бензолсульфокислота |
п-толуолсульфокислота |
о-фенолсульфокислота |
|
(бензолсульфоновая кислота) |
|||
(ПТСК) |
|
||
|
|
Основным методом получения аренсульфокислот (ArSO3H) является сульфирование с помощью концентрированной H2SO4 или олеумом (см. сульфирование аренов). Из реакционной массы ArSO3H выделяют и очищают с помощью солей, это дает возможность сместить равновесие вправо в обратимой реакции сульфирования. Кроме серной кислоты можно использовать хлорсульфоновую кислоту по следующей схеме:
ArH + ClSO3H →ArSO3H + HCl (реакция необратима)
|
Реакционная способность |
Аренсульфокислоты |
относятся к сильным кислотам, близким по |
кислотности к минеральным. Целью введения сульфогруппы в арены является увеличение растворимости в воде больших органических молекул. Аренсульфокислоты растворимы в воде лучше, чем большинство других органических соединений.
ArSO3H + Н2О → ArSO3−+ Н3О+ (полная ионизация в воде)
Аренсульфокислоты образуют производные, аналогичные производным карбоновых кислот.
|
PCl5 |
|
|
NaOH |
|
ArSO2Cl - POCl |
ArSO2OH |
- H2O ArSO2ONa |
|||
хлорангидрид |
3 |
|
|
|
натриевая соль |
- HCl |
|
|
|
||
|
Na2CO3 |
- CO2 |
|||
|
|
||||
|
|
|
- H2O |
||
|
|
|
|||
|
|
ArSO2ONa |
|||
263

|
|
|
|
|
|
|
ROH |
|
|
|
|
NH3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
ArSO2OR |
|
ArSO2Cl |
|
|
|
|
ArSO2NH2 |
|
|
|
|
|||||||
|
|
|
|
|
- HCl |
|
|
|
|
|||||||||||||
|
|
|
сульфонаты - HCl |
|
|
|
|
сульфонады |
|
|
|
|
||||||||||
|
|
|
(сложные эфиры) |
|
|
|
|
|
|
|
|
(амиды) |
|
|
|
|
||||||
|
|
CH |
|
|
OH |
|
|
NH2 |
|
|
|
|
CH3 |
|
|
CH3 |
||||||
|
|
3 SO Cl |
|
|
|
SO ONa |
|
|
|
SO2OCH3 |
|
|
|
SO2NH2 |
|
|
|
SO2NHCH3 |
||||
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлорангидрид |
о-фенолсульфо |
метил |
|
|
о-толуолсуль |
N-метил-о-толуол |
||||||||||||||||
о-толуолсульфо |
нат натрия |
о-аминобензол |
фонад |
сульфонад |
||||||||||||||||||
кислоты |
|
|
|
|
|
сульфонат |
|
|
(сульфамид) |
(сульфамид) |
||||||||||||
|
|
|
|
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
|
|||
В органических синтезах используется свойство сульфогруппы легко элиминироваться (десульфирование). Сульфогруппа может замещаться нуклеофилами (SN2Ar) и электрофилами (SEAr).
Примеры синтезов
|
|
SO3H |
2 Cl2 |
Cl |
SO3H H O |
|
Cl |
H |
||||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
|
||||||
HO |
|
|
|
HO |
|
|
100-1750C |
HO |
|
|||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
- H2SO4 |
Cl |
||||||||||
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,6-дихлорфенол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(недоступен при обычном |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C≡N |
хлорировании фенола) |
|||
|
|
|
SO3Na |
NaCN |
|
|
|
|
|
+ Na2SO3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SN2Ar |
||
|
|
|
|
|
2000C |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2000C |
|
|
|
|
|
|
нитрил 2-нафтилкарбоновой |
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||||
NaOH |
|
|
|
|
|
|
кислоты |
|
|
|
||||||||
|
|
|
OH |
+ Na SO |
SN2Ar |
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
β-нафтол
264

|
|
|
SO3H |
|
2HNO3 дым. |
NO2 |
|
|
2 k H2SO4 |
|
+ 2 H2SO4 |
||||
HO |
|
-2H2O |
|
|
(NO2) |
|
|
|
|
HO |
|||||
|
|
HO |
|
||||
|
|
|
SO3H |
|
SEAr |
NO2 |
|
|
|
|
|
(ипс-атака) |
2,4-динитрофенол |
||
АМИНОСПИРТЫ, АМИНОФЕНОЛЫ
Соединения алифатического или ароматического рядов, содержащие амино- и гидрокси-группы.
Номенклатура
NH2
HO-CH2-CH2-NH2
HO 
2(или β)-аминоэтанол (моноэтаноламин, коламин) о-, м-, п-аминофенолы
Коламин относится к биогенным соединениям, его N-триметильное производное – холин (нейромедиатор), ацилированное производное холина – ацетилхолин. Оба соединения участвуют в передаче нервного импульса.
Методы получения
CH2-CH2 |
|
NH3 |
|
|
HO-CH -CH -NH |
||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
2 |
2 |
2 |
||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SO3H |
2NaOH |
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
+ Na2SO3 + 2H2O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2000C |
|
|
|
|
|||
NH |
|
|
NH2 |
|
|
||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Приведены методы получения наиболее важных производных.
265
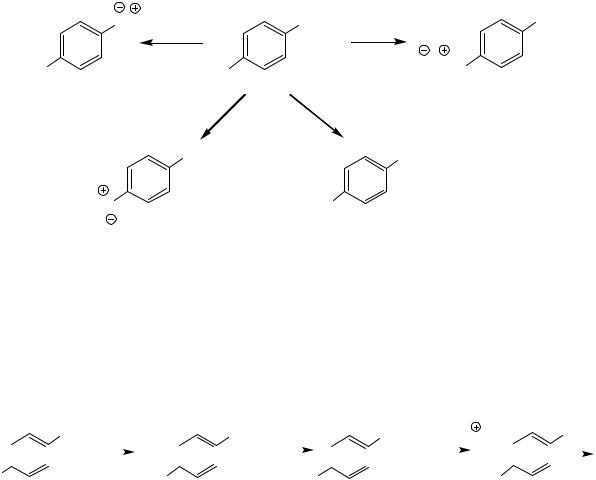
Реакционная способность п-аминофенола и синтез его производных, являющихся лекарственными препаратами
п-Аминофенол является амфотерным соединением и амбидентным нуклеофилом (нуклеофильные свойства аминогруппы выше таковых гидроксильной).
Примеры реакций
O Na |
NaOH |
OH |
HCl |
OH |
NH2 |
NH |
|
Cl NH3 |
|
|
2 |
|
|
|
п-аминофенолят натрия |
CH3I |
|
1м (CH3CO)2O |
гидрохлорид |
|
п-аминофенола |
|||
|
OH |
|
NHCOCH3 |
|
CH3NH2 |
|
HO |
|
|
I |
|
|
|
|
йодметилат |
|
|
N-(п-оксифенил)ацетамид, |
|
п-аминофенола |
|
парацетамол |
|
|
Синтез фенитидина, парацетамола, фенацетина
|
|
|
Cl |
C H OH |
|
|
|
OC2H5 |
Na |
S |
|
|
OC2H5 |
H O/H |
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
NaOH |
|
|
|
|
[H] |
|
|
- C2H5OH |
|
|
|
|
|
||||||
|
|
|
NO |
|
|
|
|
|
NH |
|||||||||||||||
|
|
|
|
(MnO2) |
|
|
|
NH |
|
|
|
|
|
|||||||||||
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
||||
SN2Ar
п-этоксианилин, фенитидин
266

OH
1 м (CH3CO)2O
CH3OC-NH
N-(п-оксифенил)ацетамид, парацетамол (панадол)
(CH3CO)2O
OC2H5
CH3OC-NH
N-(п-этоксифенил)ацетамид, фенацетин
Фенитидин, фенацетин и парацетамол относятся к жаропонижающим и анальгетическим средствам. По приведенным схемам эти соединения получают в фармацевтической промышленности.
АРОМАТИЧЕСКИЕ ОКСИКИСЛОТЫ (оксибензойные кислоты)
Ароматические одноосновные кислоты, содержащие одну и более оксигрупп, относят к ароматическим оксикислотам.
Номенклатура
|
|
OH |
|
|
OH |
|
|
|
OH |
|
|
COOH |
|||||||
|
|
|
|
COOH |
|
|
|
|
|
|
|
HO |
|
|
|
OH |
|||
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
о-оксибензойная |
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||
м-оксибензойная кислота |
п-оксибензойная кислота |
3,4,5-триоксибензойная |
|||||||||||||||||
кислота, |
|
|
|
|
|
|
|
|
|
|
кислота,галловая |
||||||||
салициловая |
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
||||||
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Методы получения
Методы получения салициловой и п-оксибензойной кислот приведены в теме “Фенолы”.
|
|
|
SO3H |
|
OH |
||
|
|
|
|
2NaOH |
|
+ Na2SO3 + H2O |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
2000C |
|
||
|
|
|
|
|
|
||
HOOC |
HOOC |
||||||
|
|
м-сульфобензойная кислота |
м-оксибензойная кислота |
||||
267

Реакционная способность
Для оксибензойных кислот характерны реакции по функциональным группам и ароматическому ядру.
Примеры реакций
|
|
|
|
|
C O |
|
PCl5 |
|
|
|
|
COOH |
|
|
|
|
COONa |
||
|
|
|
|
|
Cl |
|
|
|
|
|
изб.NaOH |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
HO |
или PCl3, |
|
|
|
|
- H2O |
|
|
|
|
|
||||||||
POCl3 |
HO |
|
NaO |
|
|
R-Hal или (R=алкил) |
|||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
t0C |
- CO2 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
хлорангидриды |
|
|
|
|
|
(CH3O)2SO2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
о-,м-, |
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
п-оксибензойных |
|
|
|
|
|
|
|
|
|
|
|
COOR (или CH3) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
кислот |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
RO |
или (CH3) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
о-,м-, п-оксифенолы |
|
|
|
|
|
||||||
сложные эфиры о-, м-, п-алкоксибензойные кислоты
Электрофильное замещение (нитрование, сульфирование, галогенирование) происходит преимущественно в орто- и пара-положения относительно гидроксильной группы, которая является сильным донором и предопределяет направление замещения.
|
OH |
|
Cl |
|
3 |
OH |
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|||||||
|
Cl2 |
|
2 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH3COOH |
4 |
|
|
|
1 |
+ |
|
|
|
|
|
||
|
|
5 |
|
|
|
|
|
|
|
|
|
||||
|
|
COOH |
|
6 |
COOH |
|
|
|
|
|
COOH |
||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Cl |
|||||
|
|
|
|
3-окси-4-хлорбензойная |
|
|
|||||||||
|
|
|
|
2-хлор-5-оксибензойная |
|||||||||||
|
|
|
|
|
|
|
кислота |
|
|
|
кислота |
||||
Биологически активные производные оксибензойных кислот
268

|
|
OH |
|
|
|
OCOCH3 |
|
|
|
OH |
O |
||||||||
|
|
|
|
COOH |
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OC6H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
о-оксибензойная, |
ацетилсалициловая |
фенилсалицилат, |
|||||||||||||||||
салициловая |
кислота, аспирин |
||||||||||||||||||
|
|
салол |
|
||||||||||||||||
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Салициловая кислота образуется в коре ивы, относится к антисептикам, использовалась при лечении подагры (отложение солей). Аспирин обладает жаропонижающим и анальгезирующим свойствами, а также антитромбозным действием. Салол использовался как антисептик при желудочно-кишечных отравлениях.
АРОМАТИЧЕСКИЕ АМИНОКИСЛОТЫ (аминобензойные кислоты)
Ароматические одноосновные кислоты, содержащие аминогруппу, относятся к ароматическим аминокислотам.
Номенклатура
|
|
NH2 |
|
|
NH2 |
|
|
|
NH2 |
||||
|
|
|
COOH |
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
||
|
|
|
|
|
|
|
|
|
|
|
|||
о-аминобензойная кислота, |
м-аминобензойная кислота |
|
|
|
|
||||||||
|
|
|
|||||||||||
п-аминобензойная кислота, |
|||||||||||||
антраниловая кислота |
|
|
|
|
|
|
|
|
|
(ПАБК) |
|||
Методы получения
Основным методом получения является восстановление орто-, мета-, пара- нитробензойных кислот.
COOH Fe + HCl |
COOH |
|
+ H2O |
NO2 |
NH2 |
Реакционная способность
Ароматические аминокислоты аналогично аминокислотам алифатического ряда являются амфотерными соединениями, но не образуют цвиттер-ионы. Причиной являются низкие кислотность карбоксильной группы и основность́ аминогруппы, за счет взаимного ослабления основных́ и кислотных свойств.
269
