
Решение примерного варианта КР анал
.docРЕШЕНИЕ ПРИМЕРНОГО ВАРИАНТА КОНТРОЛЬНОЙ РАБОТЫ №2
1. Растворением навески тетрабората натрия декагидрата массой 1,9112 г приготовили 100,0 мл раствора; на титрование 15,00 мл этого раствора пошло 17,50 мл раствора НСl. Вычислите молярную концентрацию НСl и титриметрический фактор пересчета по СаО.
Дано: m(Nа2В4О7∙10Н2О) = 1,9112 г
Vк = 100,0 мл = 100,0 ∙10-3 л
Vпип(Nа2В4О7) = 15,00 мл = 15,00 ∙10-3 л
V(НСl) = 17,50 мл =17,50 ∙10-3 л
______________________________________________
Найти: С(НСl), t(НСl/СаО)
Решение. 1. Определяем fэкв.(Nа2В4О7∙10Н2О).
Взаимодействие Nа2В4О7∙10Н2О с хлороводородной кислотой проходит по реакции:
Na2В4О7 + 2НСl + 5Н2О → 4Н3ВО3 + 2NаСl
А Т
fэкв.(Nа2В4О7·10Н2О) = fэкв.(Nа2В4О7) = ½.
Определяем молярную концентрацию эквивалента Na2В4О7
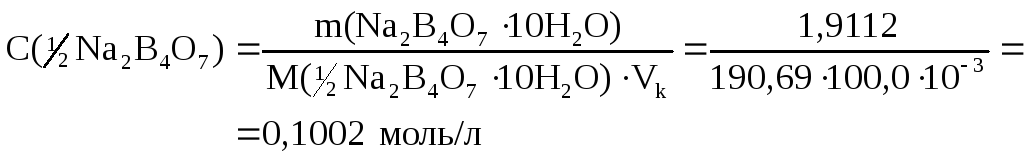
Определяем молярную концентрацию НСl. Используется прямое титрование, метод пипетирования (аликвот).
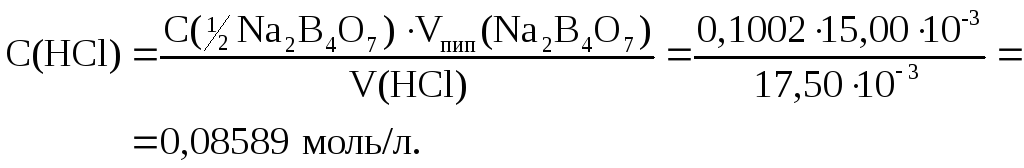
2. Рассчитываем титриметрический фактор пересчета.
СаО + 2НСl → СаСl2 + Н2О, fэкв.(СаО) = ½.
Х Т
![]()
Ответ: 0,08589 моль/л; 2,408·10-3 г/мл.
2. Навеску дихромата калия массой 0,1088 г растворили в разбавленной серной кислоте. К полученному раствору добавили избыток иодида калия. Вычислите молярную концентрацию тиосульфата натрия и титриметрический фактор пересчета по Сu2+, если на титрование выделившегося йода было израсходовано 20,88 мл титранта.
Дано: m(К2Сr2О7) = 0,1088 г
V(Nа2S2О3) = 20,88 мл = 20,88∙10-3 л
_____________________________________________________
Найти: С(Nа2S2О3); t(Nа2S2О3/Сu2+)
Решение. 1. Определяем С(Nа2S2О3).
Стандартизация раствора тиосульфата натрия по дихромату калия основана на восстановлении дихромат-ионов избытком КI по реакции:
Сr2О72– + 6 I– + 14 H+ → 2 Cr3+ + 3 I2 + 7 H2O.
A
Выделившийся йод оттитровывают раствором Na2S2O3 (заместительное титрование):
I2 + 2 S2O32– → 2 I– + S4O62–.
T
Полуреакция восстановления дихромат-ионов имеет вид:
Cr2O72– + 14 Н+ + 6 ē →2 Сr3+ + 7 H2O, fэкв. (К2Сr2О7) = 1/6,
а полуреакция окисления тиосульфат-ионов:
2 S2O32– – 2ē → S4O62-, fэкв.(Nа2S2О3) = 1.
Используется метод отдельных навесок, поэтому:
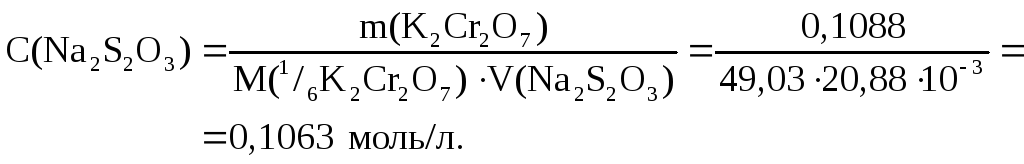
2. Рассчитываем t(Nа2S2О3/Сu2+).
Иодометрическое определение Сu2+ методом заместительного титрования основано на реакциях:
2 Сu2+ + 4 I– → 2 СuI + I2,
Х
I2 + 2 S2O32– → 2 I– + S4O62–.
Т
Полуреакция восстановления Сu2+ имеет вид
Сu2+ + I– + ē → СuI, fэкв.( Сu2+) = 1,

Ответ: 0,1063 моль/л; 6,755∙10-3 г/мл.
3. Навеску химически чистого хлорида натрия массой 0,1108 г оттитровали 18,75 мл раствора нитрата серебра. Вычислите молярную концентрацию титранта и титриметрический фактор пересчета по Вr–.
Дано: m(NаСl) = 0,1108 г
V(AgNO3) = 18,75 мл = 18,75∙10-3 л
__________________________________________________
Найти: С(AgNO3); t(AgNO3/Вr–)
Решение. 1. Уравнение реакции стандартизации:
NaCl + AgNO3 → АgСl + NаNО3,
A Т
fэкв.(NaCl) = fэкв.(AgNO3) = 1
Используется прямое титрование, метод отдельных навесок, поэтому
![]()
2. Уравнение реакции нитрата серебра с бромид-ионами:
Вr– + Ag+ AgВr, fэкв.( Вr–) = 1;
Х Т
![]()
Ответ: 0,1011 моль/л; 8,078∙10-3 г/мл.
4. Вычислите молярную концентрацию трилона Б и титр по Сo2+, если на титрование 15,00 мл раствора трилона Б расходуется 13,65 мл раствора сульфата магния, С(½МgSО4) = 0,1000 моль/л.
Дано: V(ЭДТА) = 15,00 мл
С(½МgSО4) = 0,1000 моль/л
V(МgSО4) =13,65 мл
______________________________________________
Найти: С(ЭДТА); t(ЭДТА/Сo2+)
Решение. 1. Уравнение реакции стандартизации:
Мg2+ + Y4- МgY2-
А Т
fэкв.(МgSО4) = fэкв.(Мg2+) = fэкв.(ЭДТА) = 1.
Титрование прямое, метод пипетирования, поэтому
![]()
Данную в условии задачи молярную концентрацию эквивалента сульфата магния надо перевести в С(МgSО4):
С(МgSО4) = ½ С(½МgSО4) = ½ ∙ 0,1000 = 0,05000 моль/л.
Рассчитываем С(ЭДТА):
![]()
2. Уравнение реакции титрования Сo2+:
Сo2+ + Y4- СoY2-
Х Т
fэкв.( Сo2+) = fэкв.(ЭДТА) = 1
![]() Ответ:
0,04550
моль/л; 2,681∙10-3
г/мл.
Ответ:
0,04550
моль/л; 2,681∙10-3
г/мл.
5. Навеску технического хлорида аммония массой 0,3197 г растворили в 100,0 мл раствора. К 20,00 мл полученного раствора добавили 25,00 мл раствора NaOH с концентрацией 0,09547 моль/л и смесь прокипятили до удаления аммиака. Избыток гидроксида натрия оттитровали 12,25 мл соляной кислоты, С(НСl) = 0,09976 моль/л. Вычислите массовую долю хлорида аммония в образце.
Дано: m* = 0,3197 г
Vk = 100,0 мл = 100,0·10-3 л
Vпип.(NH4Cl) = 20,00 мл = 20,00·10-3 л
V(NaОН) = 25,00 мл = 25,00·10-3 л
С(NаОН) = 0,09547 моль/л
V(НСl) = 12,25 мл = 12,25·10-3 л
С(НСl) = 0,09976 моль/л
_________________________________________
Найти: w (NН4Сl)
Решение. В ходе анализа проходят реакции:
NH4Cl +NaOH NH3 + NaCl +H2O,
Х Т1
fэкв(NH4Cl) = 1, fэкв(NaOH) = 1,
NaOH + HCl NaCl +H2O.
Т1 Т2
fэкв(HCl) = 1,
Определение проводится методом пипетирования, титрование обратное.
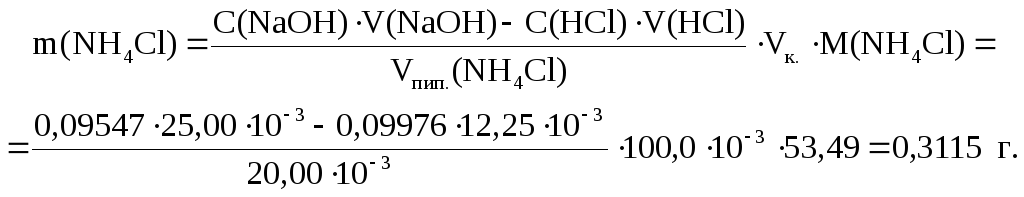
Определяем массовую долю NH4Cl в образце:
![]()
Ответ: 97,44%.
6. К раствору пероксида водорода добавили избыток иодида калия. Выделившийся йод оттитровали раствором тиосульфата натрия с молярной концентрацией 0,05009 моль/л. Определите массу пероксида водорода в растворе, если на титрование затрачено 17,12 мл титранта.
Дано: C(Na2S2O3) = 0,05009 моль/л
V(Nа2S2О3) = 17,12 мл = 17,12·10-3 л
__________________________________________________________________________________
Найти: m(Н2О2)
Решение. При титровании проходят следующие реакции:
1) Н2О2 + 6 I– + 14 H+ → 3 I2 + 7 H2O;
X
Н2О2 + 2H++ 2ē → 2H2О, fэкв.( Н2О2) = ½,
2 I– – 2ē → I2.
2) I2 + 2 S2O32– → 2 I– + S4O62–;
T
I2 + 2 ē → 2 I–,
2 S2O32– – 2ē → S4O62-, fэкв(Nа2S2О3) = 1.
Титрование иодометрическое заместительное. Рассчитываем массу пероксида водорода:
![]()
Ответ: 0,01459 г.
7. На титрование 15,00 мл раствора, содержащего нитрат серебра, пошло 12,55 мл раствора тиоцианата калия, Стеор.(КSСN) = 0,1000 моль/л (F0,1 = 1,003). Вычислите титр ионов серебра.
Дано: V(AgNO3) = 15,00 мл = 15,00·10-3 л
Стеор.(КSСN) = 0,1000 моль/л
F0,1 = 1,003
V(КSСN) = 12,55 мл = 12,55·10-3 л
___________________________________________________
Найти: Т(Ag+)
Решение. Реакция титрования:
AgNO3 + КSСN → АgSСN + КNО3
Ag+ + SСN– → AgSСN
Х Т
fэкв.(Ag+) = fэкв.(AgNO3) = fэкв.(КSСN) = 1.
Титрование тиоцианатометрическое, прямое. Рассчитываем массу ионов серебра в растворе:
m.(Ag+) = Стеор.(КSСN)·F0,1·V(КSСN)·M(Ag+) = 0,1000·1,003·12,55·10-3·107,87 = 0,1358 г.
Вычисляем титр ионов серебра:
![]()
Ответ: 9,053∙10-3 г/мл.
8. Навеску препарата лактата кальция [СН3СН(ОН)СОO]2Са массой 1,4657 г растворили в мерной колбе вместимостью 100,0 мл. 15,00 мл полученного раствора оттитровали раствором ЭДТА; на титрование затрачено 20,45 мл титранта с титриметрическим фактором пересчета по Са2+, равным 4,008·10-3 г/мл. Вычислите массовую долю ионов кальция в препарате.
Дано: m* = 1,4657 г
Vк = 100,0 мл = 0,1000 л
Vпип = 15,00 мл = 15,00·10-3 л
V(ЭДТА) = 20,45 мл = 20,45·10-3 л
t(ЭДТА/Са2+) = 4,008·10-3 г/мл
___________________________________________________
Найти: w(Са2+)
Решение. Лактат кальция в растворе диссоциирует:
[СН3СН(ОН)СОO]2Са Са2+ + 2 СН3СН(ОН)СОO–
Ионы кальция титруются ЭДТА:
Са2+
+ Y4-
СаY2-![]()
Х Т
fэкв.(Са2+) = fэкв.(ЭДТА) = 1
Титрование прямое, метод пипетирования, поэтому
m.(Са2+) = t(ЭДТА/Са2+)·V(ЭДТА)·103·Vк/Vпип =
= 4,008·10-3·20,45·10-3·103·0,1000 /15,00·10-3=0,5464 г.
Рассчитываем массовую долю ионов кальция в препарате:
![]()
Ответ: 37,28%.
9. Рассчитайте молярный коэффициент поглощения KMnO4, если пропускание раствора с C(КМnО4) = 1,14·10-4 моль/л на длине волны 528 нм в кювете с l = 1,00 см составило 53,5%.
Дано: C(КМnО4) = 1,14·10-4 моль/л
l = 1,00 см
λ = 528 нм
Т% = 53,5% или Т = 0,535
_____________________________________________________________________________________________
Найти: ε
Решение. Определяем оптическую плотность раствора
А = – lg T = – lg 0,535 = 0,272.
Вычисляем молярный коэффициент поглощения:
![]() моль-1·л·см-1
моль-1·л·см-1
Ответ: 2,40·103 моль-1·л·см-1
10. Навеску препарата витамина В12 массой 0,3197 г растворили в воде в мерной колбе вместимостью 250,0 мл. 15,00 мл этого раствора перенесли в мерную колбу на 200,0 мл и довели объем раствора до метки. Измеренная оптическая плотность полученного раствора при длине волны 361 нм и толщине слоя 2,00 см составила 0,425. Определите массовую долю витамина В12 в препарате, если удельный коэффициент поглощения чистого витамина В12 при = 361 нм равен 207.
Дано: m* = 0,3197 г
V1к = 250,0 мл
Vаликв. = 15,00 мл
V2к = 200,0 мл
λ = 361нм
l = 2,00 см
А = 0,425
![]() =
207
=
207
_____________________________________________________________
Найти: w (В12)
Решение. По значению удельного коэффициента поглощения определяем С% витамина В12 в фотометрируемом растворе:
С%
(В12)
= А / (![]() ∙l)
= 0,425/(207∙2,00) = 1,03∙10-3
г/100 мл.
∙l)
= 0,425/(207∙2,00) = 1,03∙10-3
г/100 мл.
Рассчитываем массу витамина В12 в фотометрируемом растворе:
m2к(В12) = С% (В12)∙V2к /100 = 1,03∙10-3 ∙200,0 /100 =
= 2,06∙10-3 г.
Рассчитываем массу витамина В12 в исходном растворе:
m1к (В12) = m2к(В12)∙V1к/Vаликв = 2,06∙10-3 ∙250,0/15,00 = 0,0343 г.
Находим массовую долю витамина В12 в препарате:
w (В12) = m1к(В12) / m* = 0,0343/0,3197 = 0,107.
Ответ: 0,107.
11. Никель(II) из водного раствора объемом 100,0 мл экстрагируют в виде диметилглиоксимата хлороформом и объем экстракта доводят до 20,0 мл. Из полученного раствора аликвоты объемом 5,00 мл фотометрируют методом добавок. Рассчитайте массу никеля(II) в растворе, если оптические плотности экстрактов с добавкой 20 мкг никеля и без нее равны соответственно 0,48 и 0,23. Дано: Vводн.р-ра = 100,0 мл
Vэкстракта =20,0 мл
Vаликв =5,00 мл
mдоб(Ni2+) = 20 мкг
Ах = 0,23;А1 = 0,48
_____________________________________________________________
Найти: m(Ni2+)
Решение: Рассчитываем массу никеля(II) в фотометрируемом растворе:
m*(Ni)=![]() .
.
Рассчитаем массу Ni в исходном растворе, учитывая, что масса никеля в исходном водном растворе равна массе никеля в экстракте.
m(Ni)=![]()
Ответ: 72 мкг
12. Определение алюминия проводят по интенсивности люминесценции его соединения с красителем кислотный хром-сине-черный. Анализируемый раствор перенесли в мерную колбу вместимостью 25,00 мл, прибавили раствор кислотного хром-сине-черного и довели объем до метки. Интенсивность люминесценции полученного раствора равна 65. Интенсивность люминесценции стандартного раствора, содержащего в 50,0 мл 5,0 мкг Al, равна 75. Определите массу алюминия в анализируемом растворе.
Дано: Vк = 25,00 мл
Iem х = 65
m(Al) = 5,0 мкг
Vст р-ра = 50,0 мл
Iem ст = 75
_____________________________________________________________
Найти: m(Al)
Решение: Рассчитываем титр алюминия в стандартном растворе:
Т(Al)ст = m(Al) / Vст р-ра = 5,0 /50,0 = 0,10 мкг/мл.
Определяем титр алюминия в фотометрируемом растворе по формуле для метода одного стандарта:
Тх(Al) = Тст (Al)∙Iem х / Iem cт = 0,10∙65/75 = 0,087 мкг/мл.
Рассчитываем массу алюминия в анализируемом растворе: m(Al) = Tх(Al)∙Vк = 0,087∙25,00 = 2,2 мкг.
Ответ: 2,2 мкг.
