
Практикум Коллоидные ПАВ
.pdfТема 2. МИЦЕЛЛЯРНЫЕ РАСТВОРЫ ПАВ
Напомним, что к поверхностно-активным веществам /ПАВ/ относятся органические вещества, молекулы которых дифильны (амфифильны). ПАВ это спирты, амины, органические кислоты и их соли, в молекулах которых присутствует полярная группа ( NН2 , ОН, СООН, COONa, =OSO3Na и т.д.) и неполярный углеводородный радикал СН3 (СН2)n … = R). Полярная группа сообщает молекуле гидрофильные свойства и определяет ее способность растворяться в воде или в других полярных растворителях. Углеводородный радикал проявляет гидрофобные свойства, обеспечивая растворимость ПАВ в углеводородах (неполярных растворителях).
Все поверхностно-активные вещества можно разделить на две группы:
1.Истинно растворимые в воде ПАВ. Полярные группы этих молекул недостаточно гидрофильны, а углеводородные радикалы невелики. При любой концентрации они находятся в виде молекулярного раствора.
2.Коллоидные ПАВ. Их молекулы обладают полярными группами высокой гидрофильности и большими углеводородными радикалами (число атомов
углерода nС больше 10). У коллоидных ПАВ небольшая растворимость (10 5 10 3 моль/л) и высокая поверхностная активность. К коллоидным ПАВ относятся соли жирных кислот (мыла), некоторые красители, синтетические ПАВ и др.
Различают четыре типа коллоидных ПАВ: 1) неионогенные, т.е. недиссоциирующие, ионогенные, т.е. диссоциирующие ПАВ, которые могут быть анионактивные (2), например, мыла RCOOM RCOO + M+ , и катионактивные (3), например, соли аминов [RN+H3]Cl и амфотерные ПАВ (4), к ним относятся алкиламинокислоты RNH2COOH.
При концентрациях, превышающих некоторую критическую концентрацию, которая называется критической концентрацией мицеллообраэования (ККМ), растворы ПАВ приобретают коллоидный характер вследствие образования ассоциатов молекул (мицелл). Поэтому коллоидные растворы ПАВ называют мицеллярными или ассоциативными растворами.
Простейшие мицеллы сферической формы состоят из 50-100 молекул. Диаметр мицеллы близок к удвоенной длине молекулы (d = 10 7 10 5см).
С ростом концентрации ПАВ при условии, что С > ККМ наряду с увеличением концентрации сферических мицелл постепенно происходит и изменение их формы с повышением числа молекул ПАВ в мицелле.
1
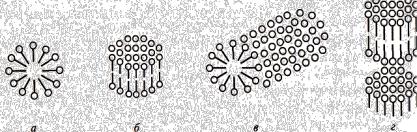
Мицеллы можно рассматривать как одномерные, двумерные и трехмерные нанообъекты. В зависимости от природы ПАВ число молекул в мицелле с ростом концентрации увеличиваются от десятков до нескольких сотен, при этом изменяются и размеры мицелл. Число молекул, составляющих мицеллу, называется числом ассоциации, а произведение числа ассоциации на молекулярную массу молекулы ПАВ – мицеллярной массой.
 д
д
Рис.2.1. Формы мицелл коллоидных ПАВ.
прямые мицеллы в полярном растворителе сферические (а), дискообразные (6), цилиндрические (в), пластинчатые (г));
обратные мицеллы в неполярном растворителе (пример сферической мицеллы д)
В водном растворе (вода – полярный растворитель) образуются прямые мицеллы, в которых гидрифильные головки обращены к среде, а гидрофобные хвосты образуют неполярное ядро мицеллы, как показано на рис. 2.1а. В неполярном растворителе образуются обращенные или обратные мицеллы с противоположным расположением молекул ПАВ (рис.2.1 д). Ядро в таких мицеллах полярное. Изменение формы мицелл (эволюция) при увеличении концентрации раствора происходит в последовательности превращения сферических мицелл в анизометричные мицеллы различной формы эллипсоидальная (дискообразная)
цилиндрическая ленточная, пластинчатая (ламеллярная), как это показано на рис.2.1 а-в. Эти превращения обратимые. Затем раствор ПАВ превращается в гель, потом в жидкие кристаллы с упорядоченным расположением молекул. При дальнейшем уменьшении содержания воды (увеличении концентрации ПАВ до значений больше ККМ в десятки раз) образуются твердые кристаллы.
Гель – структурированная жидкость, состоящая из молекул ПАВ встроенных в сетку с характерными механическими свойствами (пластичность, прочность, тиксотропия).
Тиксотропией называется равновесный переход коллоид гель.
Жидкие кристаллы (ЖК) – это особое фазовое состояние вещества с проявлением свойств как жидкости (текучесть), так и кристаллов (анизотропия). В
2
начале своей истории жидкие кристаллы (были открыты в 1890 г.) относили к коллоидным системам, поскольку именно пластинчатые мицеллы ПАВ с характерным упорядоченным расположением молекул проявляли указанные двойственные свойства. В ЖК состояние переходят вещества с дифильными молекулами, но при определенных условиях. Под воздействием электрических полей в жидком кристалле изменяется ориентация молекул, а при поворотах они по-разному пропускают и отражают свет. Применение жидких кристаллов для отображения информации в дисплеях началось только после 1970 года.
Мы уже отмечали, что различным состояниям системы отвечают равновесия
молекулярный раствор ПАВ мицеллярный раствор ПАВ гель ПАВ.
Термодинамика. Мицеллы ПАВ образуются самопроизвольно и система остаѐтся термодинамически равновесной, т.е. устойчивой.
Термодинамическая устойчивость прямых мицелл связана с тем, что контакт гидрофобных неполярных групп ПАВ с водой уменьшается из-за формирования углеводородного ядра, экранированного полярными группами ПАВ и их гидратными оболочками. В случае ионогенных ПАВ вокруг мицеллы образуется двойной электрический слой и взаимодействие таких мицелл носит электростатический характер. В неполярных растворителях (обращенные мицеллы) ориентация молекул ПАВ противоположная, как видно из рисунка 2.1 б: углеводородные хвосты обращены в сторону родственной им неполярной среды.
Самопроизвольный процесс мицеллообразования при постоянной температуре Т связан с понижение энергии системы.
Изменение энергии Гиббса ∆GМ согласно основному уравнению термодинамики имеет вид
∆GМ = ∆HМ – Т∆SМ |
(2.1), |
где ∆HМ тепловой эффект, ∆SM – изменение энтропии системы при образовании |
|
мицелл ПАВ. Мицеллообразование в водной среде |
имеет энтропийную природу: |
∆GМ |
– Т∆SМ < 0, поскольку ∆HМ 0. Увеличение энтропии всей системы ∆SM = |
S2 S1 |
> 0 при переходе от истинного раствора (1) к мицеллярному (2) связано с |
доминирующим ростом энтропии («хаосом») молекул растворителя, тогда как
«хаос» молекул ПАВ, образующих ассоциат, уменьшается. |
В отличие от водной |
||
среды мицеллообразование в неполярной среде |
имеет |
не энтропийную, а |
|
«силовую» природу. Энергетический |
выигрыш |
от объединения полярных |
|
групп очень велик, поэтому образование обратных мицелл наблюдается уже при низких концентрациях ПАВ.
3
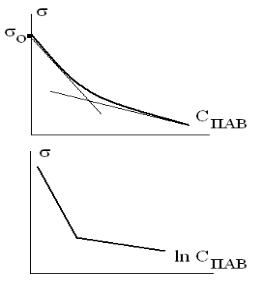
Критическая концентрация мицеллообразования.
Появление в растворе ПАВ мицелл происходит при концентрации, которая называется критической концентрацией мицеллообразования (ККМ). Переход молекул ПАВ в ассоциативное состояние при С=ККМ резко изменяет объемные и поверхностные свойства раствора: на зависимостях «свойство-концентрация ПАВ» появляется излом (рис.2.2). На опыте определяются такие характеристики раствора как поверхностное натяжение , мутность , показатель преломления n, осмотическое давление , электропроводность (только у ионогенных ПАВ) и т.д. Существуют десятки методов определения ККМ. «Чувствительность» разных методов к появлению в растворе мицелл разная, поэтому говорят об области ККМ. Комплекс методов позволяет надежнее установить значение ККМ.
а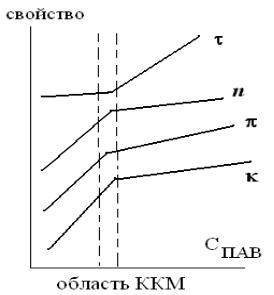 б
б
Рис.2.2. Графическое определение ККМ
Факторы, влияющие на ККМ.
Значение ККМ зависит от температуры, природы ПАВ, наличия других веществ, особенно электролитов. Влияние этих факторов выражают формулы 1 и 2, полученные из термодинамического анализа мицеллообразования:
(2.2)
где а характеризует энергию растворения полярных групп ПАВ, b энергию растворения, приходящуюся на одну СН2-группу, n число СН2-групп. Знак « » относится к полярному растворителю (прямым мицеллам), а знак «+» неполярному растворителю (обратным мицеллам).
4
Влияние введения электролитов в водный раствор коллоидного ПАВ
описывается формулой RT ln ККМ а` b`n k ln C |
(2.3), |
||
где С концентрация индифферентного электролита, а`иb` |
|
постоянные, |
|
имеющие тот же физический смысл, что и в уравнении |
(1), |
k |
- константа. |
Присутствие электролитов снижает ККМ водных растворов коллоидных ПАВ. Уменьшение ККМ и увеличение мицеллярной массы ионогенных ПАВ
наблюдается в ряду противоионов М+ = Na+ < K+ < Cs+ анионактивных ПАВ и анионов Cl < Br < I в случае катионактивных ПАВ при одинаковой гидрофобной части молекулы. Это связано с различной гидратацией протиивоионов одного заряда и разного размера, окружающих мицеллу (лиотропные ряды ионов).
Влияние природы ПАВ также очень существенное: у ионогенных ПАВ значения ККМ = 10 2 10 3 моль/л, для неионогенных ККМ =10 4 10 5 моль/л, то есть значения различаются в 100-1000 раз.
Повышение температуры препятствует ассоциации молекул ПАВ. В то же время тепловое движением молекул уменьшает гидратацию полярных групп ионов ПАВ. Поэтому влияние температуры на ККМ сложное. В случае
неионогенных ПАВ с ростом температуры ККМ снижается.
Для коллоидных ПАВ также можно определить поверхностную активность, используя значения ККМ. В случае неионогенных ПАВ она рассчитывается по
формуле g 0 ККМ / ККМ (2.4).
Солюбилизация.
Солюбилизация включение в состав мицелл другого компонента,
нерастворимого в дисперсионной среде. Различают прямую союбилизацию (в |
|
водных дисперсиях ПАВ) и обратную солюбилизацию (в углеводородных |
|
средах). В первом случае, |
гидрофобное ядро прямой мицеллы «растворяет» |
неполярные вещества, а |
во втором, в гидрофильном ядре мицеллы |
концентрируются полярные вещества. Эти вещества называются |
|
солюбилизатами, а коллоидные ПАВ солюбилизаторами. |
Количественно |
||
солюбилизацию отражает отношение |
s nПАВ / nмицПАВ |
(2.5), где n ПАВ |
|
число молей солюбилизата, nмицПАВ |
число молей ПАВ, |
находящегося |
в |
мицеллярном состоянии. Величина s зависит от формы мицеллы, температуры и природы солюбилизата. Так, в расчете на 1 моль олеата натрия при 6-200С
сферические мицеллы солюбилизируют 0,5 моль октана и 1,2 моль циклогексана.
5

Солюбилизация – самопроизвольный процесс, сопровождающийся убылью свободной энергии. При концентрациях выше ККМ в ядре мицелл концентрируются вещества соответствующей полярности, поэтому солюбилизацию еще называют внутримолекулярным растворением.
Явление солюбилизации играет важную роль в биологии и технике. Сферические бислойные мицеллы липосомы, образующиеся в системе водафосфолипид, обеспечивают в организме транспорт веществ-солюбилизатов. Липосомы обладают универсальной солюбилизацией: в ядре концентрируются молекулы воды, а в слое углеводородных радикалов (липидный слой) концентрируются неполярные вещества.
Мицеллярные растворы применяются для увеличения нефтедобычи, в эмульсионной полимеризации, для регенерации почв, как «упаковка» лекарств, Новым направлением является мицеллярный катализ (мицелла нанореактор).
Основное использование ПАВ – производство синтетических моющих средств. Механизм моющего действия включает и явление солюбилизации. Моющее действие ПАВ можно иллюстрировать рисунком 2.3 б.
 б
б
а popnano.ru
Рис.2.3. Бислойная мицелла – липосома (а) и моющее действие ПАВ (б)
Моющее действие ПАВ базируется на следующих факторах:
1.ПАВ снижает поверхностное натяжение воды;
2.ПАВ улучшает смачивание поверхности загрязненных предметов и проникновение раствора в узкие каналы (капилляры) ткани;
3.Очистка от неполярного вещества (масляных загрязнений) происходит за счет солюбилизации, моющее действие коллоидных ПАВ проявляется только при концентрациях выше ККМ.
4.Образующаяся пена удаляет загрязнения за счет флотации.
6
Работа 2. ОПРЕДЕЛЕНИЕ ККМ АНИОНАКТИВНОГО ПАВ
Цель работы определить критическую концентрацию мицеллообразования (ККМ) олеата натрия на основании концентрационных зависимостей электропроводности, мутности и показателя преломления его растворов. Cоли карбоновых кислот общей формулы R COOM, где М = Na, K, а углеводородный радикал R = CnH2n+1с числом атомов углерода n от 15 до 18 называют мылами. При диссоциации (распаде на ионы) молекулы R COOM R COO + М+ образуется ПАВ-анион R COO и катион М+, его называют противоионом.
Молекулярная масса олеата натрия
С17Н33COONa – 304 г/моль Плотность 1,2 г/см3 Температура плавления – 232-235 0С
Внешний вид – светло-желтые кристаллы
Порядок работы:
1. Приготовление растворов олеата натрия.
а). Для приготовления рабочих растворов, концентрации которых указаны в табл.2, используется 0,01 М раствор олеата натрия C17H33COONa. Рассчитайте навеску олеата натрия для приготовления 300 мл 0,01 М раствора. Расчет записать в тетради. Раствор готовит лаборант или учебный ассистент.
б). Рассчитайте и запишите в таблицу 2 концентрации растворов, приготовленных разбавлением исходного 0,01 М раствора олеата натрия. Константа разбавления вычисляется по формуле 2.5, концентрация раствора по формуле 2.6. Суммарный объем каждого раствора 50 мл.
|
|
|
V V0 |
|
|
С0 |
|
0,01 |
|
|
100 |
|
||
K |
разб |
|
(2.6); |
С |
|
(2.7) |
|
ln |
|
|
||||
|
|
|
|
|||||||||||
|
|
|
||||||||||||
|
|
V |
|
К разб |
|
К разб |
|
T % |
|
|||||
|
|
|
|
|
|
|
x |
(2.8) |
||||||
V – объем исходного |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
раствора, V0 – объем воды |
|
|
|
|
|
x толщина кюветы |
||||||||
в). Измерить электропроводность (каппа), коэффициент пропускания Т% и показатель преломления n десяти растворов. Рассчитать по значениям Т% мутность (тау) по формуле 2.7. Указать размерности величин.
Все измерения проводят в порядке увеличения концентрации растворов.
7

Удельную проводимость определяют с помощью кондуктометра с электродом и датчиком температуры. Значения на табло в микроСименсах. Размерность 1 Сименс = 1 Ом 1. После кондуктометрических измерений те же растворы используют для измерения оптических характеристик – это коэффициента пропускания на фотометре/нефелометре и показателя преломления на рефрактометре. Рабочая длина волны на фотометре установливается в диапазоне значений от 500 до 540 нм (указывает преподаватель).
Таблица 2.
Приготовление рабочих растворов и их характеристики
Навеска олеата натрия ……… г Объем приготовленного исходного раствора …….. мл Температура растворов – ……о С
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
V раствора ПАВ, мл |
5 |
10 |
15 |
|
|
|
|
|
45 |
50 |
|
|
|
|
|
|
|
|
|
|
|
V0 воды, мл |
45 |
40 |
35 |
|
|
|
|
|
5 |
0 |
К разбавления
Концентрация С, моль/л
Проводящие и оптические свойства растворов ПАВ
Электропроводность
, ____________
Коэффициент пропускания, Т%
Мутность
, ___________
Показатель преломления, n
Для определения поверхностного натяжения растворов можно использовать и тензиметрический метод (прибор Ребиндера). Описание этого метода было в лабораторной работе №1. В отличие от измерения поверхностного натяжения растворов изопропилового спирта при работе с водными растворами олеата натрия определение осложняется образованием пены, что увеличивает ошибку нахождения ККМ.
8
2. Графическое определение ККМ. Построить графики концентрационных зависимостей , и n. По точкам излома определить ККМ. Значения могут не совпадать, поэтому говорят об области ККМ.
В кондуктометрическом и тензиметрическом методах можно использовать логарифмические координаты, например, зависимости ln С или билогарифмические координаты ln ln С. На графике ln С значение ln ККМ определяется по точке пересечения двух прямых. Выбор логарифмической шкалы концентраций (см. работу №1) связан с тем, что в области средних концентраций ПАВ выполняется уравнение Шишковского
0 a bln C .
Изменение хода полученных зависимостей в интервале концентраций, включающем ККМ, отражает переход молекулярного раствора ПАВ в коллоидное состояние. Например, ниже ККМ удельная электропроводность растворов ионогеных ПАВ возрастает с ростом концентрации в результате увеличения количества диссоциированных молекул ПАВ в растворе. При концентрациях выше ККМ градиент удельной электропроводности (тангенс угла наклона от С) уменьшается, так как мицеллы, которые обладают малой подвижностью.
Используя графики, запишите вывод работы.
Вопросы для самоконтроля.
1.В чем заключаются характерные признаки коллоидных ПАВ? В чем различие термодинамики образования прямых и обратных мицелл?
2.Нарисуйте анизометричную мицеллу ПАВ в растворителях различной полярности. При каких условиях образуется гель ПАВ и жидкие кристаллы?
3.Почему на графиках «свойство раствора – концентрация ПАВ» в точке ККМ наблюдается излом? Объясните полученные зависимости.
4.Как влияет природа ПАВ, температура, и наличия электролитов на значение ККМ мыла? Сравните ККМ олеата натрия и олеата калия, используя последовательность ионов в лиотропном ряду.
5.Нарисуйте прямую и обратную мицеллы с солюбилизатом. Какие это вещества?
6.Объясните проявление солюбилизации в моющем действии олеата натрия.
7.Какие существуют экологические проблемы, связанные с широким
использованием ПАВ ? Какое влияние ПАВ оказывают на живые организмы?
9
