
Практикум ФизХим Кинетика. Катализ Михаленко 2018
.pdf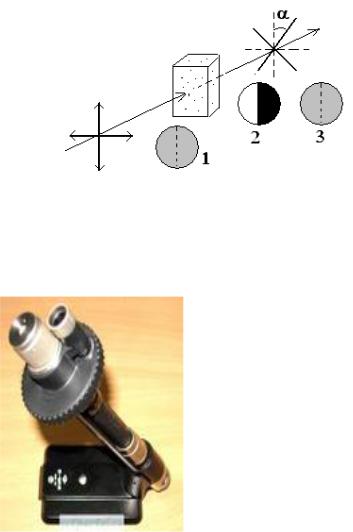
Измерения углов вращения проводят на приборе, который называется поляриметр или сахариметр (рис.2.3).
Рис. 2.2. Вращение плоскости поляризации света при прохождении через оптически активное вещество: 1 поле окуляра до введения пробы, 2 – после введения
пробы, 3 – после компенсации
|
В |
основе |
поляриметрии |
||
лежит |
линейная |
связь |
между |
||
углом |
вращения |
|
и |
||
концентрацией С: |
|
|
|||
|
|
|
|
||
|
[ ] C L |
(2.5) |
|
||
|
|
|
|
|
|
Угол вращения зависит от
-типа вещества, имеющего характерный угол вращения;
-концентрации оптически активного вещества C [г/мл] ;
-длины оптического пути L, (выражена в дециметрах).
Рис. 2.3. Полутеневой поляриметр и его схема
53
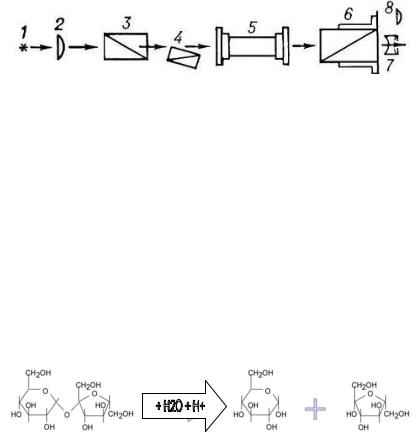
Свет, поступающий от источника (1), проходит через конденсор (2) и потом плоско-параллельный пучок света проходит через полутеневой поляризатор (3,4). Поляризованный свет затем проходит через кювету с измеряемым оптически-активным веществом (5). Анализатор с отсчетным устройством (6) позволяет определить угол вращения поляризованного света через окуляр прибора (7).
Гидролиз или инверсия сахарозы протекает в кислой водной среде (кислотный катализ) согласно уравнению реакции:
С12Н22О11 + Н2О = С6Н12О6 |
|
+ С6Н12О6 |
|
сахароза |
глюкоза |
|
фруктоза |
[ ] = + 66,56 о |
[ ] = + 52,5 |
о |
[ ] = 91,9 о |
Гидролиз сахарозы бимолекулярная реакция, но еѐ скорость подчиняется кинетическому уравнению реакции первого порядка, поскольку вода находится в избытке, т.е. реакция является псевдомономолекулярной. Для расчета константы скорости реакции используют логарифмическую форму уравнения 1.6. Начальную и текущую концентрацию вещества С0 и С можно выразить через угол вращения .
Начальный угол вращения рассчитывается по формуле
0 |
|
0 ` |
Vc |
|
(2.6) ,где дробь – это объемная доля |
V V |
|
||||
|
|
|
c |
к |
|
|
|
|
|
54 |
|

сахарозы, которая рассчитывается через объемы растворов сахарозы Vс и кислоты Vк . Значение 0 `измеряют на опыте.
Для нахождения угла вращения , соответствующего
концу реакции (t ), требуется много времени, но его можно рассчитать через молекулярные массы М и удельные углы вращения [ ] глюкозы, фруктозы и сахарозы
0 |
|
[ ]гл М |
гл [ ]фр |
М фр |
(2.7`) |
. После подстановки |
[ ]c M c |
|
|||||
|
|
|
|
|
||
0,3110 |
(2.7) . |
Логарифмическая форма уравнения |
||||
(1.6) преобразуется в формулу (2.8), пользуясь которой можно рассчитать константу скорости реакции k
C0 |
|
0 |
|
|
||
|
|
|
|
|
|
kt (2.8) . |
ln |
|
|
||||
ln |
t |
|
||||
C |
|
|
|
|
||
Порядок выполнения работы.
1). Научитесь работать с поляриметром. Заполните кювету водой до образования выпуклого мениска. Накройте стеклышком так, чтобы под его поверхностью не образовался пузырек воздуха. Завинтите крышку кюветы. Осушите кювету фильтровальной бумагой и при необходимости протрите стекла, закрывающие ее концы. Поместите кювету в поляриметр. Добейтесь с помощью зеркала поляризатора хорошей освещенности зрительного поля окуляра (при недостатке света в помещении воспользуйтесь лампой). Найдите положение анализатора, при котором освещенность обоих полей окуляра одинаковая. При правильной компенсации отсчет показаний по шкале нониуса должен дать величину 0.
3). Научитесь снимать показания углов вращения. При повороте анализатора по часовой или против часовой стрелки «картинка» на зрительном поле изменится (на середине круга появится четкая граница двух половинок.
55
Отсчет показаний по шкале нониуса: на неподвижной верхней шкале нанесено 20 делений вправо (+20) и влево (20) с ценой деления 1о. На подвижной нижней шкале с обеих сторон от нуля нанесено по 10 делений с ценой деления 0,1о. Пример отсчета показаний показан ниже. По верхней шкале берут целые значения, по нижней – десятые градуса для совпадающих рисок обеих шкал.
4). Замените воду в кювете на раствор сахарозы. Поместите кювету в поляриметр. При этом равномерная освещенность обеих частей поля нарушится. Вращением анализатора добейтесь равной освещенности полей. Произведите отсчет показаний 0' три раза. Возьмите среднее значение и сравните его с рассчитанным по формуле (2.5): для С=0,3 г/мл, L=0,9 дм мы получим ` = +18о.
5). Приготовьте реакционную смесь. Для этого к 10 мл сахарозы добавьте 2 мл кислоты. В момент смешения включите секундомер. Этому моменту соответствует начальный угол вращения 0. Перелейте смесь в кювету поляриметра. Запишите первое показание через две минуты и далее снимайте и записывайте в табл.1.5 показания t в течение 20 минут с интервалом 2 минутs. Они уменьшаются от значения 0 = + 15о, т.к. объемная доля сахарозы 10/12=0,77. По ходу реакции значение угла вращения проходит через нулевое значение и становится отрицательным, поэтому реакцию называют инверсией (обращением) сахарозы.
6). Запишите расчеты начального угла вращения для реакционной смеси 0 и конечного угла вращения (используйте формулы 2.6 и 2.7). Рассчитайте разности 0(константа), t (уменьшается во времени), и логарифм их отношения (увеличивается), а также значения константы скорости реакции, используя формулу 2.8. Найдите среднее значение k.
56

|
|
|
0 |
|
|
|
|
7). Постройте график зависимости |
ln |
|
|
|
от времени |
||
|
|
|
|
||||
|
|
t |
|
|
|
|
|
|
|
|
|
||||
реакции t. Определите, является ли полученная зависимость линейной. О чем это свидетельствует?
Таблица 1.2.
Определение константы скорости инверсии сахарозы поляриметрическим методом
Время |
|
|
|
0 |
|
|
k |
|
t |
t |
|
ln |
|
|
|
|
|
|
|
|||||||
мин. |
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
||
5 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
14 |
|
|
|
|
|
|
|
|
16 |
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
Среднее значение kср |
= … , по графику k = … |
|
||||||
Период полупревращения t1/2 = …
8). Рассчитайте тангенс угла наклона кинетической зависимости гидродиза сахарозы, представленной в полулографмических координатах.
9). Сравните константы скорости инверсии сахарозы, полученные графическим и аналитическим методами. Укажите размерность константы. Рассчитайте период полупревращения по формуле 1.6`.
10). Запишите вывод работы.
57
Вопросы перед началом работы
1.Какие вещества обладают оптической активностью?
2.Чем являются ионы водорода в данной реакции: реагентом или катализатором?
3.Что называют удельным углом вращения?
4.Почему в формуле (1.21) начальная концентрация сахарозы равна С0 = 0 , а текущая Сt = t .
5.Каков порядок выполнения работы?
Вопросы перед защитой работы
1.Почему реакция гидролиза сахарозы является мономолекулярной?
2.Каков физический смысл константы скорости реакции?
3.Как будет изменяться константа скорости реакции при уменьшении концентрации ионов водорода?
4.Объясните смысл периода полупревращения и, какие данные нужно знать для его определения?
5.Укажите ассиметрические атомы в структуре гексоз.
58

Лабораторная работа 3
ИЗУЧЕНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РАЗЛОЖЕНИЯ КОМПЛЕКСНОГО ИОНА МЕТОДОМ ФОТОМЕТРИИ
Цель работы определить константу скорости разложения комплексного оксалата марганца при двух температурах и вычислить энергию активации и энтропию активации реакции.
Изучаемая реакция является реакцией первого порядка
Mn C2O4 3 3 Mn2 52 C2O4 2 CO2
Ввиду того, что комплексный ион марганца окрашен, а продукты его разложения бесцветны, для изучения реакции удобно использовать фотометрический метод.
Согласно основному закону фотометрии – закону Бугера-Ламберта-Беера оптическое поглощение A (Absorption) прямо пропорционально его концентрации С
|
|
|
А C x |
(2.9) , |
|
здесь х толщина слоя раствора, через который проходит свет (обычно кюветы с х=1 см), коэффициент поглощения, зависящий от природы растворенного вещества и растворителя. В случае, если концентрация С выражена в моль/л, то размерность л/(моль см) и называют молярным коэффициентом поглощения или экстинцией. Часто пользуются весовыми концентрациями веществ г/л, мг/л, тогда ` удельный коэффициент поглощения, при этом линейность между A и C сохраняется.
59
Поглощение А – безразмерная величина, поскольку представляет собой логарифм отношения интенсивности падающего I0 света к интенсивности прошедшего I через
раствор света |
А log |
I0 |
log T |
(2.10) . |
||
I |
||||||
|
|
|
|
|
||
Отношение |
I |
T называют пропусканием раствора. |
||||
I0 |
||||||
|
|
|
|
|
||
При высоких концентрациях наблюдаются отклонения от закона Бугера-Ламберта-Беера, поэтому рекомендуется исследовать разбавленные растворы с оптическим поглощением, не превышающим 0,7-1.0.
На основании измерения в ходе реакции оптической характеристики раствора рассчитывают по фотометриическим данным константу скорости реакции k
|
1 |
C |
|
|
1 |
|
A |
|
|
|||||
k |
|
|
|
ln |
0 |
|
|
|
|
|
ln |
0 |
(2.11) |
, |
|
|
|
|
|
|
|
|
|||||||
|
|
t |
|
C |
|
|
|
t |
|
A |
|
|||
где t – время реакции, С0 – начальная концентрация исходного вещества, С – концентрация в данный момент времени, А0 и А – оптическое поглощение раствора при t = 0 и времени t соответственно.
В случае графического определения k используют
логарифмические |
временные |
зависимости |
ln C ln C0 kt |
или ln А ln А0 kt |
(2.12) . |
Тангенс угла наклона прямой у = a + bx равен b = k , а отрезок, отсекаемый по ординате, это lnC0 или lnА0 = a.
Реактивы и оборудование. Для проведения работы необходимы растворы 0,01 М KMnO4, 0,1 M MnSO4 , 0,1 M
H2C2O4. стаканчики, цилиндры или пробирки с делениями на 10 мл. Стакан-реактор или две тонкостенные пробирки разных диаметров. На спектрофотометре устанавливают рабочее значение длины волны света или используют синий светофильтр ( = 490-455 нм) при работе с фотометром. Значение записать в тетрадь.
60
Порядок выполнения работы.
1). Приготовление реакционной смеси. Используют специальный сосуд, в одну из внутренних частей наливают
1 мл 0,1 M MnSO4 и 7 мл 0,1 M H2C2O4 , а в другую 2 мл
0,01 М KMnO4. Можно также использовать две тонкостенные пробирки. Растворы помещают в термостат на 10 минут. При нагревании растворов рекомендуется подготовить к работе фотометр. Для этого необходимо произвести настройку прибора – выставить режим работы «оптическая плотность» и сделать калибровку, установив нулевое показание А по воде. Значения А0 при данных концентрациях реагентов лежат не превышают 0,9 1,0.
2). Регистрация значений А в ходе реакции. После нагрева растворов сосуд энергично встряхивают, затем быстро наливают в кювету, которую сразу же помещают в подготовленный для измерений прибор. Момент включения секундомера или таймера принимают за начало реакции. Время реакции указывают лаборант или преподаватель. Разложение комплексного иона марганца сопровождается уменьшением окраски раствора (значения A), что фиксируют по показаниям прибора и записывают в таблицу.
3). Опыт повторить при другой температуре.
4). Построение кинетических зависимостей: на одном графике для двух температур построить зависимости
А время, а на другом ln А время. Линейный вид полулогарифмических зависимостей подтверждает выполнимость первого порядка для реакции разложения.
5). Определить тангенс угла наклона прямых, который равен константе скорости реакции (см. уравнение 2.11).
61
6). Расчет энергии |
|
активации |
реакции проводится по |
||||||||
|
|
k |
2 |
|
|
T T |
|
|
|
||
формуле |
E ln |
|
|
|
1 |
2 |
|
R |
(2.13) . Укажите |
||
|
|
|
|
||||||||
|
a |
k |
|
T T |
|
|
|
||||
|
|
|
1 |
|
|
2 |
1 |
|
|
|
|
размерность Еа (она зависит от размерности газовой постоянной R = 8,314 Дж/(моль оК=1,988 кал/(моль оК).
Таблица 1.3.
Определение константы скорости реакции разложения
|
Температура t1 = ….. oC |
Температура t2 = ….. oC |
||||||||
|
|
T1 = ….. oK |
|
|
T2 = ….. oK |
|
||||
№ |
t,мин. |
|
А |
|
ln А |
t,мин. |
|
А |
|
ln А |
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
k1 = ……, |
|
|
k2 = ……, |
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
||||||||
|
Значение Еа = ….. |
(привести расчет) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
7). Записать вывод работы.
Вопросы к защите работы
1.Какой смысл имеет энергия активации реакции Еа?
2.Как изменяется Еа в присутствии катализатора?
3.Нарисуйте энергетические диаграммы реакции без катализатора и с катализатором для эндотермической реакции.
4.То же для экзотермической реакции.
5.Приведите вывод уравнения 2.13.
62
