
Практикум ФизХим Кинетика. Катализ Михаленко 2018
.pdf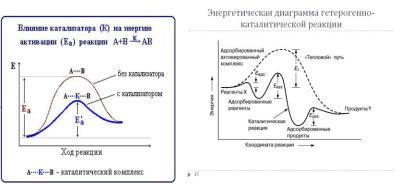
Рис.1.8. Снижение энергии активации в присутствии катализатора для слитного механизм (слева) и раздельного механизма (справа) со стадиями адсорбции и десорбции.
Причина каталитического действия – снижение энергии активации вследствие образования поверхностных комплексов (интермедиатов). Профиль энергии каталитической реакции в общем виде и с интермедиатамиадсорбатами показан на рис.1.8.
Промышленные катализаторы имеют сложный состав,
который защищен патентами. В процессах нефтепереработки применение гетерогенных катализаторов составляет 99%. Перечислим наиболее важные процессы, химический состав и условия (температура, давление) работы катализатора: крекинг (цеолиты с добавками редкоземельных элементов, Pt, Cr, 740-790 оК, 0,3 МПа), риформинг (полиметаллические нанесенные на
Al2O3 катализаторы с Pt, Re, Ir, 740-790 оК, 0,8-1,5 МПа),
гидроочистка (алюмо-кобальт-молибденовый, алюмо-никель- молибденовый, алюмо-никель-молибден-силикатный, 600-680 оК, 3-5 МПа), гидрокрекинг (цеолиты с нанесенными Ni,Co, Mo и добавками Pt, Pd,520-740 оК, 5-15 МПа), изомеризация (нанесенные на Al2O3 или цеолиты Pt,Pd с Сl , F ).
Велика роль гетерогенного катализа и для экологии. Широко используются каталитические нейтрализаторы для очистки выхлопных газов автомобилей и промышленных газовых выбросов, которые участвуют в каталитическом окислении монооксида углерода и восстановлении оксидов азота.
43
ЛАБОРАТОРНЫЕ РАБОТЫ
Работа 1
ИЗУЧЕНИЕ КИНЕТИКИ ГОМОГЕННОГО КАТАЛИТИЧЕСКОГО РАЗЛОЖЕНИЯ Н2О2
Пероксид (перекись) водорода в водных растворах самопроизвольно медленно разлагается с образованием
воды и кислорода 2H2O2 2H2O O2 .
С катализаторами реакция идет значительно быстрее, например, при введении в раствор ионов железа, меди, йода,
бихромат-иона (гомогенно-каталитическое разложение), в
присутствии металлов платины, кобальта и др.
(гетерогенно-каталитическая реакция). В организме человека разложение перекиси водорода, образующейся в процессе обмена веществ, происходит под действием фермента каталазы (ферментативный катализ).
Механизм реакции. Гомогенно-каталитическое разложение Н2О2 в растворе под действием бихромат-иона Cr2O72 в общем виде можно представить двумя стадиями:
1)2H2O2 Cr2O7 2 K1 Cr2O9 2 2H2O,
2)Cr2O9 2 k2 Cr2O7 2 O2
Медленной (лимитирующей) стадией является распад иона Cr2O92 , поэтому скорость реакции будет пропорциональна его концентрации:
w |
dCH O |
k |
C |
|
|
|
|
(2.1) , |
2 2 |
|
|
|
|
||||
|
Cr O |
2 |
|
|||||
|
dt |
2 |
|
|
|
|||
|
|
|
2 |
9 |
|
|
|
|
|
|
|
|
|
|
|
||
где k2 константа скорости второй стадии.
Концентрацию ионов промежуточного соединения CCr2O92
можно выразить, используя метод стационарных концентраций (см. вывод уравнения Михаэлиса-Ментена) или же уравнение константы равновесия 1ой стадии, в
44
котором равновесную концентрацию катализатора CCr2O72 следует записать как разность начальной концентрации
катализатора C |
0,Cr O |
2 |
|
и концентрации Cr O |
2 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
9 |
|
|
|
|
||||
|
|
|
|
2 |
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
CCr O 2 |
|
|
|
|
CCr O |
2 |
|
|
|
|
|
(2.2) . |
||||||||
|
2 |
9 |
|
|
|
|
|
2 |
9 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
C 2 H O |
C |
Cr O |
2 |
|
|
C 2 H O |
(C |
0,Cr O |
2 |
|
C |
Cr O |
2 |
|
) |
|
||||
|
2 2 |
|
|
|
2 2 |
|
|
|
|
|
|
||||||||||
|
|
|
|
2 |
7 |
|
|
|
|
|
2 |
7 |
|
|
|
2 |
9 |
|
|
|
|
Из (2.2) |
выразим |
концентрацию Cr2O92 , подставим в (2.1) |
|||||||||||||||||||
и получим зависимость скорости реакции от начальной концентрации катализатора и Н2О2
w |
dCH O |
k |
C |
|
|
|
|
|
|
K1 CH2 |
O |
|
(2.3) |
2 2 |
|
|
|
|
|
2 |
2 |
|
|||||
|
|
|
2 |
|
|
2 |
|
||||||
|
dt |
2 |
|
0,Cr O |
|
|
|
|
|
||||
|
|
|
|
2 |
7 |
|
1 K1 CH O |
||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
с константами равновесия К1 |
и лимитирующей стадии k2. |
||||||||||||
Из формулы (2.3) |
следует, что |
|
|
|
|||||||||
а) порядок реакции по |
|
катализатору |
|
первый, т.е. скорость |
|||||||||
реакции линейно увеличивается с ростом начальной концентрации бихромат-ионов; б) порядок реакции по Н2О2 может изменяться от 0 до 2.
Действительно, если K C2 H2O2 1 , то скорость реакции не |
|||||||
|
|
|
|
1 |
|
|
|
зависит |
от C |
H O |
(n=0), а |
при |
условии |
K C2 H2O2 1, |
|
|
|
|
|
|
1 |
||
|
|
2 |
2 |
|
|
|
|
скорость |
пропорциональна |
C 2 H2O2 |
(n=2). |
На опыте часто |
|||
получается промежуточный вариант n=1, что соответствует
уравнению реакции H2O2 H2O 12 O2 .
Примечание. Есть мнение, что при разложении перекиси водорода в первой обратимой стадии образуются ионы промежуточного соединения HCrO6 , которые необратимо распадаются с выделением кислорода и бихромат-иона Cr2O72 .
Двухстадийный механизм можно записать в виде
1) 4Н2О2 + Cr2O72- K1 2HCrO6 + 3Н2О 2) 2HCrO6- k2 Cr2O72 + H2O + 2О2 .
Первая стадия является сложной реакцией. Вывод кинетического уравнения для такого случая мы не рассматриваем.
45
ПРАКТИЧЕСКАЯ ЧАСТЬ
Лабораторная работа проводится в двух вариантах:
а) определяется порядок реакции по K2Cr2O7 на основании зависимости скорости реакции от начальной концентрации концентрациях катализатора, б) определяется порядок по
Н2О2 из зависимости ln t1/2 ln Co,H2O2 (cм. формулу 1.8`).
В обоих вариантах в опытах получают зависимости количества выделившегося кислорода от времени реакции.
Оборудование и реактивы: газометр с реактором, мешалка, раствор бихромата калия 0,1 моль/л, растворы перекиси водорода, два мерных цилиндра или пробирки с делениями на 10 мл, 1 колба на 100 мл, 1 стакан на 50 мл.
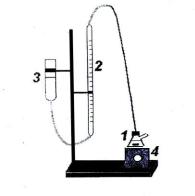
Газометр состоит из сосуда-реактора 1, соединенного трубкой с бюреткой 2 и уравнительной склянкой 3, которая нужна для того, чтобы измерять объѐм выделившегося О2 всегда при одном и том же давлении (атмосферном).
Рис.2.1. Газометр:
1 реактор-колба с раствором Н2О2
2 бюретка для измерения объѐма выделившегося О2,
3 уравнительная склянка,
4 магнитная мешалка.
Подготовка газометра к работе. Установить уровень воды в бюретке на «ноль» (реактор должен быть открыт) перемещением уравнительной склянки 3. Закрыть пробкой реактор и опустить склянку ниже середины шкалы бюретки. Уровень воды в бюретке понизится и установится на некотором делении. Если это положение не изменится в течение 2х минут, то систему можно считать герметичной.
46
Работа 1 А
ОПРЕДЕЛЕНИЕ ПОРЯДКА РЕАКЦИИ ДЛЯ K2Cr2O7 ПО ЗАВИСИМОСТИ СКОРОСТИ РАЗЛОЖЕНИЯ Н2О2 ОТ КОНЦЕНТРАЦИИ КАТАЛИЗАТОРА
Цель работы: получить зависимости количества выделившегося кислорода от времени реакции при различных начальных концентрациях катализатора и определить частный порядок реакции для K2Cr2O7.
Порядок выполнения работы:
1). По известной молярной концентрации перекиси водорода (указывает лаборант) рассчитайте максимальный объем кислорода, который может выделиться при полном разложении Н2О2, выразив его в мл:
V |
|
C0,H O |
VH O |
RT |
, где |
||
2 |
2 |
2 |
2 |
(2.4) |
|||
max O |
2PO |
|
2 |
||
|
||
|
2 |
R = 0,082 (л атм)/(град моль), Т – температура в помещении в градусах Кельвина, РО2 = 1 атм парциальное давление кислорода равно атмосферному давлению, т.к. парциальное давление паров воды мало (0,02 атм),
VН2О2 – объем перекиси водорода в реакторе (15 мл), С0,Н2О2 – начальная концентрация Н2О2 в моль/л.
Используя значение Vmax O2 , можно рассчитать степень разложения Н2О2 в конце опыта (глубину протекания
реакции) формуле |
VO |
2 |
100% (2.4`) . |
Vmax O2
2). Налейте в реактор 15 мл рабочего раствора Н2О2(0,3М), закройте реактор пробкой и уравняйте мениски в бюретке с «нулевым» отсчетом и в уравнительной склянке. Включите мешалку, быстро добавьте 2 мл раствора K2Cr2O7, закройте пробкой, включите секундомер и через одинаковые интервалы времени измеряйте объѐм выделившегося кислорода при выровненных менисках (склянка 3
47

опускается по мере увеличения VО2). Опыт продолжайте 10 минут при наименьшей начальной концентрации K2Cr2O7 (шаг 1 минута) или 5 минут (шаг 30 секунд). Время реакции t в мин. и VО2 в мл записывайте в табл.1.1а.
3). Вылейте реакционную смесь в стаканчик, достаньте якорь мешалки, промойте его и реактор дистиллированной водой. Подготовьте прибор к следующему опыту с другой концентрацией K2Cr2O7 (еѐ увеличивают или уменьшают). Всегда для опыта берут 2 мл раствора K2Cr2O7.
4-6). Повторите кинетические опыты с другими концентрациями K2Cr2O7.
7). На одном графике постройте четыре кинетические зависимости VО2(мл) время (мин.).
8). Рассчитайте средние скорости реакции w VO2 , выбрав
t
линейные области кривых на одной и той же глубине протекания реакции (VО2=const). Рассчитайте значение .. 9). Постройте график зависимости скорости реакции (укажите еѐ размерность) от концентрации катализатора. 10). Сделайте вывод о полученном опытном порядке реакции по катализатору.
Таблица 1.1а. Определение скорости разложения Н2О2 при разных концентрациях K2Cr2O7 ( температура …. 0С)
|
Опыт 1 |
Опыт 2 |
Опыт 3 |
Опыт 4 |
|||||
№ |
С1 = …. |
С2 = …. |
С3 = …. |
С4 = …. |
|||||
измерения |
t |
VO2 |
t |
VO2 |
t |
VO2 |
t |
VO2 |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
... |
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
Скорость |
w1 = …. |
w2 = …. |
w3 = …. |
w4 = …. |
|||||
реакции |
|||||||||
|
|
|
|
|
|
|
|
||
48
Работа 1 Б.
ОПРЕДЕЛЕНИЕ ПОРЯДКА РЕАКЦИИ ПО Н2О2 МЕТОДОМ ОСТВАЛЬДА-НОЙЕСА
Цель работы: определить порядок реакции по концентрационной зависимости периода полуразложения от начальной концентрации Н2О2.
Порядок выполнения работы:
1). Раствор K2Cr2O7 имеет концентрацию 0,04 М. Рабочим является 0,3 М раствор Н2О2 (опыт 4), из которого разбавлением приготавливаются растворы более низких концентраций (опыты 1-3), как это указано ниже.
Объемы (мл) |
|
Опыт 1 |
|
Опыт 2 |
|
Опыт 3 |
Опыт 4 |
|||||||
0,3 М Н2О2 V |
|
4 |
|
|
|
6 |
|
|
8 |
|
10 |
|||
Вода |
V0 |
|
6 |
|
|
|
4 |
|
|
2 |
|
0 |
||
K разб |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C0, H2O2 , M |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рассчитать константу разбавления и концентрацию С0 : |
||||||||||||||
|
К разб |
V V0 |
; |
|
|
C |
|
0,3 |
|
|
||||
|
|
|
|
C0,i |
0 |
|
|
|
|
|||||
|
|
V |
|
|
|
|
|
|||||||
|
|
K разб |
|
K разб |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||
2). Провести четыре кинетических опыта, как описано в п.п.1-3 работы 1а. Время реакции 10 минут. Данные записать в таблицу 1б.
3). Для всех концентраций Н2О2 по формуле 1.19 рассчитать максимальный объем кислорода (в мл) и записать ½ Vmax O2. 4). Построить на одном графике кинетические зависимости Vmax от времени. На оси ординат для каждой концентрации найти значение ½ Vmax O2 , опустить перпендикуляр на ось абсцисс и определить по графику время полуразложения t½. 5). Построить зависимость в координатах ln t½ ln C0. Рассчитать тангенс угла наклона и порядок реакции по перекиси водорода n в соответствии с уравнением
ln t1/ 2 const (n 1) ln C0
49

Таблица 1.1б.
Определение скорости разложения Н2О2 при разных начальных концентрациях Н2О2
(температура …. 0С, добавляется 2 мл 0,04М K2Cr2O7 )
|
Опыт 1 |
Опыт 2 |
Опыт 3 |
Опыт 4 |
||||||
№ измерения |
С1 = …. |
С2 = …. |
С3 = …. |
С4 = …. |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
VO2 |
t |
VO2 |
t |
VO2 |
t |
VO2 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Vmax O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
½ Vmax O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
период |
t1/2 |
= …. |
t1/2 |
= … |
t1/2 = …. |
t1/2 = …. |
||||
полуразложения |
||||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
ln t1/2 |
|
|
|
|
|
|
|
|
|
|
ln C0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6). Объяснить результат. Записать вывод работы.
Примечение: Можно вместо периода полупревращения t½ использовать любое фиксированное время, для которого рассчитывается степень превращения Н2О2, например, t¼ (25% прореагировавшего вещества).
50
Вопросы перед началом работы
5.Дайте определение скорости реакции, молекулярности и порядка реакции.
6.Расскажите последовательность проведения опытов.
7.Какие характеристики можно рассчитать предварительно?
8.Как рассчитать скорость реакции графическим методом?
9.Какой график нужно получить в работах 1а и 1б,если выполняется первый порядок по катализатору и по Н2О2?
Вопросы к защите работы
1.Чем обусловлена коричневая окраска раствора, содержащего одновременно перекись водорода и бихромат калия?
2.Поясните физический смысл константы скорости реакции.
3.В чем различие средней и истинной скорости реакции? Поясните это эскизом графика.
4.При каких условиях порядок реакции разложения Н2О2 будет нулевым? вторым?
5.Запишите условие стационарности для механизма
разложения Н2О2 c образованием промежуточного вещества Cr2O9 2-.
51
Работа 2
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ ИНВЕРСИИ САХАРОЗЫ МЕТОДОМ ПОЛЯРИМЕТРИИ
Цель работы: поляриметрическим методом определить константу скорости и период полупревращения инверсии сахарозы в присутствии ионов водорода.
Приборы и материалы: поляриметр, две пробирки с делениями на 10 мл, три стаканчики на 25 мл.
Реактивы: дистиллированная вода, раствор сахарозы с концентрацией 0,3 г/мл (сироп) и 2 н. раствор HCl. Аккуратно работайте с раствором соляной кислоты.
Поляриметрия метод исследования, основанный на измерении вращения плоскости поляризации света для определения концентраций оптически активных веществ. К ним относятся аминокислоты, белки и углеводы, например, сахароза и продукты ее гидролиза глюкоза и фруктоза. Молекулы оптически активных веществ построены асимметрично, у них неодинаковые показатели преломления для право- и лево-поляризованного света (n1n2), поэтому их растворы вращают плоскость поляризованного света на угол , как показано на рис.2.2. Удельный угол вращения [] это угол вращения при С = 1 г/мл, L = 1дм, температуре 20оС и желтом свете с длиной волны 590 нм.
Для сахарозы, глюкозы и фруктозы имеет разное значение (+66,55о, +52,5о , 91,9о, соответственно), при этом знак плюс означает правое направление вращения плоскости поляризации света, а знак минус – левое.
52
