- •8. Окислительно-восстановительные процессы
- •8.1 Окислительно-восстановительные реакции
- •8.1.1. Степень окисления элементов
- •8.1.2. Составление уравнений окислительно-восстановительных реакций
- •8.2. Типы окислительно-восстановительных реакций
- •8.3. Направление окислительно-восстановительных реакций
- •8.4. Электрохимические процессы
- •8.4.1. Электродный потенциал
- •8.4.2. Уравнение Нернста
- •8.4.3. Гальванические элементы
- •8.4.4. Электродвижущая сила гальванического элемента
- •8.4.5. Измерение э.Д.С. Гальванического элемента
- •8.5. Химические источники тока
- •8.5.1. Гальванические первичные элементы
- •8.5.2. Аккумуляторы
- •8.5.3 Топливные элементы и электрохимические энергоустановки
- •8.6. Электролиз
- •8.6.1. Электролиз расплавов
- •8.6.2. Электролиз водных растворов
- •8.6.3. Законы электролиза
- •8.6.4. Электрохимическая поляризация при электролизе
- •8.6.5. Перенапряжение. Потенциал разложения
- •8.6.6. Выход по току
- •8.6.7. Применение электролиза
- •8.7. Коррозия металлов
- •8.7.1. Химическая коррозия
- •8.7.2. Электрохимическая коррозия
- •8.7.3. Методы защиты металлов от коррозии
8.6. Электролиз
Электролиз - это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
Для осуществления электролиза применяют устройства, называемые электролизерами. В зависимости от вида получаемого продукта (металл, газ, раствор) применяют различные конструкции электролизеров. В простейшем случае электролизер состоит из двух электродов, погружаемых в электролит. Электрод, подключаемый к отрицательному полюсу внешнего источника постоянного тока, называют катодом. На катоде протекает процесс восстановления – принятия электронов. Электрод, подключаемый к положительному полюсу источника питания, называют анодом. На нем идет процесс окисления – отдача электронов.
Процессы электролиза, протекающие на электродах, зависят:
1) от вида электродов: металлические или неметаллические (графитовые);
2) от состояния электролита (раствор или расплав).
Рассмотрим процессы электролиза разбив его на две группы:
-
электролиз растворов и расплавов;
-
электролиз с инертными и растворимыми электродами.
8.6.1. Электролиз расплавов
Имеется расплав NaCl. Катионы и анионы находятся в хаотическом движении. Если в расплав опустить графитовые электроды и пропустить постоянный электрический ток, то катионы Na+ будут двигаться к катоду, а анионы Cl‾ – к аноду.

На катоде катионы натрия, взаимодействуя с электронами, приходящими по внешней цепи, восстанавливаются. На аноде протекает процесс окисления ионов хлора и последующее связывание атомов Cl в молекулы Cl2.
Если электролизу подвергается расплав, который содержит несколько различных катионов металлов, то при этом в первую очередь восстанавливаются катионы металлов, обладающих большим значением электродного потенциала.
Окислительно-восстановительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей. Меняя напряжение на электродах, можно создать любой силы окислители и восстановители, которыми являются электроды.
8.6.2. Электролиз водных растворов
Более сложные процессы электролиза протекают в водных растворах электролитов. Рассмотрим электролиз с инертными (нерастворимыми) электродами водного раствора NaCl.

Если концентрация NaCl окажется очень мала, то на аноде вместе с ионами Cl‾ могут окисляться молекулы H2O:
![]() .
.
Руководствуясь табличными значениями стандартных электродных потенциалов металлов можно сделать вывод о последовательности протекания электродных процессов
Катодные процессы.
На катоде:
-
возможно восстановление катионов металлов
![]() ;
;
-
возможно восстановление молекул воды
![]() .
.
На отрицательном катоде легче всего разряжаются катионы или молекулы с наиболее положительным потенциалом.
То есть:
-
Катионы металлов с потенциалом, превышающим потенциал водорода: Cu2+, Hg2+, Ag+, Pt2+, … - легко восстанавливаются на катоде и выделяются в виде металла.
-
Катионы металлов с малой величиной потенциала: Li+, Na+, K+, Rb+, … до Al3+ включительно – на катоде не восстанавливаются при электролизе водных растворов. Вместо них восстанавливается молекулы H2O с выделением H2.
-
Катионы металлов с потенциалом меньшим, чем у водорода, но большим, чем у алюминия: Mn2+, Zn2+, Cr3+, Fe2+, … до H – при электролизе водных растворов восстанавливаются одновременно с молекулами H2O.
Анодные процессы.
На аноде протекают процессы окисления, то есть электроны отводятся внешним источником тока. В зависимости от вида электролита и материала анода на аноде могут окисляться анионы, молекулы растворителя (чаще всего H2O), а также сам материал анода.
-
 ;
; -
 ;
; -
 .
.
Чем ниже величина потенциала, тем легче вещество окисляется на положительно поляризованном аноде.
-
В первую очередь окисляются бескислородные анионы
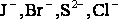 (кроме F‾),
если отсутствуют - окисляется вода.
(кроме F‾),
если отсутствуют - окисляется вода. -
Кислородсодержащие анионы (
 )
не окисляются из-за высокого потенциала.
Вместо них окисляются молекулы H2O с
образованием O2.
)
не окисляются из-за высокого потенциала.
Вместо них окисляются молекулы H2O с
образованием O2. -
Растворимые аноды: Cu, Ag, Zn, Cd, Ni и др. – окисляются, посылая свои ионы в раствор. Инертные (графитовые, платиновые) аноды не окисляются.
Рассмотрим электролиз с инертными (нерастворимыми) электродами водного раствора K2SO4
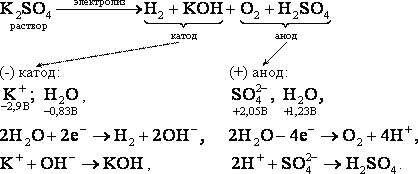
Электролиз водных растворов с растворимым анодом: Cu, Ag, Zn, Cd, Ni рассмотрим на примере NiSO4.