
Лаб журнал
.docx

МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
|
|
Институт тонких химических технологий им. М.В. Ломоносова |
|
(наименование Института)
|
|
Кафедра коллоидной химии им. С.С. Воюцкого |
|
(наименование кафедры)
Лабораторный журнал
Студентки группы ХББО-02-16
Ивановой Елены Анатольевны
Преподаватель:
Буканова Евгения Фёдоровна
Москва, 2019
Лабораторная работа №1 (1+3)
Исследование взаимосвязи между поверхностным натяжением и адсорбцией
Цель работы: определение адсорбции и основных характеристик адсорбционного слоя на границе раствор – воздух по экспериментально найденной изотерме поверхностного натяжения.
Объект исследования: изоамиловый спирт
Метод исследования – сталагмометрический
|
Исследуемое вещество |
Концентрация раствора с, моль/л |
Число капель n (угол отрыва) |
Поверхностное натяжение σ, мДж/м2 |
||||
|
Опр.1 |
Опр.2 |
Опр.3 |
Ср. значение |
||||
|
Вода |
55,56 |
48 |
48 |
- |
48 |
72,7 |
|
|
Изоамиловый спирт |
0,03 |
54 |
53 |
53 |
53 |
65,8 |
|
|
Изоамиловый спирт |
0,06 |
66 |
67 |
66 |
66 |
52,9 |
|
|
Изоамиловый спирт |
0,12 |
78 |
73 |
80 |
77 |
45,3 |
|
|
Изоамиловый спирт |
0,18 |
84 |
86 |
85 |
85 |
41,1 |
|
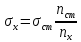
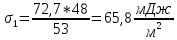
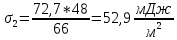
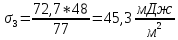
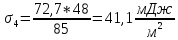
График 1. Изотерма поверхностного натяжения
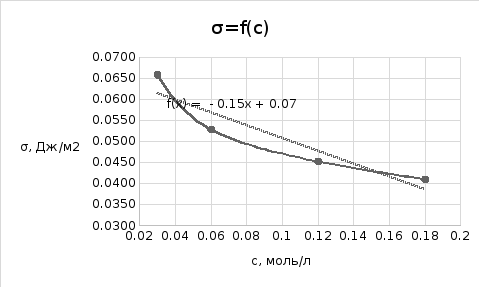
График 2. Зависимость поверхностного натяжения от натурального логарифма концентрации раствора ПАВ
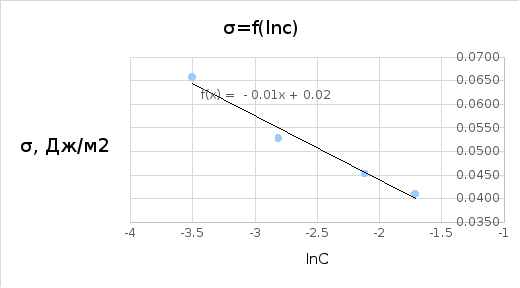
y=-0,0136x+0,0166
σ=f(lnc) => tgα=-0,0136
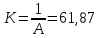
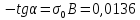
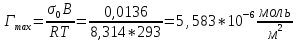
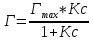
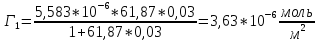
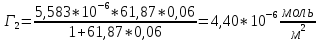
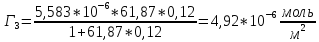
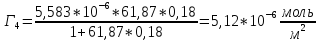
График 3. Изотерма адсорбции
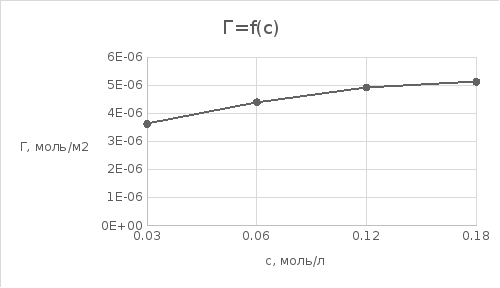
По уравнению Шишковского:
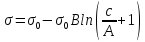

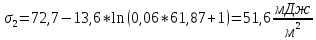
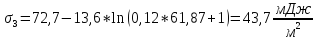
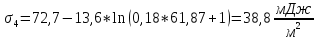
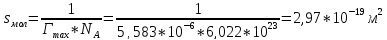
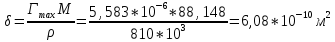
Вывод: в ходе лабораторной работы были определены адсорбция и основные характеристики адсорбционного слоя на границе раствор ПАВ – воздух по экспериментально найденной изотерме поверхностного натяжения.
Лабораторная работа №2 (8)
Исследование адсорбции красителя из раствора на ткани
Цель работы: построение изотермы адсорбции красителя из раствора на ткани, расчет констант уравнения Ленгмюра, удельной поверхности адсорбента.
|
№ п/п |
Сисх, г/л |
D1 до адсорбции |
D2 до адсорбции |
Сравн, г/л |
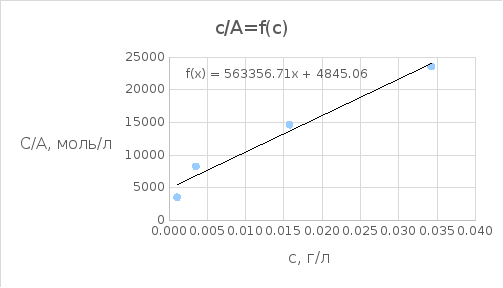
A*106, моль/г |
А/с, моль/л |
|
1 |
0,042 |
0,8 |
0,66 |
0,034 |
1,45 |
23596 |
|
2 |
0,021 |
0,42 |
0,32 |
0,016 |
1,07 |
14667 |
|
3 |
0,0105 |
0,23 |
0,18 |
0,008 |
0,45 |
18243 |
|
4 |
0,00525 |
0,13 |
0,095 |
0,003 |
0,42 |
8280 |
|
5 |
0,002625 |
0,07 |
0,05 |
0,001 |
0,30 |
3540 |
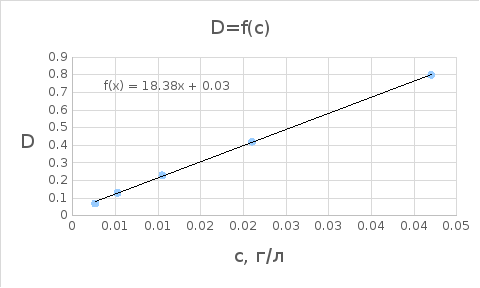
График 2.1. Зависимость оптической плотности D от концентрации раствора с.
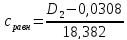
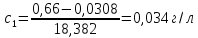
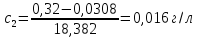
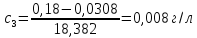
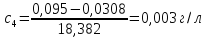
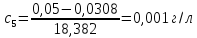
|
№ п/п |
m ткани |
|
1 |
0,36 |
|
2 |
0,33 |
|
3 |
0,36 |
|
4 |
0,28 |
|
5 |
0,36 |
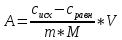
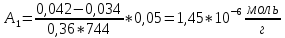
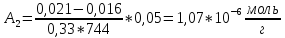
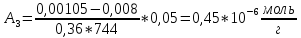
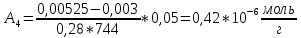
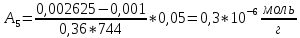
График 2.2. Изотерма адсорбции
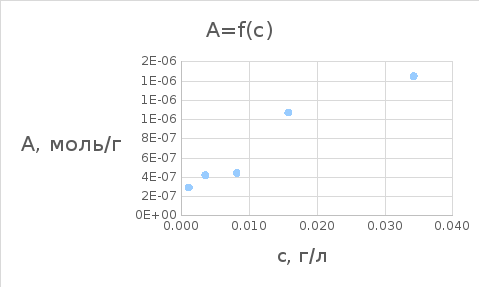
График 2.3. Зависимость сравн/А от сравн
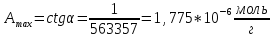
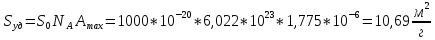
Вывод: в ходе лабораторной работы была построена изотерма адсорбции красителя из раствора на ткани, рассчитаны константы уравнения Ленгмюра и удельная поверхность адсорбции.
Лабораторная работа №3
Определение размера частиц коллоидных систем, подчиняющихся уравнению Рэлея, турбодиметрическим методом
Цель работы: определение оптической плотности латекса и вычисления глобул по уравнению Рэлея.
Объект исследования: СКС-30
Метод исследования – турбодиметрический
|
Разведение |
D |
Смасс, г/см3 |
Соб, см3полим см3сист |
τ, см-1 |
τ/соб |
|
2 на 100 |
0,04 |
1*10-4 |
1,08*10-4 |
0,092 |
851,9 |
|
4 на 100 |
0,065 |
2*10-4 |
2,15*10-4 |
0,1495 |
695,3 |
|
6 на 100 |
0,095 |
3*10-4 |
3,23*10-4 |
0,2185 |
674,5 |
|
10 на 100 |
0,16 |
5*10-4 |
5,38*10-4 |
0,368 |
684,0 |
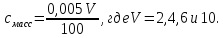
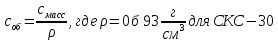
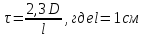
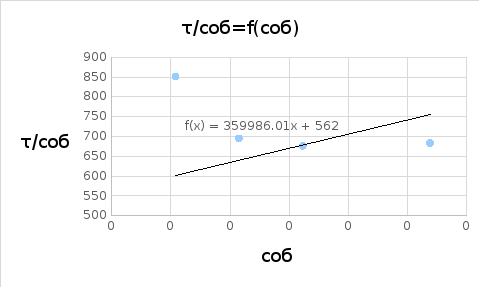
τ/соб (соб=0) = 562
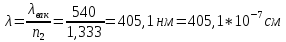
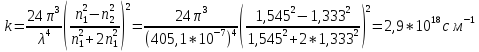
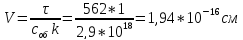
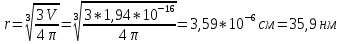
Вывод: была определена оптическая плотность латекса СКС-30 и вычислены объем и радиус глобул (по уравнению Рэлея), равные 1,94*10-16см и 35,9 нм соответственно, т.е. латекс является представителем коллоидной химии.
Лабораторная работа №4
Получение дисперсных систем
Цель работы: получение гидрозолей различными методами; наблюдение их опалесценции и определение знака заряда частиц.
-
Получение золя берлинской лазури методом химической конденсации
-
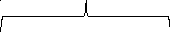 В
небольшой стакан пипеткой внесли 9 мл
K4[Fe(CN)6]
0,025 М и прилили в недостатке (прим. 1 мл)
0,015 М раствор FeCl3.
Получили раствор зелено-синей окраски.
При переносе осадка на фильтровальную
бумагу произошло окрашивание бумаги
в центре нанесения осадка, по краям
пятно осталось бесцветным. Золь дает
конус Тиндаля.
В
небольшой стакан пипеткой внесли 9 мл
K4[Fe(CN)6]
0,025 М и прилили в недостатке (прим. 1 мл)
0,015 М раствор FeCl3.
Получили раствор зелено-синей окраски.
При переносе осадка на фильтровальную
бумагу произошло окрашивание бумаги
в центре нанесения осадка, по краям
пятно осталось бесцветным. Золь дает
конус Тиндаля.
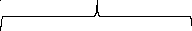
3K4[Fe(CN)6]+4FeCl3= Fe4[Fe(CN)6]3+12KCl
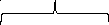
Мицелла
Ядро
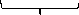
{m(Fe4[Fe(CN)6]3)nFe3+(3n-x)Cl-}xCl-
Агрегат
Частица
-
 Аналогичную
реакцию провели с 1 мл K4[Fe(CN)6]
и избытком (прим. 9 мл) FeCl3
(оба раствора 0,025 М). Получили раствор
темно-синего цвета. При переносе осадка
на фильтровальную бумагу окрашивание
произошло по всей поверхности пятна
нанесения. Наблюдался конус Тиндаля.
Аналогичную
реакцию провели с 1 мл K4[Fe(CN)6]
и избытком (прим. 9 мл) FeCl3
(оба раствора 0,025 М). Получили раствор
темно-синего цвета. При переносе осадка
на фильтровальную бумагу окрашивание
произошло по всей поверхности пятна
нанесения. Наблюдался конус Тиндаля.
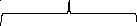
3K4[Fe(CN)6]+4FeCl3= Fe4[Fe(CN)6]3+12KCl
Мицелла

Ядро
{m(Fe4[Fe(CN)6]3)n[Fe(CN)6]4-(4n-x)K+}xK+
Агрегат
 Частица
Частица
Объяснение окрашивания фильтровальной бумаги: бумага имеет отрицательно-заряженную поверхность. В первом случае произошла адсорбция осадка, поскольку частица в мицелле положительно-заряженная, во втором случае произошло растекание, т.к. частица – отрицательно-заряженная.
-
Получение золя диоксида марганца методом химической конденсации
 В
небольшой стакан прилили 5 мл 1,5% раствора
перманганата калия и разбавили до 50 мл
дистиллированной водой. Затем по каплям
добавили 1% раствор тиосульфата натрия.
Получили бордово-красный золь, который
дает конус Тиндаля.
В
небольшой стакан прилили 5 мл 1,5% раствора
перманганата калия и разбавили до 50 мл
дистиллированной водой. Затем по каплям
добавили 1% раствор тиосульфата натрия.
Получили бордово-красный золь, который
дает конус Тиндаля.
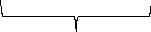
Мицелла
Ядро

{mMnO2nMnO-4(n-x) K+}xK+
Агрегат
Частица
-
Получение золя канифоли методом замены растворителя (физическая конденсация)
В стакан прилили 5 мл 2% спиртового раствора канифоли (желтое окрашивание). Туда же прилили избыток дистиллированной воды. Окраска золя изменилась на белую. Золь дает конус Тиндаля.
-
Получение золя фосфата железа методом пептизации
5 мл насыщенного раствора FeCl3 разбавили дистиллированной водой до 50 мл. По каплям прилили 10% раствор Na2HPO4. Образовался зеленовато-белесый золь фосфата железа (III), который дает конус Тиндаля.
 Мицелла
Мицелла
Ядро
{mFePO4n PO43-(n-x)Na+}xNa+
Агрегат
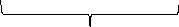
Частица
-
Получение золя гексацианоферрата меди методом химической конденсации
0,5 мл 20% раствора K4[Fe(CN)6] разбавили до 100 мл дистиллированной водой. Туда же прилили 4 капли 10% раствора CuSO4. Образовался красно-бурый золь, который дает конус Тиндаля.
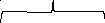
Мицелла
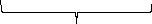
Ядро

{m(Cu2[Fe(CN)6])nCu2+(n-x)SO42-}x SO42-
Агрегат
Частица
Лабораторная работа №5
Исследование зависимости вязкости растворов полимеров от их концентрации
Цель работы: 1) изучение зависимости вязкости от концентрации раствора полимера и сопоставление с уравнением Эйнштейна; 2) исследование зависимости вязкости от концентрации раствора и вычисление молекулярной массы полимера.
|
Концентрация раствора полимера с, 1/100 мл |
Время истечения τ, с |
ηотн |
η, сП |
ηуд |
ηуд/с |
|
Вода |
10,5 |
- |
- |
- |
- |
|
Поливиниловый спирт, 0.75% |
14,7 |
1,4 |
1,4 |
0,4 |
0,53 |
|
Поливиниловый спирт, 1% |
15,7 |
1,5 |
1,5 |
0,5 |
0,5 |
|
Поливиниловый спирт, 1.5% |
21,1 |
2 |
2 |
1 |
0,67 |
|
Поливиниловый спирт, 2% |
24,8 |
2,4 |
2,4 |
1,4 |
0,7 |
 Уравнение
Эйнштейна:
Уравнение
Эйнштейна:
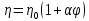
где η0 – вязкость дисперсной системы
α – коэффициент формы частицы
ηуд – удельная вязкость
Вывод: зависимость не подчиняется уравнению Эйнштейна из-за наличия эффекта взаимодействия между частицами.
[η]=0,38
Уравнение Марка-Куна:
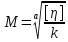
а=0,63; k=5,95*10-4
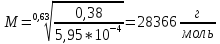
Вывод: 1. Изучили зависимость вязкости от концентрации раствора полимера и определили, что зависимость не подчиняется уравнению Эйнштейна из-за наличия эффекта взаимодействия между частицами; 2) экспериментально вычислили молекулярную массу поливинилового спирта, которая равна 28366 г/моль.
Лабораторная работа №6
Исследование кинетики ограниченного набухания полимера
Цель работы: исследование кинетики ограниченного набухания ненаполненной резины и числа набухания объемным методом.
Объект исследования: ненаполненная резина в ксилоле
Метод исследования – объемный
Начальная масса резины m0 = 0,42 г.
Плотность резины ρ0=0,91 г/мл
Плотность ксилола ρ1=0,8802 г/мл
|
Время отсчета |
Время прошедшее с начала отсчета, мин |
Уровень жидкости в бюретке |
Суммарное количество поглощенного растворителя |
Qmax-Qτ,% |
lg(Qmax-Qτ),% |
|||||
|
Деления бюретки |
мл |
г |
% от массы исходного образца |
|
|
|||||
|
9.28 |
0 |
111 |
0 |
0 |
0 |
0 |
102,4 |
2,01 |
||
|
|
15 |
105 |
6 |
0,114 |
0,1 |
23.8 |
78,6 |
1,9 |
||
|
|
30 |
103 |
8 |
0,152 |
0,13 |
31 |
71,4 |
1,85 |
||
|
|
45 |
97 |
14 |
0,266 |
0,23 |
54,8 |
47,6 |
1,68 |
||
|
|
60 |
94 |
17 |
0,323 |
0,28 |
66,7 |
35,7 |
1,55 |
||
|
|
90 |
89 |
22 |
0,418 |
0,37 |
88,1 |
14,3 |
1,16 |
||
|
|
120 |
85 |
26 |
0,494 |
0,43 |
102,4 |
0 |
- |
||
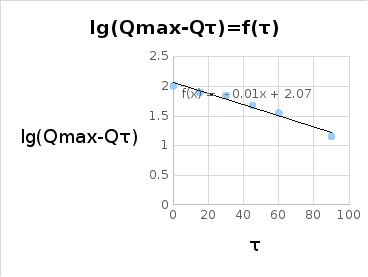
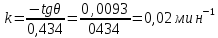
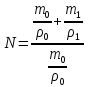
m0 = 0,42 г
m1 = 0,43 г
ρ0=0,91 г/мл
ρ1=0,8802 г/мл
N=2,07
Вывод: изучена кинетика ограниченного набухания ненаполненной резины: определено число набухания, равное 2,07 и константа скорости набухания, равная 0,02 мин-1.
