
3 КУРС (БИОХИМИЯ ЭНЕРГИЯ) / Разобранные билеты на экзамен по биохимии
.pdf«Биохимия и молекулярная биология»
1. Характеристика метаболических путей. Унификация и конвергенция.
Метаболизм – от греческого “менять” (обмен веществ)
представляет собой совокупность всех химических реакций, происходящих в организме. В обмене веществ выделяют внешний и промежуточный обмен:
-Внешний обмен – внеклеточное переваривание веществ при поступлении и выделении из организма. -Промежуточный обмен - превращение веществ внутри клеток с момента их поступления до образования конечных продуктов.
Попав внутрь клетки, питательное вещество метаболизируется, то есть претерпевает ряд химических изменений, которые катализируются ферментами. Определённая последовательность таких химических изменений называется метаболическим путём, а образующиеся промежуточные продукты
– метаболитами. Существуют разные типы метаболических путей.
Обмен веществ (метаболизм) можно разделить на два взаимосвязанных, но разнонаправленных процесса: анаболизм (ассимиляция) и катаболизм (диссимиляция).
Катаболические и анаболические реакции протекают одновременно, однако их скорости регулируются независимо, они часто локализованы в разных участках клетки. Метаболичесие пути регулируются на нескольких уровнях, как внутри клетки, так и внеклеточно.
1) Аллостерическая регуляция метаболитами, сигнализирующими о состоянии метаболизма внутри клетки.
2)Регуляция при участии гормонов и ростовых факторов, которые действуют снаружи клетки.
3)Регуляция на уровне транскрипции.
Катаболизм объединяет процессы деградации, в которых органические молекулы пищи (углеводы, жиры и белки) превращаются в более простые конечные продукты (молочная кислота, СО2, NH3). Анаболизм, называемый также биосинтезом, - включает процессы, при которых из малых молекулпредшественников, или «строительных блоков», синтезируются более крупные и сложные молекулы
– жиры, полисахариды, белки и нуклеиновые кислоты.
Общую стадию катаболических и анаболических путей называют иногда амфuболuческой стадией метаболизма (от греч. «amfi»-оба).
Все метаболические пути делят на центральные и специальные.
Центральные метаболические пути - пути превращения основных пищевых веществ клетки - углеводов, жиров, белков и нуклеиновых кислот. Они немногочисленны и сходны почти у всех живых форм.
Специальные метаболические пути - пути образования различных специализированных веществ, требующихся клеткам в малых количествах (гормоны, пигменты, токсины, антибиотики, алкалоиды и др.). Они составляют, так называемый, вторичный метаболизм Унификация питательных веществ идёт в три фазы.(характерна для катаболизмавсе пути сходятся на ацетил соа)
I. Подготовительная фаза. Высокомолекулярные соединения распадаются под действием гидролаз ЖКТ до мономеров. Протекает в ЖКТ и лизосомах. Не является поставщиком энергии (1%).
II фаза. Превращение мономеров в простые соединения - центральные метаболиты (ПВК, ацетилКоА). Эти продукты связывают 3 вида обмена, до 2-3 с, протекает в цитоплазме, завершается в митохондриях, даёт 20-30% энергии, поставляемой анаэробно.
III фаза. Цикл Кребса. Аэробные условия, полное окисление поступивших с пищей веществ, выделяется большое количество энергии и аккумулируется она в АТФ.
Анаболические пути расходятся
1фаза. Синтез белков начинается с образования α-кетокислот.
2фаза. Аминирование α-кетокислот, получение АМК.
3фаза. Из АМК образуются белки. 2 СО2
2.Распад углеводов в желудочно-кишечном тракте. Характеристика амилолитических
ферментов. Транспорт моносахаридов.
Этапы переваривания углеводов 1. Расщепление углеводов пищи начинается в ротовой полости под действием α-амилазы слюны.
2.В желудке отсутствуют ферменты, расщепляющие углеводы. Незначительное расщепление углеводов пищи происходит внутри пищевого комка до тех пор, пока не произойдет инактивация слюнной α-амилазы слюны желудочным соком.
3.Расщепление углеводов завершается в тонком кишечнике под действием панкреатической
4.α-амилазы и дисахаридаз кишечника.
α-Амилаза слюны
Относится к ферментам класса гидролаз. Локализация – ротовая полость. Оптимум рН 6,7 (от 6,6 до 6,8). Активируется ионами Cl-. Гидролизует α-1,4-гликозидные связи внутри полисахаридной цепи (эндогликозидаза), не расщепляет 1,6-связи.
Действие α-амилазы слюны останавливается в желудке при снижении рН до 1,5 – 2,5. Продукты расщепления крахмала и гликогена – декстрины и мальтоза.
Панкреатическая α-амилаза
Оптимум рН 7,1. Как и α-амилаза слюны, активируется ионами Cl-. Гидролизует α-1,4-гликозидные связи внутри полисахаридной молекулы (эндогликозидаза), не расщепляет 1,6-связи.
Продукты расщепления крахмала и гликогена – мальтоза, мальтотриоза, α – лимит декстрин.
Сахаразо-изомальтазный комплекс
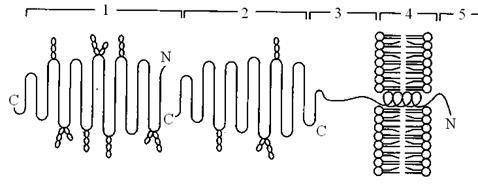
Этот ферментативный комплекс состоит из двух полипептидных цепей и имеет доменное строение. Сахаразо-изомальтазный комплекс прикрепляется к мембране микроворсинок кишечника с помощью гидрофобного (трансмембранного) домена, образованного N-концевой частью полипептида. Каталитический центр выступает в просвет кишечника (рис. 16.7). Связь этого пищеварительного фермента с мембраной способствует эффективному поглощению продуктов гидролиза клеткой.
Рис. 16.7. Сахаразо-изомальтазный комплекс. 1 – сахараза; 2 – изомальтоза; 3 – связывающий домен; 4 – трансмембранный домен; 5 – цитоплазматический домен
Сахаразо-изомальтазный комплекс гидролизует сахарозу и изомальтозу, расщепляя α-l,2- и, α-l,6- гликозидные связи. Кроме того, оба ферментных домена имеют мальтазную и мальтотриазную активности, гидролизуя α-l,4гликозидные связи в мальтозе и мальтотриозе (трисахарид, образующийся из крахмала). На долю сахаразо-изомальтазного комплекса приходится 80% от всей мальтазной активности кишечника. Но, несмотря на присущую ему высокую мальтазную активность, этот ферментативный комплекс назван в соответствии с основной специфичностью. К тому же сахаразная субъединица – единственный фермент, гидролизующий сахарозу в кишечнике.
Лактаза расщепляет β-1,4-гликозидные связи между галактозой и глюкозой в лактозе (рис. 16.10). По химической природе этот ферментативный комплекс является гликопротеином. Лактаза, как и другие гликозидазные комплексы, связана со щёточной каемкой и неравномерно распределена по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, у плода активность лактазы особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность фермента снижается, составляя у взрослых 10% от уровня активности, характерного для детей.
Трегалаза – также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе (дисахариде, содержащемся в грибах). Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода
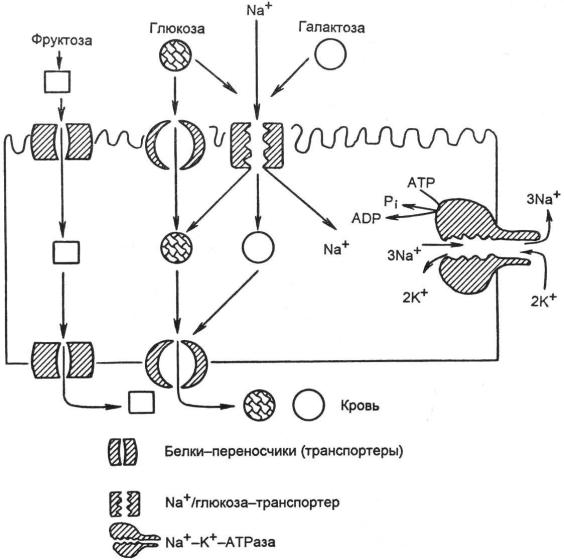
Глюкозные транспортёры (ГЛЮТ) — большая группа мембранных белков, отвечающих за перенос глюкозы через клеточную мембрану.
Типы ГЛЮТ Локализация в органах ГЛЮТ-1 Преимущественно в мозге, плаценте, почках, толстом кишечнике
ГЛЮТ-2 Преимущественно в печени, почках, β-клетках островков Лангерганса, энтероцитах ГЛЮТ-3 Во многих тканях, включая мозг, плаценту, почки ГЛЮТ-4 (инсулинзависимый) В мышцах (скелетной, сердечной), жировой ткани. Содержится в отсутствие инсулина почти полностью в цитоплазме ГЛЮТ-5 В тонком кишечнике. Переносчик фруктозы
3. Гликолиз. Регуляция гликолиза.
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
Реакции:
1. Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет ATP. Реакция катализируется ферментом гексокиназой. Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
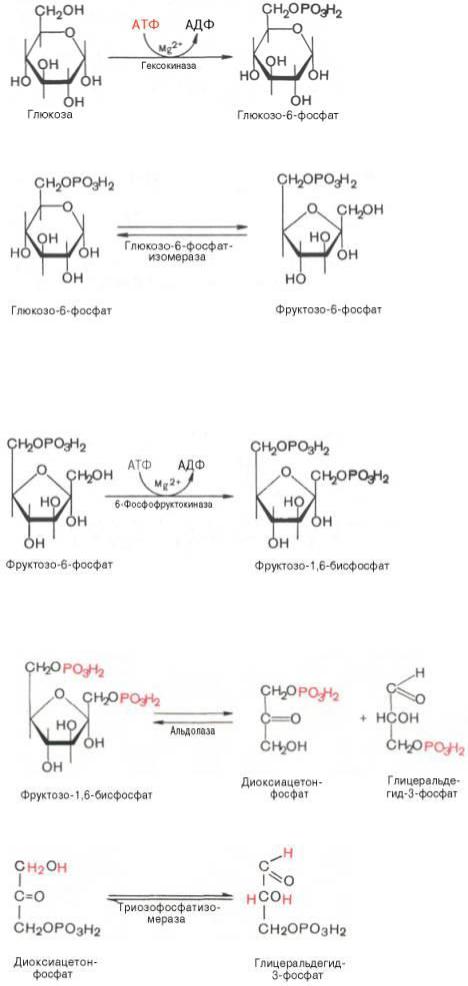
2. Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:
3. Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ. протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом. Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается
4. Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо- 1,6-бисфосфат расщепляется на две фосфотриозы. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).
5. Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой.
6.В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента
глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается

своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йодили бромацетатом, протекает в несколько этапов: 1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3- бисфосфоглицериновая кислота.
7. Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3- фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
8. Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3- фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат). Реакция легкообратима, протекает в присутствии ионов Mg2+.
9. Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической. Енолаза активируется двухвалентными катионами Mg2+или Мn2+ и ингибируется фторидом.
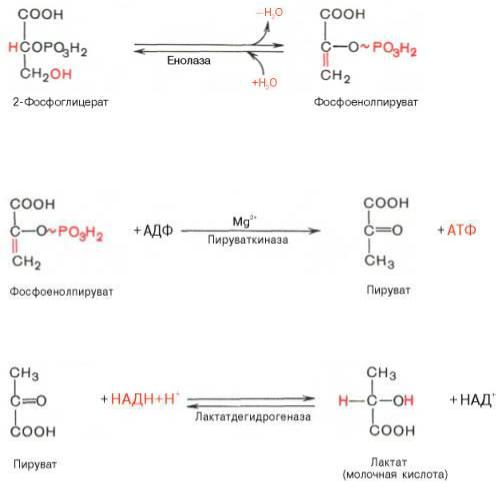
10. Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой: Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.)
11. В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:
Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз – гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами.
Втканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1 и ЛДГ2. Эти изоферменты инги-бируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле трикарбоновых кислот.
Втканях человека, в значительной степени использующих энергию гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
4. Гликогенолиз. Регуляция процесса на уровне гликогенфосфорилазы.
Как отмечалось, процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии 2 ферментов – фосфорилазы а и фосфо-глюкомутазы.
Фосфорилаза гликогена (кофермент пиридоксальфосфат) – расщепляет α-1,4-гликозидные связи с образованием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления (α1,6-связи) не останется 4 остатка глюкозы.
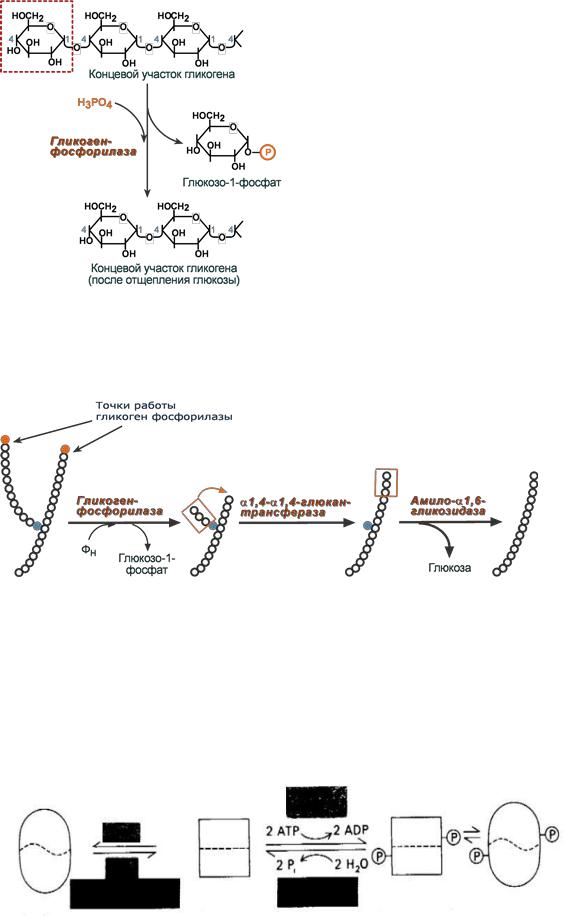
2.α(1,4)-α(1,4)-Глюкантрансфераза – фермент, переносящий фрагмент из трех остатков глюкозы на другую цепь с образованием новой α1,4-гликозидной связи. При этом на прежнем месте остается один остаток глюкозы и "открытая" доступная α1,6-гликозидная связь.
3.Амило-α1,6-глюкозидаза, ("деветвящий" фермент) – гидролизует α1,6-гликозидную связь с высвобождением свободной (нефосфорилированной) глюкозы. В результате образуется цепь без ветвлений, вновь служащая субстратом для фосфорилазы.
Основным механизмом регуляции активности этих ферментов является их ковалентная модификация путем фосфорилирования - дефосфорилирования.
Фосфорилированная фосфорилаза активна (отвечает за расщепление гликогена) ее называют фосфорилаза-А. В то время как фосфорилированная гликогенсинтетаза неактивна, ( активная форма отвечает за синтез) а дефосфорилированные формы наоборот. Дефосфорилированная фосфорилаза неактивна - фосфорилаза-В.
Если оба эти фермента находятся в фосфорилированной форме ( фосфорилаза - активна), то в клетке идет расщепление гликогена с образованием глюкозы. В дефосфорилированном состоянии (дефосфорилированная гликогенсинтетаза - активна) наоборот идет синтез гликогена из глюкозы.
Фосфорилаза скелетных мышц существует в двух взаимопревращающихся формах: активная фосфорилаза а и обычно неактивная фосфорилаза b (рис. 17.3).
Фосфорилаза |
b Фосфорилаза |
b Фосфорилаза |
a Фосфорилаза a |
(активная |
(неактивная |
(неактивная |
(активная |
R-форма) |
Т-форма) |
Т-форма) |
R-форма) |
Рис. 17.3. Регуляции гликоген-фосфорилазы в скелетных мышцах
Фермент может принимать каталитически неактивную Т (напряженную) конформацию или активную R (релаксированную) конформацию. Равновесие R↔T для фосфорилазы а сдвинуто далеко в сторону активного R-coстояния. В противоположность этому фосфорилаза b находится преимущественно в неактивном Т-состоянии, исключая случаи, когда содержание AMP находится на высоком уровне, а содержание АТР и глюкозо-6-фосфата – на низком. При большинстве физиологических состояний доля активного фермента определяется скоростями фосфорилирования и дефосфорилирования. Фермент представляет собою димер, молекулярная масса субъединиц которого равна 92 кДа. Фосфорилаза b превращается в фосфорилазу а путем фосфорилирования одного остатка серина (Ser14) в каждой субъединице. Эта ковалентная модификация катализируется специфическим ферментом киназой фосфорилазы, которая была открыта Эдмондом Фишером и Эдвином Кребсом. Фосфорилаза а инактивируется специфической фосфатазой, гидролизующей фосфорильную группу, присоединенную к Ser-14.
Мышечная фосфорилаза b активна только в присутствии высоких концентраций AMP, действующих аллостерически. AMP связывается с центром связывания нуклеотида и изменяет конформацию фосфорилазы b. ATP действует как отрицательный аллостерический эффектор, конкурируя с AMP. Глюкозо-6-фосфат также ингибирует фосфорилазу b преимущественно путем связывания с другим активным центром. При большинстве физиологических состояний фосфорилаза b неактивна вследствие ингибирующего действия АТР и глюкозо-6-фосфата. В противоположность этому
фосфорилаза а полностью активна независимо от содержания AMP, ATP и глюкозо-6-фосфата. Доля активного фермента определяется, прежде всего, скоростями фосфорилирования и дефосфорилирования. В неработающей мышце почти весь фермент находится в неактивной b-форме. Повышенное содержание адреналина и электростимуляция мышцы приводят к образованию активной a-формы.
5. Спиртовое брожение.
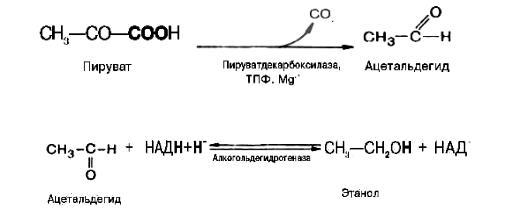
Спиртовое брожение осуществляется так называемыми дрожжеподобными организмами, а также некоторыми плесневыми грибками.
Механизм процесса спиртового брожения чрезвычайно близок к гликолизу. Расхождение начинается лишь после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента NADH восстанавливается в лактат. При спиртовом брожении этот конечный этап заменен двумя другими ферментативными реакциями: пируватдекарбоксилазной и алкогольдегидрогеназной. В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная необратимая реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов Mg2+ и кофермента (TРP):
Образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от NADH, восстанавливаясь при этом в этанол. Реакция катализируется ферментом алкогольдегидрогеназой:
Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не молочная кислота, как при гликолизе.
6. Пентозофосфатный путь окисления глюкозы.
Пентозофосфатный путь (ПФП), называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-б-фосфата.
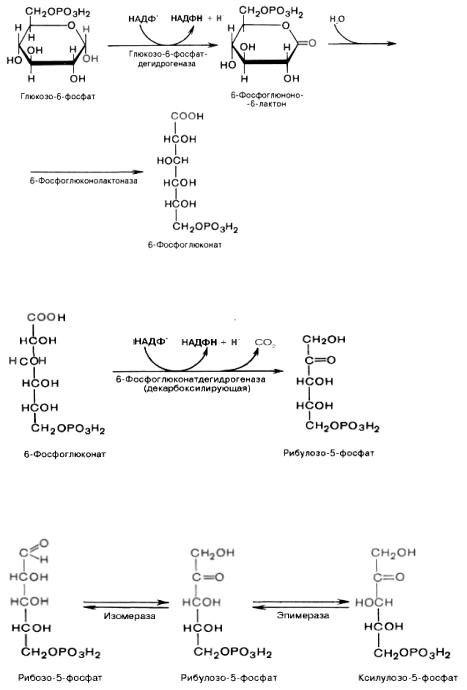
Пентозофосфатный цикл начинается с окисления глюкозо-6-фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла. Вторая стадия включает неокислительные превращения пентозофосфатов с образованием исходного глюкозо-6-фосфата.
Значение ПФП в обмене веществ велико. Он поставляет восстановленный NADPH, необходимый для биосинтеза жирных кислот, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50%
покрывается потребность организма в NADPH. Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов.
Отдельные реакции:
1. Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6- фосфатдегидрогеназы (Г6ФДГ) и кофермента NADP+. Образовавшийся в ходе реакции 6- фосфоглюконо- - лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-D-фосфоглюконолактоназы с образованием 6- фосфоглюконовой кислоты (6-фосфоглюконат): Показано, что NADP+ способствует стабилизации Г6ФДГ и сохранению её в активном состоянии, а NADPH – продукт реакции, является сильным ингибитором Г6ФДГ, вызывающим диссоциацию белковой молекулы. Кроме того, ингибировать активность Г6ФДГ могут АТP и 2,3-бисфосфоглицерат (в меньшей степени).
2. Во второй окислительной реакции, катализируемой 6- фосфоглюконатдегидрогеназой (декарбоксилирующей), 6-фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза ‒ D-рибулозо-5-фосфат и еще 1 молекула NADPH:
Под действием соответствующей эпимеразы из рибулозо-5-фосфата может образоваться другая фосфопентоза ‒ ксилулозо-5-фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:
При определенных условиях пентозофосфатный путь на этом этапе может быть завершен. Однако при других условиях наступает так называемый неокислительный этап пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом частично образуются вещества, характерные для первой стадии гликолиза (фруктозо-6-фосфат, фруктозо-l,6-бисфосфат, фосфотриозы).
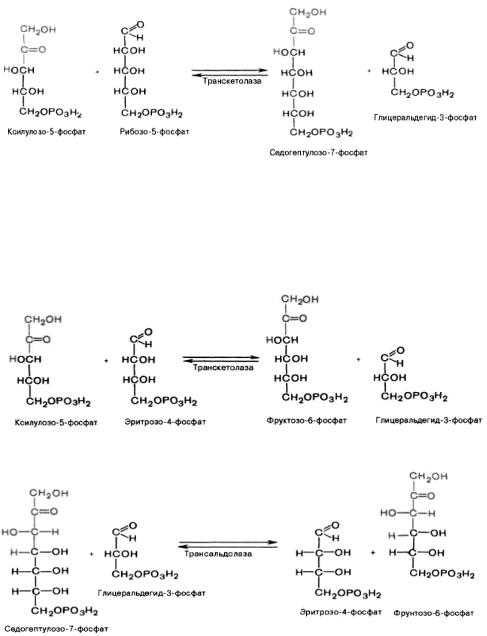
Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов:
Коферментом в транскетолазной реакции служит тиаминпирофосфат, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5- фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
Транскетолазная реакция в пентозном цикле встречается дважды (второй раз – при образовании фруктозо-6-фосфата и триозофосфата в результате взаимодействия второй молекулы ксилулозо-5- фосфата с эритрозо-4-фосфатом):
Фермент трансальдолаза катализирует перенос остатка диоксиацетона (но не свободного диоксиацетона) от седогептулозо-7-фосфата на глицеральдегид-3-фосфат:
Шесть молекул глюкозо-6-фосфата, вступая в пентозофосфатный цикл, образуют 6 молекул рибулозо- 5-фосфата и 6 молекул СО2, после чего из шести молекул рибулозо-5-фосфата снова регенерируется пять молекул глюкозо-6-фосфата Валовое уравнение окислительной и неокислительной стадий пентозофосфатного цикла можно представить в следующем виде:
6Глюкозо-6-фосфат + 7Н2О + 12 NADP+ =5 Глюкозо-6-фосфат + 6СО2 + Рi + 12 NADPH + 12Н+ или
Глюкозо-6-фосфат + 7Н2О + 12 NADP+ =6СО2 + Рi + 12 NADPH + 12Н+
Образовавшийся NADPH используется в цитозоле на восстановительные синтезы и, как правило, не участвует в окислительном фосфорилировании, протекающем в митохондриях.
