
- •Оглавление
- •Предисловие
- •Лекция 1 предмет и значение химии
- •Лекция 2 Основные законы химии
- •§ 2. Стехиометрические законы. Химический эквивалент. Основу атомно-молекулярного учения составляет основные законы химии, открытые на рубеже XVIII и XIX вв.
- •Лекция 3 Строение атома
- •Электронные конфигурации атомов
- •Лекция 4, 5 Химическая связь
- •Лекция 6 Периодический закон д.И. Менделеева
- •§ 4. Закономерности периодичности свойств химических элементов и соединений. Периодичность фундаментальных параметров атомов хорошо иллюстрируются рис. 6.1, 6.2.
- •Лекция 7, 8 Химическая термодинамика
- •Классификация термодинамических систем
- •Классификация термодинамических процессов
- •Лекция 9 Химическая кинетика и катализ. Химическое равновесие
- •Лекция 10 Растворы
- •Лекция 11, 12 растворы электролитов. ЭлектролитическАя диссоциациЯ
- •Лекция 13 Окислительно-восстановительные реакции
- •§ 1. Степень окисления. Одним из основных понятий в химии, широко использующимся при составлении уравнений овр, является степень окисления (с.О.) атомов.
- •Лекция 14 Электрохимические процессы и системы
- •Лекция 15 коррозия металлов и защита от коррозии
- •§ 3. Защита от коррозии. Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
- •Лекция 16 координационные соединения
- •Лекция 17 Обзор химических свойств элементов
- •Дополнение к лекции 12 о структуре воды и растворов
- •Лекция 18 Основы кристаллохимии
- •Рисунки к лекции 3.
- •Литература
- •Курс лекций по общей химии: Учеб. Пособие для вузов.
§ 4. Закономерности периодичности свойств химических элементов и соединений. Периодичность фундаментальных параметров атомов хорошо иллюстрируются рис. 6.1, 6.2.
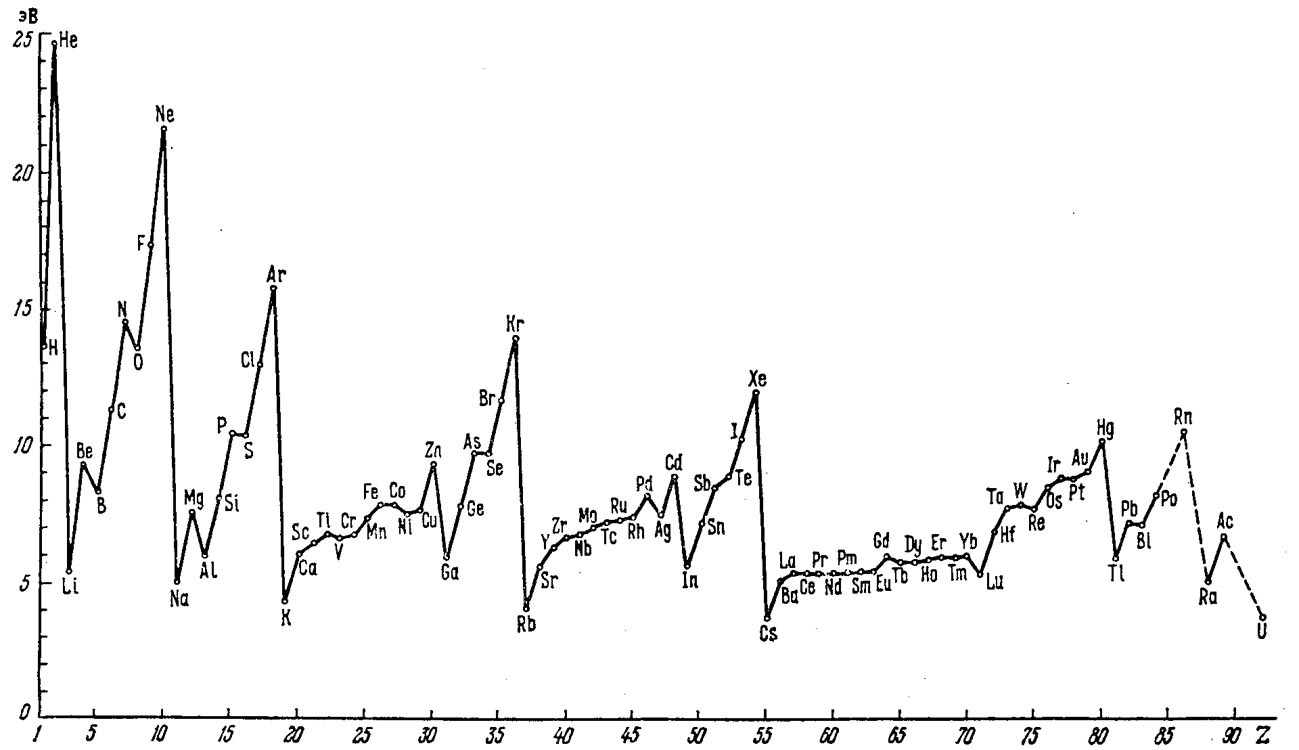
Рис. 6.1. Зависимость энергии ионизации атомов от атомного номера элемента.
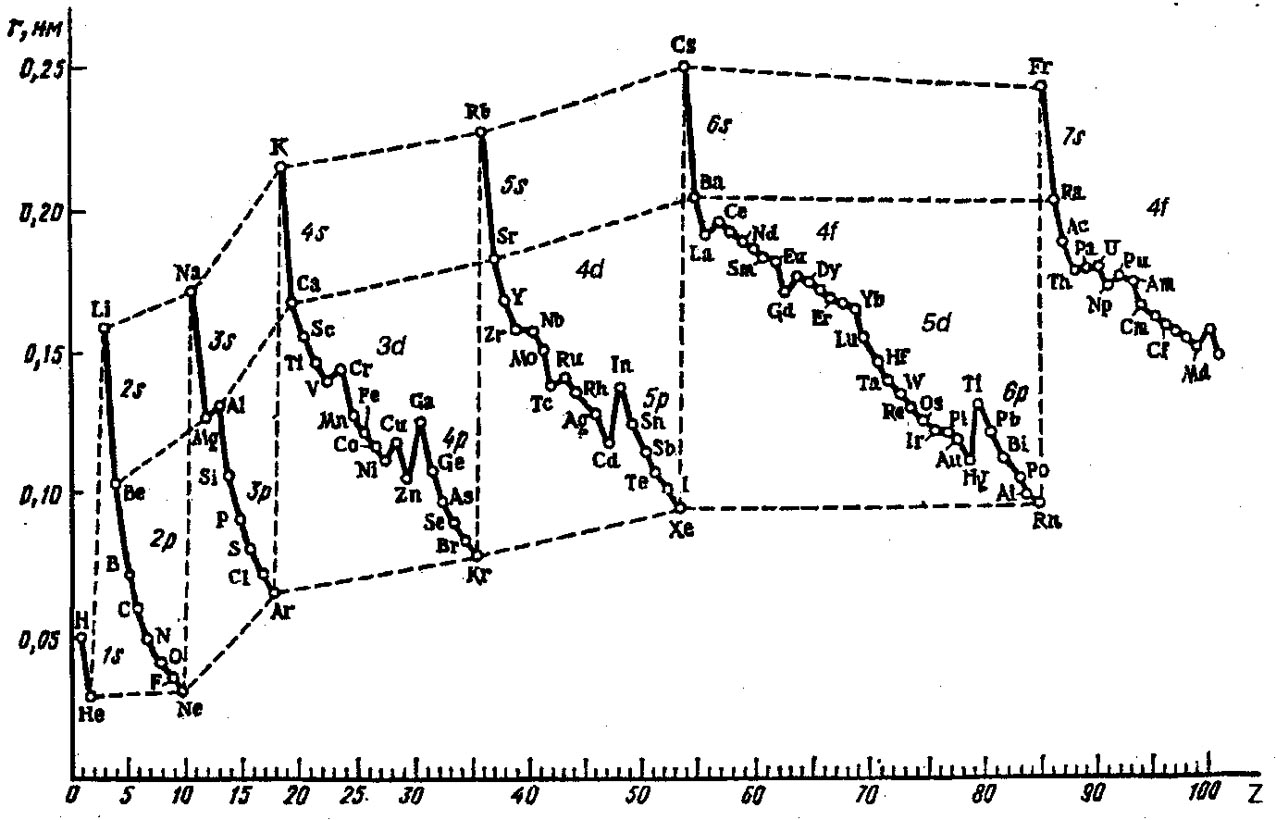
Рис. 6.2. Зависимость орбитальных радиусов атомов от атомного номера элемента.
На начало III тысячелетия открыто 114 элементов, но IUPAC утвердило названия для 104 – резерфордий, 105 – дубний, 106 – сиборгий, 107 – борий, 108 – хассий, 109 – мейтнерий, 110 – дармштадтий.
|
Лекция 7, 8 Химическая термодинамика
§ 1. Основные понятия и определения. Термодинамика – это наука, изучающая общие закономерности протекания процессов, сопровождающихся выделением, поглощением и превращением энергии. Химическая термодинамика изучает взаимные превращения химической энергии и других ее форм – тепловой, световой, электрической и т.д., устанавливает количественные законы этих переходов, а также позволяет предсказать устойчивость веществ при заданных условиях и их способность вступать в те или иные химические реакции. Термохимия, являющаяся разделом химической термодинамики, изучает тепловые эффекты химических реакций.
Объект термодинамического рассмотрения называют термодинамической системой или просто системой. Система – это рассматриваемое нами тело или группа тел, отделенная от всего окружающего (внешней среды) реально или мысленно. Выбор границ системы довольно произволен, однако должен быть правильным и неизменным в течение всего рассуждения. По отношению к внешней среде термодинамические системы можно разделить на четыре группы:
Таблица 7.1
Классификация термодинамических систем
Вид системы |
Характеристика |
Примеры |
Открытая |
Возможен обмен с внешней средой веществом и энергией |
Человеческое тело |
Замкнутая |
Невозможен обмен с внешней средой веществом, возможен обмен энергией |
Закрытая колба с реагентами |
Изолированная |
Невозможен обмен с внешней средой ни веществом, ни энергией |
Термос, сосуд Дьюара |
Адиабатически изолированная |
Невозможен обмен с внешней средой тепловой энергией, возможен обмен веществом |
|
Одна и та же система может находиться в различных состояниях. Каждое состояние системы характеризуется определенным набором значений термодинамических параметров. К термодинамическим параметрам относятся температура, давление, плотность, концентрация и т.п. Изменение хотя бы только одного термодинамического параметра приводит к изменению состояния системы в целом. При постоянстве термодинамических параметров во всех точках системы (объема) термодинамическое состояние системы называют равновесным.
Различают гомогенные и гетерогенные системы. Гомогенные системы состоят из одной фазы, гетерогенные – из двух или нескольких фаз. Фаза – это часть системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела. Примером гомогенной системы может служить водный раствор. Но если раствор насыщен и на дне сосуда есть кристаллы солей, то рассматриваемая система – гетерогенна (есть граница раздела фаз). Другим примером гомогенной системы может служить простая вода, но вода с плавающим в ней льдом – система гетерогенная.
§ 2. Внутренняя энергия. Первое начало (первый закон) термодинамики. Мерой внутренней энергии хаотического теплового (Броун) движения частиц в теле служит температура. Если тело А, вступая в контакт с телом В, отдает ему теплоту, то тело А имеет более высокую температуру, чем тело В. В тоже время нулевое начало термодинамики утверждает, что если тело А находится в тепловом равновесии (имеет одинаковую температуру) с телом В и телом С, то температура тел В и С также одинакова. Это начало лежит в основе измерения температуры при помощи термометра. При тепловом равновесии дальнейший обмен тепловой энергией невозможен.
Внутренняя энергия системы представляет собой ее полную энергию, которая складывается из кинетической и потенциальной энергий молекул, атомов, атомных ядер и электронов и представляет собой энергию поступательного, вращательного и колебательного движений частиц. Она не включает потенциальную энергию положения системы в пространстве и кинетическую энергию движения системы как целого. Иными словами потенциальная энергия (U) вещества реализуется за счет разрыва и образования химической связи в теплоту (Q) и совершаемую работу (A).
Таблица 7.2

