
- •Оглавление
- •Предисловие
- •Лекция 1 предмет и значение химии
- •Лекция 2 Основные законы химии
- •§ 2. Стехиометрические законы. Химический эквивалент. Основу атомно-молекулярного учения составляет основные законы химии, открытые на рубеже XVIII и XIX вв.
- •Лекция 3 Строение атома
- •Электронные конфигурации атомов
- •Лекция 4, 5 Химическая связь
- •Лекция 6 Периодический закон д.И. Менделеева
- •§ 4. Закономерности периодичности свойств химических элементов и соединений. Периодичность фундаментальных параметров атомов хорошо иллюстрируются рис. 6.1, 6.2.
- •Лекция 7, 8 Химическая термодинамика
- •Классификация термодинамических систем
- •Классификация термодинамических процессов
- •Лекция 9 Химическая кинетика и катализ. Химическое равновесие
- •Лекция 10 Растворы
- •Лекция 11, 12 растворы электролитов. ЭлектролитическАя диссоциациЯ
- •Лекция 13 Окислительно-восстановительные реакции
- •§ 1. Степень окисления. Одним из основных понятий в химии, широко использующимся при составлении уравнений овр, является степень окисления (с.О.) атомов.
- •Лекция 14 Электрохимические процессы и системы
- •Лекция 15 коррозия металлов и защита от коррозии
- •§ 3. Защита от коррозии. Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
- •Лекция 16 координационные соединения
- •Лекция 17 Обзор химических свойств элементов
- •Дополнение к лекции 12 о структуре воды и растворов
- •Лекция 18 Основы кристаллохимии
- •Рисунки к лекции 3.
- •Литература
- •Курс лекций по общей химии: Учеб. Пособие для вузов.
§ 3. Защита от коррозии. Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
1) обработка внешней (коррозионной) среды;
2) защитные покрытия;
3) электрохимическая защита;
4) изготовление специальных коррозионно-устойчивых сплавов (легирование);
5) рациональное конструирование.
Методы защиты нужно рассматривать, исходя из основной схемы электрохимической коррозии (приведена в «Практикуме» стр.71).
1. Сущность метода «обработка внешней среды» заключается в удалении или понижении активности веществ, способствующих коррозии: а) нейтрализации кислых сред, вызывающих коррозию за счет водородной деполяризации; б) деаэрации – удаление О2 осуществляется кипячением воды, в) продуванием воды инертным газом, г) введением в воду восстановителей, д) добавлением ингибиторов коррозии в раствор.
В качестве ингибиторов в воде и водных растворах применяются некоторые окислители–пассиваторы: нитраты, хроматы, бихроматы, персульфат натрия и пленкообразователи (фосфаты, амины). Замедлители атмосферной коррозии подразделяются на нелетучие (контактные) и летучие (парофазные). Ингибиторы избирательно адсорбируются на анодных или катодных участках и блокируют эти участки, тем самым замедляя или прекращая коррозию. По механизму воздействия ингибиторы разделяются на анионные, катионные и неионогенные.
2.
Защитные покрытия. Роль защитных
покрытий сводится к изоляции металла
от воздействия внешней среды. На
поверхность металла наносятся:
а)
металлические покрытия, они подразделяются
на анодные и катодные. К катодным
покрытиям относятся покрытия, потенциал
которых в данной среде имеет более
положительное значение, чем потенциал
основного металла, например, луженое
железо (рис. 15.1б):
![]() = –0,14 В,
= –0,14 В,
![]() = –0,44 В.
= –0,44 В.
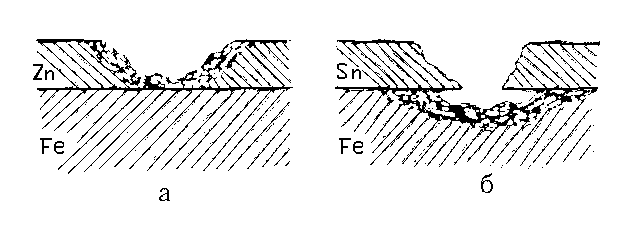
Рис. 15.1. Коррозия железа при нарушении металлических покрытий: а – оцинкованное (анодное покрытие); б – луженое (катодное покрытие).
А: Fe – 2 Fe2+
К: 2H2O + O2 + 4 4OH–
Идет разрушение металла-изделия.
У анодного покрытия покрывающего металла более отрицателен, чем основного (защищаемого) Ме (рис. 15.1а).
![]() = –0,76 В;
= –0,76 В;
![]() = –0,44 В.
= –0,44 В.
А.: Zn – 2 Zn0
К.: 2H2O + O2 + 4 4OH–
Пока защитный слой полностью изолирует основной металл от окружающей среды, принципиального различия между катодными и анодными покрытиями нет. При нарушении целостности анодное покрытие разрушается, а изделие – нет.
Кроме того, к металлическим покрытиям относятся также покрытия, полученные металлизацией – на защищаемое изделие с помощью сжатого воздуха распыляется расплавленный другой металл. Возможность нанесения покрытия на собранные конструкции и хорошее сцепление с основой дает этот метод.
Термодиффузионные покрытия – этот способ широко используется для получения жаростойких покрытий (алитирование, хромирование, титанирование). Изделие помещают в смесь, содержащую порошок покрытия. При высоких температурах происходит диффузия наносимого металла в основной металл-изделие.
Плакирование – покрытие сплава чистым металлом. Толщина плакирующего слоя не превышает 5-10% от толщины сплава.
Воронение – нанесение на сталь оксидных пленок горячим раствором (NaOH + NaNO3) и образование пленки Fe3O4 (FeO, Fe2O3) цвета «воронова крыла».
Фосфатирование – образование фосфатной пленки на стали. Изделие при 95-98С погружают в 3% раствор «мажефа» (Mn(H2PO4)2 и Fe(H2PO4)2) выдерживают в этом растворе до прекращения выделения Н2 с последующей кристаллизацией фосфатов Fe и Mn в виде черного осадка.
Анодирование – Al и Ti и других вентельных металлов с образованием оксидной пленки.
Органические покрытия: лаки, краски, эмали на основе органических полимеров; гуммирование – нанесение на металл сырой резины с последующей вулканизацией и образованием покрытия на металле.
3. Метод электрохимической защиты основан на торможении анодных или катодных реакций коррозионного процесса.
Уменьшение или полное прекращение коррозии достигается созданием на защищаемом изделии высокого электроотрицательного потенциала.
а) протекторная защита – защищаемое изделие соединяют с металлом, имеющим высокий электроотрицательный потенциал.
![]() .
Протектор является анодом и растворяется,
защищаемое изделие – катод. Например,
корпус морского корабля (сталь) –
протектор может быть Al, Mg, Zn.
.
Протектор является анодом и растворяется,
защищаемое изделие – катод. Например,
корпус морского корабля (сталь) –
протектор может быть Al, Mg, Zn.
А.: Mg – 2 Mg2+
К.: 2H2O + O2 + 4 4OH–
б) катодная защита – защищаемое изделие подключается к отрицательному полюсу внешнего источника тока, он становится катодом, а анодом служит вспомогательный металлический электрод. Анод растворяется, на защищаемом изделии (катоде) выделение Н2:
А.: Ме – n Men+;
К.: 2H+ + 2 H2.
Коррозию подземных сооружений вызывают так называемые «блуждающие токи». Они обусловлены утечкой постоянного тока с рельсов электрического транспорта в землю. Место входа «блуждающего тока» в подземное металлическое сооружение является катодом, а место выхода из него – анодом. Для защиты от коррозии находят анодный участок методом дренажа и соединяют его с источником «блуждающего тока» (трамвайным рельсом), тогда весь ток проходит по этому проводнику и коррозия не происходит.
4. Изготовление специальных коррозионноустойчивых сплавов (легирование). Легирование – это введение при выплавке основного металла коррозионноустойчивых компонентов, вызывающих пассивацию металла. Сталь легируют: Cr, Mo, Ni, Co и другими металлами. Легирующие компоненты добавляются согласно правила Таммана – порог коррозионной устойчивости кратен 1/8 атомной доли легирующего компонента.
5. Рациональное конструирование. При конструировании важно предвидеть контактирующие детали металлического сооружения, которые могут подвергнуться интенсивной коррозии. В многоэлектродном элементе разделение на катод и анод не столь однозначно, как у двухэлектродных систем и полярность электродов может изменяться в зависимости от условий. Важно отметить, что железо, как основной металл, подвергающийся коррозии, необходимо «сделать» катодом.
Итак, коррозию металла можно затормозить или даже прекратить. Выбор способа защиты определяется его эффективностью, а также экономической целесообразностью.
