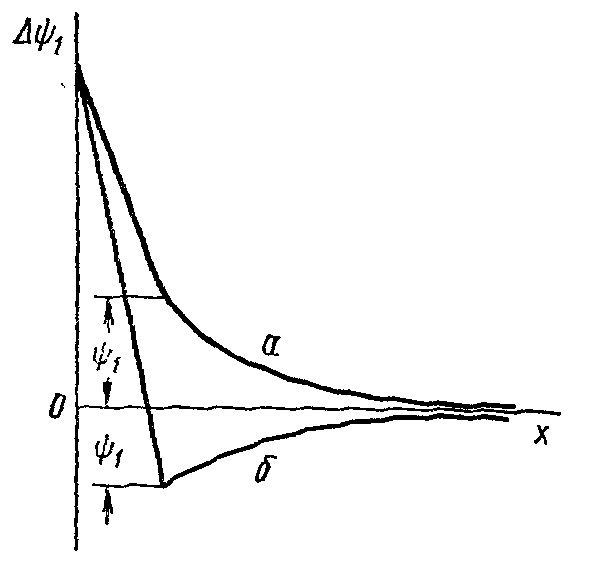- •Оглавление
- •Предисловие
- •Лекция 1 предмет и значение химии
- •Лекция 2 Основные законы химии
- •§ 2. Стехиометрические законы. Химический эквивалент. Основу атомно-молекулярного учения составляет основные законы химии, открытые на рубеже XVIII и XIX вв.
- •Лекция 3 Строение атома
- •Электронные конфигурации атомов
- •Лекция 4, 5 Химическая связь
- •Лекция 6 Периодический закон д.И. Менделеева
- •§ 4. Закономерности периодичности свойств химических элементов и соединений. Периодичность фундаментальных параметров атомов хорошо иллюстрируются рис. 6.1, 6.2.
- •Лекция 7, 8 Химическая термодинамика
- •Классификация термодинамических систем
- •Классификация термодинамических процессов
- •Лекция 9 Химическая кинетика и катализ. Химическое равновесие
- •Лекция 10 Растворы
- •Лекция 11, 12 растворы электролитов. ЭлектролитическАя диссоциациЯ
- •Лекция 13 Окислительно-восстановительные реакции
- •§ 1. Степень окисления. Одним из основных понятий в химии, широко использующимся при составлении уравнений овр, является степень окисления (с.О.) атомов.
- •Лекция 14 Электрохимические процессы и системы
- •Лекция 15 коррозия металлов и защита от коррозии
- •§ 3. Защита от коррозии. Причины, вызывающие коррозионные разрушения, многочисленны. Соответственно, разнообразны и методы защиты. Основная схема электрохимической коррозии диктует и методы защиты:
- •Лекция 16 координационные соединения
- •Лекция 17 Обзор химических свойств элементов
- •Дополнение к лекции 12 о структуре воды и растворов
- •Лекция 18 Основы кристаллохимии
- •Рисунки к лекции 3.
- •Литература
- •Курс лекций по общей химии: Учеб. Пособие для вузов.
Лекция 14 Электрохимические процессы и системы
Процессы взаимного превращения химической и электрической форм энергии, протекающие на электродах (Ox/Red) реакции называются электрохимическими, их можно рассматривать как:
1. Самопроизвольные процессы, при которых химическая энергия превращается в электрическую. Сюда относятся химические источники тока (гальванические элементы), а также коррозионные процессы.
2. Электролиз – несамопроизвольный процесс, происходящий под действием внешнего источника постоянного электрического тока, при котором на электродах образуются новые вещества.
Особенности
электрохимических процессов в том, что
все они происходят на границе раздела
двух фаз – твердая–жидкая – это
электрод-электролит и являются Ox/Red
реакциями. Ox/Red
процессы определяются электродным
потенциалом Ox/Red
пары на электроде, напомним что на аноде
идет процесс окисления, на катоде
наоборот – восстановление, ЭДС процесса
определяется как разность между
![]() и
и
![]() и его величина зависит от местоположения
металлов в ряду электрохимической
активности (напряжений).
и его величина зависит от местоположения
металлов в ряду электрохимической
активности (напряжений).
§ 1. Электродный потенциал металла. Двойной электрический слой. Электродом (первого рода) называют любой металл (или токопроводящий материал), погруженный в раствор электролита. Между ними существует подвижное равновесие, которое можно выразить уравнением Me ⇄ Men++n .
При погружении же металла в раствор начинается сложное взаимодействие металла с компонентами раствора электролита. Если энергия кристаллической решетки металла (Екрист) меньше энергии гидратации (Егидр) – Екрист < Егидр, то образующиеся ионы металла гидратируются и переходят в раствор, на поверхности металла устанавливается равновесие: Me+mH2O ⇄ Men+·mH2O+n . При этом скорости прямого и обратного переходов ионов будут равны. Процесс перехода атомов металла электрода в раствор связан с потерей электронов и образованием положительно заряженных ионов, т.е. происходит окисление (Me – n Men+), обратный процесс – восстановление Men++n Me0.
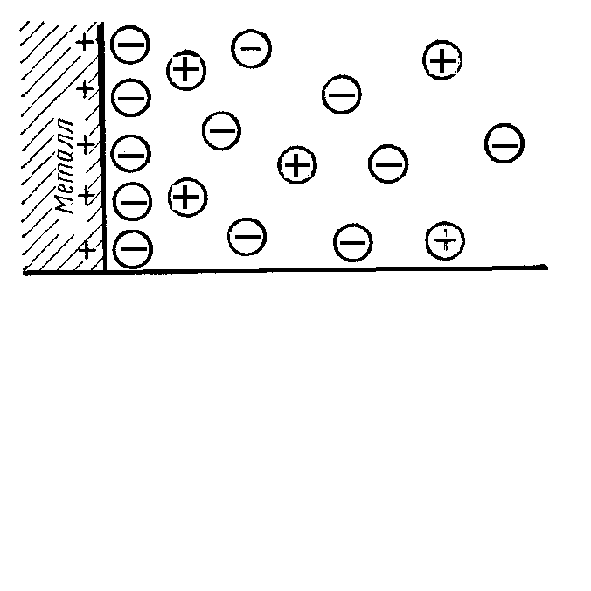
При равенстве скоростей прямого и обратного процессов ок = восст электрод находится в равновесном состоянии. Положение равновесия зависит как от энергии ионизации атома металла, так и от концентрации его ионов в растворе. Гидратированные ионы металла, находящиеся у его поверхности и оставшиеся на металле избыточные электроны образуют две противоположно заряженные плоскости, аналогичные обкладке плоского конденсатора – возникает двойной электрический слой (рис. 14.1). Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
Рис. 14.1. Схема двойного электрического слоя на границе раздела металл/раствор. |
|
Часть двойного электрического слоя, которая образуется непосредственно прилегающими к электроду ионами, называется плотной частью двойного слоя (слой Гельмгольца). Толщина плотного слоя равна радиусу гидратированных ионов. В этой части имеет место линейное изменение потенциала между электродом и плоскостью, проходящей через центры прилегающих к нему ионов. Часть двойного электрического слоя, расположенная за плотной частью, называется диффузной (слой Гуи-Чапмена). Изменение потенциала в ней нелинейно. Полный скачок потенциала на границе электрода с электролитом слагается из суммы скачков потенциалов в плотной и диффузной частях двойного электрического слоя. В 1924 г. Штерн предложил адсорбционную теорию двойного электрического слоя. Он полагал, что определенная часть ионов удерживается вблизи поверхности раздела металл-электролит, образуя плотную гельмгольцевскую обкладку двойного слоя, с толщиной, отвечающей среднему радиусу ионов электролита, остальные ионы распределяются диффузно с постепенно убывающей плотностью заряда. Дальнейшее развитие теории строения двойного электрического слоя было дано в работах Фрумкина и его школы. По их мнению, в плотной части двойного слоя следует различать внутренний и внешний гельмгольцевские слои. Внутренний слой образован специфически адсорбированными ионами, частично или полностью дегидратированными и образующими диполи с металлом, во внешнем плотном слое находятся гидратированные ионы, притянутые к поверхности металла электростатическими слоями. Непосредственно за внешним гельмгольцевским следует диффузный слой.
Переход ионов металла с электрода в
раствор приводит к равновесному состоянию
системы. Потенциал, устанавливающийся
в условиях равновесия (![]() ),
называется равновесным электродным
потенциалом и зависит от свойств металла,
концентрации его ионов в растворе.
Абсолютные значения электродных
потенциалов определить экспериментально
невозможно. Поэтому пользуются
относительными значениями электродных
потенциалов. Для этого находят разность
потенциалов измеряемого электрода и
электрода, потенциал которого условно
принимают равным нулю.
),
называется равновесным электродным
потенциалом и зависит от свойств металла,
концентрации его ионов в растворе.
Абсолютные значения электродных
потенциалов определить экспериментально
невозможно. Поэтому пользуются
относительными значениями электродных
потенциалов. Для этого находят разность
потенциалов измеряемого электрода и
электрода, потенциал которого условно
принимают равным нулю.
В настоящее время за нуль отчета принят потенциал стандартного водородного электрода. Он состоит из платинированной платины, контактирующей с газообразным водородом и раствором HCl с СН+=1 моль/л, р = 1атм, T = 298 К (25С), рН = 0. Возникает скачок потенциала за счет реакции 2Н++2 ⇄ Н2 между платиной и раствором.
Более подробно процессы, происходящие на платиновом электроде, можно представить схемой:
H2 (г.) ⇄
H2 (адс. Pt)
⇄ 2H
(адс. Pt)
![]() 2H+
(адс. Pt) ⇄
2H+
(р-р)
2H+
(адс. Pt) ⇄
2H+
(р-р)
Обычно промежуточные стадии при кратком описании не приводят, но нужно помнить, что без развитой поверхности черненого платинового электрода равновесие между газовой фазой и раствором устанавливалось бы слишком долго.
Здесь уместно напомнить уравнение Нернста:
![]() (14.1)
(14.1)
Стандартным электродным потенциалом
металла
![]() называют потенциал, который возникает
на границе между металлом и раствором
его соли с концентрацией ионов металла
называют потенциал, который возникает
на границе между металлом и раствором
его соли с концентрацией ионов металла
![]() =1
моль/л при стандартных условиях, эта
величина табулирована. Это количественная
характеристика способности металла
окисляться или восстанавливаться.
=1
моль/л при стандартных условиях, эта
величина табулирована. Это количественная
характеристика способности металла
окисляться или восстанавливаться.
![]() измеряется относительно стандартного
водородного электрода. Таким образом
измерены стандартные потенциалы
для всех металлов и они расположены в
порядке возрастания величин этих
потенциалов. Ряд стандартных электродных
потенциалов называется рядом напряжений
или рядом электрохимической активности
металлов. Исходя из этого ряда можно
сделать выводы: чем меньше
,
тем выше активность металла к окислению,
а его ионам труднее восстанавливаться.
Чем больше
,
тем металл труднее окисляется, а ионы
легче восстанавливаются.
измеряется относительно стандартного
водородного электрода. Таким образом
измерены стандартные потенциалы
для всех металлов и они расположены в
порядке возрастания величин этих
потенциалов. Ряд стандартных электродных
потенциалов называется рядом напряжений
или рядом электрохимической активности
металлов. Исходя из этого ряда можно
сделать выводы: чем меньше
,
тем выше активность металла к окислению,
а его ионам труднее восстанавливаться.
Чем больше
,
тем металл труднее окисляется, а ионы
легче восстанавливаются.
В электрохимии используются металлические и газовые электроды.
Металлический
электрод. При погружении металла в
раствор собственных ионов устанавливается
равновесие Me ⇄
Men++n
.
Для его измерения нужен гальванический
элемент H2 Pt|H+Men+M.
Токообразующей в этом элементе будет
реакция Men++![]() H2
⇄ Me+nH+.
Скачок потенциала на границе Ме/электролит
определяется по уравнению (14.1). Если
электрод инертный (графитовый, угольный,
Pt), то он является только
передатчиком электронов, но в реакции
сам не участвует.
H2
⇄ Me+nH+.
Скачок потенциала на границе Ме/электролит
определяется по уравнению (14.1). Если
электрод инертный (графитовый, угольный,
Pt), то он является только
передатчиком электронов, но в реакции
сам не участвует.
Газовые электроды состоят из
металлического проводника, контактирующего
одновременно с газом и раствором,
содержащим ионы этого газа. Металлический
проводник служит для отвода и подвода
.
Наиболее часто используются водородный
и кислородный газовые электроды. Скачок
потенциала водородного электрода
возникает на границе Н2/Н+
и потенциалоопределяющей является
реакция 2H++2
⇄ H2,
выражающая равновесие на водородном
электроде.
![]() в нестандартных условиях можно рассчитать
по уравнению (10.1), используя парциальное
давление вместо концентрации водорода
и при
в нестандартных условиях можно рассчитать
по уравнению (10.1), используя парциальное
давление вместо концентрации водорода
и при
![]() =1
моль/л, рН=0.
=1
моль/л, рН=0.
![]() определяется по формуле
определяется по формуле
![]() =–0,059рН.
=–0,059рН.
Аналогично водородному можно создать
и кислородный электрод. Для этого
необходимо Pt пластинку
привести в контакт с O2
и раствором, содержащим ионы ОН–.
Скачок потенциала происходит на границе
О2/ОН– и протекают процессы
4Н+ + О2 + 4
⇄ 2H2O,
2H2O +
О2 + 4
⇄ 4ОН–,
потенциал определяет по уравнению;
![]() =
1,23 – 0,059 рН.
=
1,23 – 0,059 рН.
§ 2. Химические источники тока. Химические источники тока (ХИТ) представляют устройства, в которых химическая энергия Ox/Red реакции превращается в электрическую. ХИТы по принципу действия делятся на первичные – гальванические элементы, и вторичные – аккумуляторы.
Для получения электрического тока Ox/Red процессы должны быть пространственно разделены и система замкнута. Процесс окисления протекает на аноде (на электроде с более электроотрицательным потенциалом), восстановление – на катоде (на электроде с более электроположительным потенциалом). Название электродов определяются протекающими на них процессами.
ЭДС ХИТ равна разности потенциалов катода – (k) и анода – (a). При отсутствии тока в цепи: ЭДС = k0 – a0.
В процессе работы ХИТа его ЭДС может уменьшаться, что вызвано изменением потенциалов катода и анода при протекании электрического тока из-за поляризации электродов. Процесс уменьшения поляризации называется деполяризацией.
k0, a0
– потенциалы электродов без тока;
![]() –
смещение потенциала анода в положительную
область;
–
смещение потенциала анода в положительную
область;
![]() – смещение потенциала катода в
отрицательную область под током. ЭДС0
= k0
– a0;
ЭДС’=
– смещение потенциала катода в
отрицательную область под током. ЭДС0
= k0
– a0;
ЭДС’=![]() ;
Епол=a+k.
Напряжение гальванического элемента
U<ЭДС из-за поляризации
электродов и омических потерь. Напряжение
ХИТ или напряжение на клеммах при
электролизе представляет алгебраическую
сумму:
;
Епол=a+k.
Напряжение гальванического элемента
U<ЭДС из-за поляризации
электродов и омических потерь. Напряжение
ХИТ или напряжение на клеммах при
электролизе представляет алгебраическую
сумму:
U = [(![]() )+I(r1+r2)] (14.2)
)+I(r1+r2)] (14.2)
Знак «–» перед
уравнением относится к ХИТ, а «+» к
электролизу, r1
и r2
– сопротивление проводников 1-го и 2-го
рода. При замыкании цепи I
=
![]() значительно меньше, чем I1
=
значительно меньше, чем I1
=
![]() ,
r1+r2=const.
Следовательно основная причина
неравенства I<I1
вызвана изменением k
и a
при прохождении тока. Подробно
гальванические элементы рассмотрены
в «Практикуме». Здесь же мы проиллюстрируем
как записывается на «электрохимическом
языке» работа и устройство элемента
Якоби–Даниэля.
,
r1+r2=const.
Следовательно основная причина
неравенства I<I1
вызвана изменением k
и a
при прохождении тока. Подробно
гальванические элементы рассмотрены
в «Практикуме». Здесь же мы проиллюстрируем
как записывается на «электрохимическом
языке» работа и устройство элемента
Якоби–Даниэля.
А ZnZnSO4CuSO4Cu К
CuSO4 + Zn = ZnSO4 + Cu; Cu2++ SO42– + Zn0 = Zn2+ + SO42– + Cu0
окис: Zn – 2 Zn2+
восcт: Cu2+ + 2 Cu
Cu2+ + Zn0 = Zn2+ + Cu0
Отметим дополнительно, как устроен концентрационный гальванический элемент (у которого электроды одни и те же, но концентрация электролита в при электродном пространстве разная).
Ag (I)AgNO3AgNO3Ag (II) C1<<C2
А.: Ag – Ag+ (I)
К.: Ag+ + Ag0 (II)
Нетрудно убедиться, используя уравнение Нернста, что возникнет разность потенциалов.
Условия, необходимые для построения любого гальванического элемента: 1) наличие проводников 1-го рода (металлы) и 2-го рода (электролиты) (электронная и ионная проводимость); 2) возможность разделения системы электродов на две неравноценные части, т.е. разделены мембраной или электролитическим ключом.
Работа и устройства гальванических элементов, а также аккумуляторов и топливных элементов приведены в «Практикуме». Отметим лишь, что в аккумуляторах возможно протекание двух противоположно направленных процесса: выработка электрической энергии за счет окислительно-восстановительной реакции, протекающей на электродах, или разрядка и противоположный – зарядка, а по сути – электролиз. Должно быть понятным, что необходимым условием работы аккумулятора является обратимость процесса, чему удовлетворяют реакции диспропорционирования (например, 2PbSO4 + 2H2O ⇄ PbO2 + Pb + 2H2SO4) и неизменность концентрации ионов на электродах, последнее достигается когда ионы входят в состав труднорастворимых соединений.
Топливные элементы (электрохимические генераторы), в основе работы которых лежит реакция окисления топлива на электродах. Простейший и самый значимый топливный элемент основан на реакции окисления водорода кислородом: 2H2 + O2 = 2H2O. Его схему работы можно записать
H2, MKOHM, O2
M – проводник первого рода (токоотвод).
A.: 2ОН–+Н2 – 2 = 2H2O
K.: ![]() О2
+ H2O
+ 2
= 2ОН–
О2
+ H2O
+ 2
= 2ОН–
H2 + ½O2 = 2H2O
В результате протекания этой реакции в цепи генерируется постоянный ток и химическая энергия превращается в электрическую.
§ 3. Электролиз. ОВР, протекающие на электродах при прохождении через электролит электрического тока – электролиз. Для осуществления электролиза необходимы: 1) источник постоянного тока (стационарный электролиз); 2) электролит – водный раствор или расплав; 3) электроды.
Электрод, соединенный с отрицательным полюсом источника тока называется катод, на нем идет процесс восстановления (присоединения электронов), находящихся в растворе ионов металла или ионов водорода (как восстановление воды). Катод является лишь передатчиком электронов. Электрод, соединенный с положительным полюсом источника тока, называется анодом, на нем происходит процесс окисления (отдача электронов). Аноды бывают: растворимые и нерастворимые, инертные, они служат для отвода электронов. В качестве нерастворимых анодов используются графит, уголь, Pt. На аноде: выделяется анион электролита (2Cl–– 2 Cl2), окисление воды (2H2O – 4 О2 + 4Н+), или ионов гидроксила (4ОН– – 4 2H2O + О2).
Количественные законы электролиза были установлены Фарадеем.
Первый закон. Масса веществ, выделившихся при электролизе на электродах, пропорциональна количеству прошедшего через раствор электричества и не зависит от его концентрации и температуры
m = kq или m = kI (14.3)
где m – масса металла, г; k – электрохимический эквивалент; I – сила тока, А; – время электролиза, с; q – количество электричества = I. Электрохимическим эквивалентом металла называется его масса, выделяющаяся на электроде при прохождении 1 кулон электричества, и характеризует природу металла.
Второй закон. Равные количества электричества выделяют при электролизе массы веществ, пропорциональные их химическим эквивалентам:
![]() ,
тогда объединенный закон:
,
тогда объединенный закон:
![]() (14.4)
(14.4)
где М – молекулярная масса; n – валентность металла; хэ = М/n; F – число Фарадея.
Из объединенного закона Фарадея следует, что nF – количество электричества, необходимое для выделения 1 моль атома металла или генерируемое гальваническим элементом при растворении такого же количества металла. Работа электрического тока (А), генерируемого в ХИТ при растворении 1 моль металла, равна А = nFE, где E = ЭДС ХИТ.
При расчетах электролиза вводится понятие плотность тока i – это отношение силы тока I к площади образца S
![]() (14.5)
(14.5)
Наименьшее напряжение, при котором начинается процесс электролиза, называется напряжением разложения (U) данного электролита при данных условиях. Теоретически для электролиза достаточно было бы напряжения, равного ЭДС ХИТ., составленного из этих электродов, но имеющего противоположное направление, но на практике напряжение разложения больше, чем ЭДС ХИТ. Разность между напряжением, фактически необходимым для электролиза, и ЭДС ХИТ, называется перенапряжением (поляризацией) при электролизе ()
= U – ЭДС (14.6)
где U – напряжение разложения; ЭДС – ХИТ, отвечающего этой системе.
Выделительным потенциалом называется тот минимальный потенциал, при котором начинается фактический разряд ионов, который на величину перенапряжения превышает равновесный потенциал.
Любая электрохимическая реакция протекает минимум в 3 стадии: а) подвод реагентов к электроду; б) собственно электрохимическая реакция; в) отвод продуктов реакции от электродов.
Возникновение поляризации обусловлено замедленностью отдельных стадий процесса. В зависимости от характера замедленной стадии возникает концентрационная или электрохимическая поляризация. Концентрационная поляризация вызвана разностью концентраций ионов в объеме и приэлектродном слое (а, б – стадии). Изменение потенциала, обусловленное замедленностью электрохимической реакции (б), называется электрохимической поляризацией или перенапряжением – это превышение потенциала разряда ионов над нормальным потенциалом в равновесных условиях. Количественно связь между и i выражается формулой Тафеля:
= (а + bi) (14.7)
где – перенапряжение; a, b – константы, зависят от природы материала, температуры.
Наиболее полно
изучено для ионов Н+ ![]() и отвечает процессу 2Н++2
=Н2
на катоде; к
смещается в (–)-область под током.
Перенапряжению кислорода
и отвечает процессу 2Н++2
=Н2
на катоде; к
смещается в (–)-область под током.
Перенапряжению кислорода ![]() отвечает процесс 4ОН––4
2H2O+О2
и а' смещается
в (+) область.
отвечает процесс 4ОН––4
2H2O+О2
и а' смещается
в (+) область.
§ 4. Электродные процессы при электролизе. Катодные процессы. Последовательность катодных процессов диктуется закономерностями Ox/Red реакций. На катоде первоначально разряжается тот ион, который характеризуется наиболее электроположительным потенциалом, т.е. наиболее сильные окислители. Все окислители условно можно разделить на 3 группы в соответствии с расположением металлов в ряду электрохимической активности 0 стандартных потенциалов. При электролизе водных растворов солей металлов, расположенных правее водорода (Ме> ) на катоде восстанавливаются ионы металла (Cu2++2 Cu), Вторая группа металлов расположена левее H2 до Mn, на катоде возможно одновременное восстановление и Н2 (или Н2О), и иона металла. Здесь необходимо учитывать и зависимость от рН. Третья группа металлов расположена левее Mn, при электролизе их можно получить только из расплавов.
Последовательность анодных процессов при электролизе также диктуется закономерностями ОВР. Возможны следующие реакции:
1) растворение металла Me – n Men+;
2) образование оксидных покрытий Me2+ + 2ОН– MeО+ Н2О;
3) окисление анионов или Н2О.
На аноде первоначально протекает процесс, который характеризуется наименьшей величиной потенциала. При электролизе водных растворов с нерастворимым анодом необходимо руководствоваться рядом окисления анионов. При электролизе солей водных растворов бескислородных кислот разряжаются ионы I–, Br–, Cl–, а не молекулы Н2О. При электролизе солей, содержащих анионы NO3–, CO42–, PO43– на аноде окисляются молекулы Н2О или ОН– из-за высокого перенапряжения кислороды ( ).
Рассмотрим электролиз водного раствора NaCl, рН=7. Анод нерастворимый.
К.: 2H2O + 2 H2+2OH–
А.: 2Cl– – 2 Cl2 (потенциал меньший), 2OH– – 2 H2O+O
При электролизе расплава NaCl (графитовые электроды) идет разложение NaCl = Na+ + Cl–, под током:
К.: Na– + Na0 – восстановление
А.: 2Cl– – 2 Cl2 – окисление.
Значение электролиза трудно переоценить, он имеет многочисленные и значительные прикладные аспекты (прикладная электрохимия): гальванотехника, гальваностегия, гальванопластика, электроэкстракция и др. Но это является предметом отдельного курса.