
- •1. Вступ
- •1.1. Предмет і мета дисципліни "Фізична хімія"
- •1.4. Тематичний план та зміст лекційного курсу
- •1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
- •2. Домашні розрахункові завдання
- •2.1. Завдання 1 (варіант а)
- •2.2. Приклади розв’язання задач.
- •Розв’язання
- •Розв’язання
- •Розв’язання Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Рівноважна х Константа рівноваги Кn має такий вираз
- •Розв’язання Якщо тепловий ефект δн не залежить від температури, тоді його значення можна визначити за наближеною формою рівняння ізобари:
- •Розв’язання
- •Завдання 2.
- •Приклад розв’язання завдання
- •3. Индивідуальне розрахунково-графічне завдання
- •3.1. Пояснення для вирішення завдання
- •3.1.1. Розрахунок константи рівноваги хімічної реакції
- •3.2. Розрахунки виходу продуктів реакції
- •3.3. Розрахунок залежності виходу аміаку від тиску та температури
- •3.4. Розрахунки рівноваги в реальних системах
- •3.2. Багатоваріантне графічно-розрахункове завдання
- •4. Перелік контрольних запитань
- •4.1. Перелік запитань для самоконтролю
- •4.2. Питання до екзаменаційних білетів
- •4.2.1. Теплоємність, перше начало термодинаміки, термохімія
- •4.2.2. Друге і третє начало термодинаміки
- •4.2.3. Хімічна рівновага
- •4.2.4. Фазові рівноваги
- •5. Нарахування рейтингових балів
- •5.1. Таблиця відповідності рейтингових балів за національною та європейською шкалами
- •5.2. Правила нарахування рейтингових балів
- •5.3. Таблиця відповідності оцінок та балів за європейською і національною шкалами
- •6. Список рекомендованої літератури Основна література
- •Перелік позначень
Приклад розв’язання завдання
Умова завдання. В таблиці 2.4 наведені дані по залежності тиску насиченої пари від температури, густини речовини в твердому і рідкому станах (dтв і dрід в кг/м3) в потрійній точці. Таблиця 2.4
-
Стан твердий
Стан рідкий
Умови
Т,К
р, Па
Т,К
р, Па
437,7
441,2
444,2
448,2
35324
39323
42659
47454
446,4
448,2
451,2
460
470
47000
47454
49563
55986
63317
М = 152
Р = 300.105 Па
dтв = 985
dрід = 977
Задача 1. Побудуйте графік залежності ln p від 1/Т.
Розв’язання. Для креслення графіка перерахуємо р на ln р, а Т на 1/Т. Дані занесемо в таблицю 2.5. Через точки, що характеризують твердий стан і через точки рідкого стану проводимо дві прямі лінії (рис. 1).
Таблиця 2.5
-
Стан
твердий
рідкий
1/Т.103
ln p
1/Т.103
ln p
2,285
2,267
2,251
2,231
10,4723
10,5796
10,6610
10,7675
2,240
2,231
2,216
2,174
2,128
10,7580
10,7675
10,8110
10,9329
11,0559
Задача 2. Визначить за графіком координати потрійної точки.
Розв’язання.. Точка перетину побудованих прямих є потрійна точка (т. о). Її координати: ln p = 10,7675 і 1/Т = 2,251.10-3, що відповідає тиску рПТ = 47454 Па і температурі ТПТ =448,2 К.
Задача 3. Обчисліть середню теплоту випаровування і сублімації.

Рис. 1.
Розв’язання. Лінія со є лінією випаровування. Її хід описується рівнянням Клапейрона-Клаузіуса у лінійному вигляді:
![]() .
.
Аналіз рівняння показує, що теплота випаровування входить в величину кутового коефіцієнта прямої. Він дорівнює тангенсу кута нахилу лінії (α1), який можна розрахувати за графічними даними:
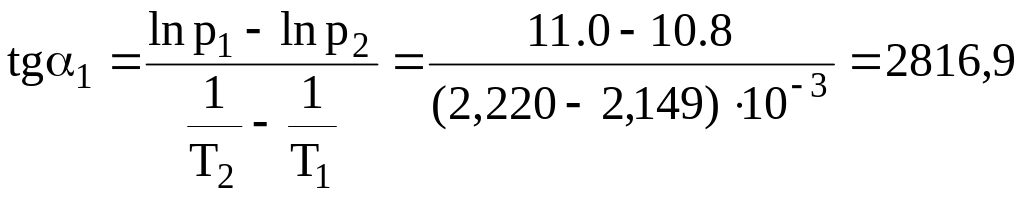 .
.
Середня теплота випаровування дорівнює:
ΔHВИП = R.tgα1 = 8,314. 2816,9 = 23429,7 Дж/моль.
Лінія оb на графіку є лінією сублімації. Вона також описується рівнянням Клапейрона-Клаузіуса. Тангенс кута нахилу (α2) прямої оb дорівнює:
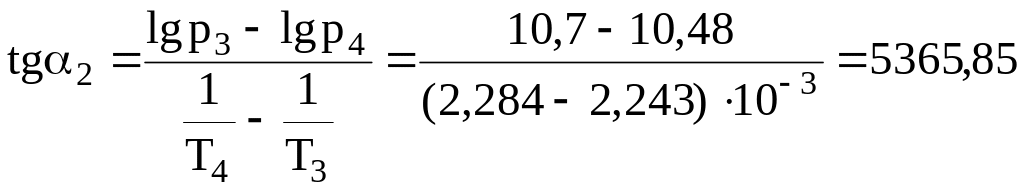 .
.
Розрахуємо середню теплоту сублімації.
ΔHСУБ = R.tgα2 = 8,314. 5365б85 = 44611,7 Дж/моль.
Задача 4. Визначить теплоту плавлення речовини при температурі потрійної точки.
Розв’язання. Теплоту плавлення речовини при температурі потрійної точки визначаємо за рівнянням:
ΔHПЛ = ΔHСУБ. – ΔHВИП = 44611,7 - 23419,7 – 21192,0 Дж/моль.
Задача 5. Обчисліть dT/dp для процесу плавлення при температурі потрійної точки.
Розв’язання. Згідно з рівнянням Клапейрона – Клаузіуса
![]() ,
,
де ΔV = VРІД – VТВ є різниця мольних об’ємів речовини в рідкому і твердому станах відповідно. Мольні об’єми розрахуємо за даними густини речовини (dРІД і dТВ) та її мольної маси (М = 152 г/моль)
![]() і
і
![]() .
.
Тоді
![]() ,
,
і![]()
![]() .
.
Задача 6. Обчисліть температуру плавлення речовини при тиску р.
Розв’язання. Температуру плавлення при тиску 300.105 Па знайдемо в результаті інтегрування рівняння
![]() ,
,
допускаючи, що залежність T = f(p) має лінійний характер.
 .
.
Т = ТПТ + 2,67.10-8(р – рПТ) = 448,2 + 2,67.10-8(300.105 – 47454) = 449,0 К.
Задача 7. Обчисліть зміну ентропії, ентальпії, внутрішньої енергії, енергії Гіббса, енергії Гельмгольца в процесі сублімації для n = 1 кмоль речовини в потрійної точці.
Розв’язання. Для процесу сублімації в потрійній точці зміна ентропії 1 кмоль речовини дорівнює:
![]() .
.
Зміна ентальпії буде дорівнювати:
ΔН = nΔНСУБ = 1000.44611,7 = 44611700 Дж.
Зміна внутрішньої енергії:
ΔU = ΔH – nRTПТ = 44611700-1000.8,314.448,2 = 40885365 Дж.
Зміна енергії Гіббса:
ΔG = ΔH – TПТ.ΔS = 44611700 – 448,2.99535,25 = 0.
Зміна енергії Гельмгольца:
ΔA = ΔG – nRTПТ = 0 – 1000.8,314.448,2 = -3726335,0 Дж.
Задача 8. Визначить число фаз і число термодинамічних ступенів свободи для фігуративних точок на “полі” діаграми, “лінії” і “точці”.
Розв’язання. Число фаз (Ф) для фігуративних точок на “полі” діаграми дорівнює 1, на “лінії” – 2, в потрійній точці – 3.
За правилом фаз Гіббса
С = К – Ф + n
для однокомпонентної системи (К = 1) і для n = 2 (змінні, що впливають на рівновагу – тиск і температура) число термодинамічних ступенів свободи в “полі” дорівнює
СП = 1 – 1 + 2 = 2,
на “лінії’
СЛ = 1 – 2 + 2 = 1,
в потрійній точці
СПТ = 1 – 3 + 2 = 0.
