- •Глава I
- •Кондуктометрическое титрование
- •Глава II
- •Определение редокс-потенциала
- •Глава III поверхностное натяжение и адсорбция
- •Изучение адсорбции пав на границе водный раствор - воздух
- •Глава IV коллоидные системы
- •Получение коллоидных растворов
- •Методы получения коллоидных систем
- •Оптические свойства дисперсных систем.
- •Строение мицеллы
- •Коллоидная защита
- •Свойства коллоидных систем
- •4. Пептизация коллоидных систем
- •Определение изоэлектрической точки белка методом набухания
- •Определение молекулярной массы полимера методом вискозиметрии
Определение редокс-потенциала
Краткая теория:
Система, содержащая в одной фазе окисленную и восстановленную форму одного и того же вещества или нескольких веществ, называется окислительно-восстановительной или редокс системой.
В момент динамического равновесия на поверхности электрода из инертного металла, помещенного в редокс-систему, возникнет равновесный потенциал, который называют окислительно-восстановительным (ОВ) или редокс – потенциалом Еr, который для реакции Ox+ne→Red рассчитывается по уравнению Нернста:
![]() (2.9)
(2.9)
где Er стандартный редокс-потенциал; n число электронов, передаваемых с донора (Red) на акцептор (Ох) в элементарном акте; CОх и CRed концентрации окисленной (Ox) и восстановленной (Red) форм, соответственно.
Инертный металл принимает лишь косвенное участие в потенциалопределяющей реакции, являясь посредником в передаче электронов от восстановленной формы вещества к окисленной и наоборот.
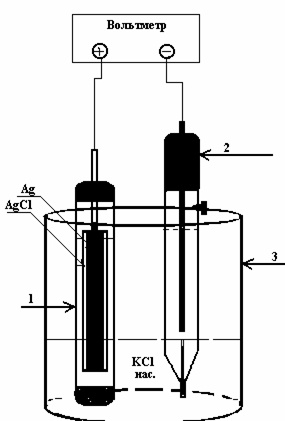
Окислительно-восстановительные реакции играют важную роль в биологических процессах. Например, почва представляет собой сложную естественную окислительно-восстановительную систему. Редокс-процессы в почве чаще всего являются необратимыми. Важнейшим окислительным агентом в почвах является кислород. Любые причины ухудшающие аэрацию (напр., заболачивание) приводят к уменьшению редокс-потенциала с 300-650 до 100-200 мВ, что в свою очередь, влияет на подвижность таких элементов питания растений как железо, марганец, азот и пр. При разложении органических соединений в условиях высоких значений Еr сера переходит преимущественно в сульфаты, а при низких значениях (анаэробные условия) – в сульфиды. Для измерения Еr почвы используются платиновые электроды, а в качестве электродов сравнения используется хлорсеребряный электрод (Рис.6)
|
Рис.6. Гальваническая цепь для измерения redox-потенциала |
|
Цель работы: Измерить редокс-потенциал нескольких смесей различного состава, приготовленных из растворов солей K3[Fe(CN)6] (красная кровяная соль) и K4[Fe(CN)6] (жёлтая кровяная соль). Построить график зависимости редокс-потенциала этой системы от логарифма соотношений концентраций окисленной и восстановленной форм железа.
Оборудование: Штатив с бюретками, потенциометр (иономер), электроды: платиновый (измерительный) и хлорсеребряный (сравнения), химические стаканы.
Реактивы: Растворы красной K3[Fe(CN)6] и желтой K4[Fe(CN)6] кровяных солей одинаковой концентрации 0,01 мольл1, раствор KCl (2 мольл1), дистиллированная вода, бумажные фильтры.
Порядок работы:
Составить смеси растворов красной и желтой кровяных солей в соответствии с таблицей 4.
Измерить потенциометром ЭДС элемента:
() Ag AgCl, КClнасыщ K3[Fe(CN)6], K4[Fe(CN)6] Pt (+)
для каждого соотношения концентраций окисленной и восстановленной форм железа.
Рассчитать величину редокс-потенциала Еr по формуле:
Еr = E + ECl¯, Ag/Ag,
где Еr редокс-потенциал, В,
Е измеренное потенциометром значение ЭДС, В,
ECl¯, Ag/Ag потенциал насыщенного хлорсеребряного электрода, величина которого для данной температуры (в °С) рассчитывается по формуле:
ECl¯, Ag/Ag = 0.2224 – 0.00065 (t – 25).
Таблица 4.
Объем, мл |
lg (Cох /Cred) |
E, B |
Er, B |
||
K3[Fe(CN)6] |
K4[Fe(CN)6] |
КС1 |
|||
20 |
2 |
10 |
|
|
|
16 |
6 |
10 |
|
|
|
11 |
11 |
10 |
|
|
|
6 |
16 |
10 |
|
|
|
2 |
20 |
10 |
|
|
|
Построить график зависимости Еr от lg (Cox/Cгеd).
Рассчитать из графика:
а) тангенс угла наклона построенной прямой, б) величину Еоr.
Сравнить полученные значения с теоретическими:
а) с тангенсом угла наклона, рассчитанным по уравнению: RТ/nF = 0,059/n,
б) со стандартным редокс-потенциалом Еоr=0,36 В.
Объяснить расхождения между практическими и теоретическими значениями этих величин.
Вопросы к работе 2б
Привести примеры окислительно-восстановительных систем; написать уравнения электрохимических реакций.
Что представляет собой окислительно-восстановительный электрод?
Какие электроды используют в качестве электродов сравнения?
Хлорсеребряный электрод: схема, строение, уравнение реакции, особенности.
Зависит ли потенциал редокс-электрода от температуры?
С какой целью во все исследуемые редокс-системы вводится раствор хлорида калия?
Каким металлом можно заменить платину в редокс-электроде?
Привести примеры редокс-систем. Какова функция платинового электрода в этих системах?
Задачи к работе 2
Потенциал редокс-электрода в системе Cr2O72-/Cr3+ равен 1,96 В, Ео (Cr2O72-/Cr3+) = 1,33 В. Определить отношение концентраций окисленной и восстановленной форм ионов хрома в этой системе.
Рассчитайте величину потенциала окислительно-восстановительного электрода Pt/Fe3+,Fe2+, если концентрации FeCl3 и FeCl2 соответственно равны 0,05 М и 0,85 М.
В какой из приведённых ниже систем возникает окислительно-восстановительный потенциал: а) Cu/Cu+2; б) Ag,AgCl/HCl; в) Pt/Cu+2,Cu+; г) Pt,H2/HCl. Рассчитайте Red-Ox потенциал этой системы при 25°С, если отношение концентраций окисленной и восстановленных форм равно 3?
Какие электроды можно использовать для измерения рН? Какой из приведённых ниже процессов протекает на поверхности стеклянного электрода?
Н+ + ē = 1/2Н2, Н+ + ОН- = Н2О
Н+р-р ↔ Н+пов-сть, Н+р-р + ē = Нпов-сть
Дан электрод Pt/Sn4+,Sn2+. Концентрации равны С(SnCl4)=0,01 М, C(SnCl2)=0,001 М. Определите тип электрода и его потенциал.