
- •1. Химический состав подземных вод
- •2. Формирование химического состава подземных вод
- •2.1. Воды инфильтрационно-атмосферного происхождения
- •2.2. Воды седиментационного происхождения
- •3. Физико-химические показатели качества ьоды и их определение
- •3.1. Физические свойства природных вод
- •4. Обработка данных химического анализа
- •5. Систематизация данных химического состава подземных вод
- •5.1. Химическая классификация природных вод
- •6. Оценка качкства воды
- •6.1. Оценка качества воды для хозяйственно-питьевых целей
- •7. Пример обработки анализа и оценки качества воды
- •7.8. Оценка качества воды по агрессивности в отношении бетона
6. Оценка качкства воды
Подземные воды прежде всего должны оцениваться как источник хозяйственпо-питьевего водоснабжения.
6.1. Оценка качества воды для хозяйственно-питьевых целей
Хорошая питьевая вода не должна содержать вредных соединений, болезнетворных бактерий (ГОСТ 2874-82). Она должна иметь малую жесткость и минерализацию, быть прозрачной, бесцветной и без запаха. Вредными примесями считаются соединения свинца, меди, мышьяка, цинка, ртути, сероводород, некоторые органические вещества и т. д.
Важным показателем пригодности воды для питьевых целей является общее солесодержание {сухой остаток). В хорошей питьевой воде сухой остаток не должен превышать 1 г/ч однако в районах с гумидным климатом водой хорошего ка-
50
чества следует считать ту, в которой сухой остаток составляет от 1 до 0,2—0,3 г/л, менее минерализованная вода считается неблагоприятной (нижний предел 50 мг/л).
В условиях аридного климата, где преобладают солоноватые и соленые воды, по согласованию с органами здравоохранения, для хозяйственно-питьевого снабжения допускается вода с сухим остатком до 1,5 г/л. Любая используемая для хозяйственно-питьевых целей вода должна содержать не более 500 мг/л сульфат-иона и не более 350 мг хлор-иона, общая жесткость не должна превышать 7 мг-экв/л и лишь в особых случаях, по согласованию с санэпидстанцией, может быть допущена до 14 мг-экв/л.
6.2. Оценка качества воды для орошения
Оросительная вода оказывает разнообразное влияние на объекты гидротехнической мелиорации — растения, почвогруи-ты, грунтовые воды и при определенных условиях наносит им вред: ожоги листьев (при дождевании водой с повышенным содержанием хлора, натрия, бикарбоната кальция, нитратов), угнетает растения (при избытке соды, хлора, натрия), вызывает болезни (при недостатке бора, меди), накапливает токсичные микрокомпоненты, опасные для здоровья (мышьяк, бериллий, молибден, селен, свинец и др.).
Любая оросительная вода при любом способе орошения изменяет свойства почвы, активизируя процессы миграции ч ней химических компонентов и изменяя концентрацию и ионный состав поровых растворов. Изменение свойств почв зависит не только от качества оросительной воды и состояния почв, но и от климатических (осадки, испарение), гидрогеологических (глубина залеган-ия и минерализация грунтовых вод, дренированность) и искусственно создаваемых (количество подаваемой воды, способ полива, характер возделываемых культур) условий. При разном их сочетании одна и та же вода может оказывать разное действие. В районах с аридным климатом мощным фактором является .испарение, ведущее к концентрации солей в почве и интенсификации ионного обмена, что может привести к засолению или осолонцеванию почв, резко снижающим их продуктивность.
Таким образом, оценку оросительной воды необходимо вести или с точки зрения способности ее накапливать соли в почве (засоление), или изменять катионный состав (осолонце-
4* 51
вание). В первом случае опасна высокомиперализованная вода, во втором — ее специфический ионный состав. Поэтому обязательным является постоянный контроль за изменениями, происходящими в почвенном покрове, и своевременная реакция на них: либо создание промывного режима при поливе, либо проведение специальных промывок с применением соответствующих химических мелиорантов. Сказанное ранее еще раз заставляет подчеркнуть, что оценка качества оросительной воды должна быть не одноразовой, а постоянной (по крайней мере, два-три раза в год) вместе с ионно-солевым опробованием почв.
Таким образом, оценка качества подземных вод для орошения должна быть многосторонней — по содержанию как главных, так и второстепенных компонентов (в том числе микрокомпонентов). Способность оросительной воды засолять почву оценивается, как правило, по общей минерализации. Ученые предлагают при этом разные критерии. Академик А. Н. Костяков (1960) считал воду вполне пригодной для орошения при общей минерализации 1,0—1,5 г/л. При концентрации солей 1,5—3,0 г/л он рекомендовал установить содержание токсичных солей, особенно Ыа2СОз, NaCl, NauSO4. Предельным содержанием их он считал соответственно 1,2 п 5 г/л, а предельной общей минерализацией — 5 г/л.
Хорошо известна методика Стэблера — опенка воды с помощью ирригационного (щелочного) коэффициента, полученного им на основе наблюдений за максимальной безвредной концентрацией щелочей и над относительной вредностью солей натрия для 40 культур. Под ирригационным коэффициентом Стэблер понимал высоту столба воды в дюймах, (практически это оросительная норма), которая при испарении дает количество солей, достаточное для превращения почвы на глубину 1,2 м в непригодную для произрастания большинства культурных растений. Ирригационный коэффициент вычисляют по формулам в зависимости от относительного содержания rNa + , rCl- и rSOj-, которые приведены в табл. 6.2.1.
Оценка пригодности воды по вычисленному коэффициенту проводится по критериям, обозначенным в табл. 62.2.
Рекомендации А. Н. Костякона и Стэблера хороню согласуются. Так, ирригационный коэффициент больше 18 соответствует минерализации менее 1,2 г/л, 18—6 — минерализации 1,2—3,0 г/л. а 1,2 — минерализации больше 5 г/л. В последние годы широко проводятся опыты и производственные испы-
52
тания полива солоноватыми и солеными водами дренажного стока с орошаемых полей. И. П. Айдаров (1980) считает безвредным орошение суглинистых почв в пустынных районах
Таблица 6.2.1 Данные для расчета ирригационного коэффициента
Соотношение ионов о воде rNa^-<rCl-В воде содержится хлорид натр-ия rCl~+rSO2->rNa+>/-Cl" 4 Присутствуют хлорид i: сульфат ргатрия rNa+>rCI-+rS©4~ Присутствуют хлорид дульфат и карбонат натрия |
Ирригационный коэффициент 288 sTc!^ 288 rNa+4rCl~ 288 10rNa+— 5/-C1-— 9rSO- 2 4 |
|
||
Ирригационный коэффициент >18 18—6 5,9-1,2 <1,2 |
Качество воды Хорошее Удовлетворительное Неудовлетворительное Плохое |
Характеристика вод Воду много лет можно успешно применять без специальных мероприятий, предупреждающих накопление щелочей Необходимы специальные мероприятия предупреждения постепенного накапливания щелочек. Исключением являются почвы рыхлые со свободным дренажем Искусственный дренаж почти всегда необходим Воды практически непригодны для ирригации |
||
водой с минерализацией 1,5—2,0 г/л при промывном режиме (обязательный сток воды из почвенного профиля в грунтовые воды). Ф. М. Рахимбаев и Г. А. Ибрагимов (1978) показали возможность повторного использования дренажных вод с минерализацией 3-4 г/л для орошения, а древесных насажде-
Таблица 6,2.2
Критерии оценки оросительной воды по ирригационному коэффициенту
ний — при минерализации до 9 г/л при хорошей дренирован-ности почв.
ЕЯ
jj. В. Скрепчинскаи и др. (-1977) считают, что для большинства растений пригодна вода с минерализацией 2—5 г/л, а для солеустойчивых культур на легких почвах—до 1-U— 12 г/л. Устойчиво токсичной считается вода при концентрации солей 15—20 г/л. В. А. Ковда (1973), обобщив отечественный и зарубежный опыт, рекомендует следующие нормы использования минерализованных вод па фоне промывного режима ц профилактических промывок (табл. 0.2.3).
Т а б л ii ц а 6.2.3
Условия применения минерализованных вод для орошения (По В. А. Ковда)
Концентрация солей (без соды) в поливной воде, г/л |
Частота промывок |
Отвод дренажных вод от водозабора, % |
0,2—0,4 0,5—1,0 1,0—2,0 2,0—3,0 3,0—5,0 |
Не нужны 1 раз в 1 — 2 года 1 — 2 раза в год Несколько раз в год Каждый полив промыннои |
.0 10—15 • 20—25 30—35 50—60 |
Способность йоды осолонповывать почвы зависит главным образом от содержания в пей натрия. Дело в том, что кальций обладает хорошими каогулнрующими свойствами (при преобладающем положении в поглощенном комплексе почв), способствует улучшению структуры почвы и делает ее водопрочной. Натрий, наоборот, разрушает структуру и ухудшает водно-физические свойства. Поэтому если ионы натрия значительно преобладают в оросительной воде над двухвалентными Са2+ и Mg24, то возможно взаимодействие N'a* с поглощенным комплексом почвы, что приводит к увеличению слитности, плотности, коркообразованию и бесструктурности почв, т. е. к потере почвой ее главных свойств, способствующих высокой продуктивности.
Способность оросительной воды к осолонцеванию почв может быть оценена по критерию осолонцевания, предложенному И. Н. Лнтиповым-Каратаевым и Г. М. Кадером (1961)..
гСа2++гМе2+
~ rNa+ -<0.238C..
где С — сухой остаток, г/л.
Если это соотношение выполняется, осолонцевацие будет происходить.
54
Лаборатория засоленных почв США предлагает эту способность оросительной воды оценивать по коэффициенту потенциального поглощения натрия (натриевое адсорбционное отношение) SAR:
ЧЛ1>= _______^__/
VO,5{rCa2++rMg20'
Считается, что при $-4Я<1() опасность осолонцевання ночи малая, при 10—18'—средняя, при 18—26 — высокая и при 26 — очень высокая.
Почти все остальные методы основаны па отношении одновалентных катионов (натрия) к двухвалентным (кальцию и магнию), при этом критерии оценок иесколько-разнятся. что, видимо, объясняется природными условиями, где эти методы испытывались. Например, А. М. Можейко и Г. К. Воротник (1958) для Украины получили предельное значение этого
гМ^+гСа2-" коэффициента равным 0,5, т. е. если —--------—-—- >U,o,.
rNa+
осолонцёваниё происходить не будет. М. Ф. Буданов (1965) считает, что вода не приведет к осолонцеванию, если
лЫа+
—------------------ <0,7 и т. д.
rCa2+-f-rMn-2i-
Интересны предложения венгерских ученых (1973) оценивать воду по магниевой опасности. Дело в том, что магнии, занимая промежуточное положение между кальцием и na'i-рнем, подавлен ими. Однако, когда содержание натрия в воде незначительно, а магний преобладает над кальцием, он способен вытеснять из поглощенного основания почвы структурообразующий кальций, занять преобладающее положение-и -ухудшить свойства почвы аналогично натрию. Магниевая
rMg2+ ., -
опасность оценивается соотношением Кмы—~ — <">э
rCa2- + rMg2 +
(магниевый коэффициент).
Иной подход к оценке пригодности воды для орошения с учетом ее токсичности и способности к осолопцсваппю пред- . лагают Ю. Г. Богомолов и др. (1980). В основу опенки они кладут содержание нормальной и двууглекислой соды, определяемое как:
а) (гНСОа-+гСО2- } — (rCa2++rMg2'-).
Если полученное значение окажется <1,25 мг-экв/л, вода считается" пригодной для орошения; при содержании общей
55
соды в пределах 1,25—2,5 мг-экв/л — ограниченно пригодной, есл-и >2,5 мг-экв/л, то применять воду для орошения нельзя.
б) rCO^-—(rCa2--+rMg2+).
Этот показатель содержания нормальной соды имеет более строгие ограничения. Так, при значении <0,3 мг-экв/л вода пригодна для орошения; 0,3—0,6 мг-экв/л — условно пригодна; >0,6 мг-экв/л-—не пригодна.
Следует отметить, что при отсутствии в воде ионов СО3~ содержание двууглекислой соды следует рассчитывать по кальцию, не участвующему в образовании гипса (см. состав гипотетических солей, гл. 4.2). Эти же авторы считают предел токсичности хлора (С1~) в оросительной воде равным 1,5 г/л, имея в виду ион хлора, соответствующий натриевой соли.
Степень влияния оросительной воды на почву зависит, главным образом, от соотношения содержащихся в ней и в воде натрия ,магния и кальция. Пр.и преобладании кальция п поглощенном комплексе почвы она долго «сопротивляется» осолонцеванию (буферные свойства почвы). Попытка учесть эти свойства почв сделана лабораторией засоленных почв США, предложившей способность оросительной воды к осолонцеванию оценивать с помощью «выверенного^ адсорбционного соотношения натрия, учитывающего резервы кальция в почве, SAR*. Оно определяется как
5/iА1*-------"Na-^ ___^r1 + (84 H )]
V(0,5(rCa2+ + rMg2+)
здесь рНс—величина, представляющая собой активную концентрацию ионов, участвующих в обмене, и учитывающая резервы кальция в почве. Она подсчитывается по формуле:
pH^pK2+pKo)+p(Ca2---+Mg2')+pAIK.
Абсолютные значения величин, входящих в формулу, берут из табл. 6.2.4, где (рК2+рКо) определяется по суммарному содержанию катионов rNa+-f Mg24 -fCa2*, p (Ca2+-f Mg2+) — в зависимости от суммарного содержания двухвалентных катионов, rMg2++rCa2-r и рА1к — в зависимости от суммы (rCo32~-f-rHCO3-). При уточненном адсорбционном отношении натрия (SAR*)<.6 осолонцевания почв не ожидается,
56
при- 5Л#*=*6—9 возможно накопление солей в почве, а при 5ЛЯ*>9 — возможность осолонцевания вероятна.
Т а б л И ц а 6.2.4 Данные для расчета рНе при определении SAX*
Н-а основе отечественного и зарубежного опыта орошения разных культур минерализованными водами и методов оценки
57
rNa+-+rMg2i+ + 4-гСаЧ-, МГ-ЭКВ/Л |
рК* 4- рК0 |
/-Са!+ + -frMg**, мг-экв/л |
р(Сая+ + + Mg2+) |
(rCO^- + rHC03-, МГ-ЭКВ/Л |
рА1 к |
0,5— 0,7 0,9 1,2 1,6 ],9 2,4 2,8 3,3 3,9 4,5 5,1 5,8 6,60 7,4 8,3 9,2 11,0 13,0 15,00 18,0 22,0 25;0 29,0 34,0 39,0 45,0 51,0 59,0 67,0 76,0 |
2J1 2,12 2,13 2,14 2,15 2,16 2,17 2,18 2,19 2,20 2,21 2,22 2,23 2,24 2,25 2,26 2,27 2,28 2,30 2,32 2,34 2,36 2,38-2,40 2,42 2,44 2,46-2,48 2,50 2,52 2,54. |
0,5 0,10 0,15 0,20 0,25 0,32 0,39 0,50 0,63 0,79 1.00 1,25 1,58 1,93 2,49 3,14 3,90 4,97 б.ЗО 7.90 10,0 12,5 35-,8 19,8 |
4,60 4i30 4,12 4,00 3,90 3,80 3,70 3,60 3,50 3,40 3,30 3,20 3,10 3,00 2,90 2,80 2,70 2,60 2,50 2.40 2,30 2,20 2,10 2-.00 |
0,00 0,10 0,15 0,20 0,25 0,31 0,40 0,50 0,63 0,79 0,99 1,25 1,57 1.98 2,49 3,13 4,00 5,00 6,30 7,90 9,90 12,5 15,7 19,8 |
4,30 4,00 3,82 3,70 3,60 3,51 3,40 3,30 3,20 3,10 3,00 2,90 2,80 2,70 2,60 2,50 2,40 2,30 2,20 2,10 2,00 1,90 1,80 1,70 |
качества орошаемой воды ВНИИГиМ (С; Я. Сойфер, !982) рекомендует обобщенную классификацию оросительных • под
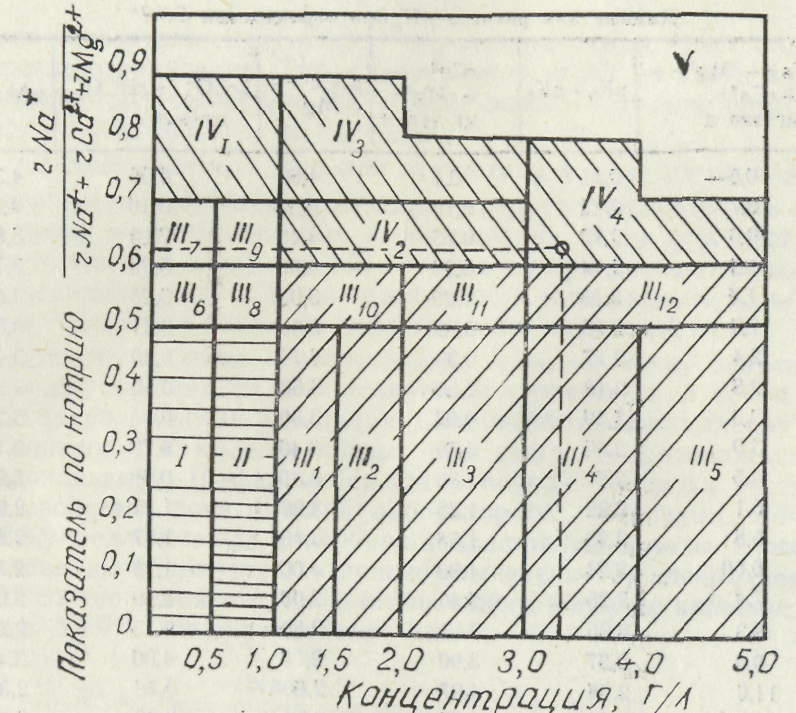
Рис. 6.2.1. Классификация оросительных вол яо-степенй опасности осолонцсвании почв
по степени осолонцевания почв (рис. 6.2.1). Основой этой классификации является натриевый показатель Кка —
rNa +
=------------------------— и общая минерализация (г/л). Б клас-
rNa++rMg2++rCa2*
сификации выделено пять классов воды (римские цифры) и группы (арабские цифры) по относительному содержании» натрия (табл. 6.2.5).
Качество оросительной воды не ограничивается рассмотренными показателями. В ней могут содержаться токсичные для растений микрокомпоненты, например, бор (В), необходимый для их роста и развития. При определенных концен*
58
трациях он может быть ядовитым. Токсичность химических компонентой зависит и значительной степени от солеустоичп-
:'.-.. Таблица 6.2.5
Характеристика классов и групп оросительных код (По С Я. СойсЬеп)
Классы |
Пригодность под |
• Группа |
. Мероприятия по улучшению |
I 11 III IV V |
Вполне пригодны Пригодны для большинства культур и почв Ограниченно пригодны Условно пригодны Непригодны |
IHiiAW Шб.7 "18,9,10,11,12 IV, IV 2. 3.4 |
Контроль почв пи подпои вытяжке • — » — Разбавление, опреснение Химическая мелиорация Разбавление, опреснение, .химическая мелиорации Химическая мелиорация Разбавление, опреснение, .химическая мелиорация |
воети растений, глубины залегания грунтовых.вод и природных условий. В прцл. 1 (табл. 1, 2, 3, 4) приведены нормы пригодности оросительной воды по всем показателям (ВНИИГиМ, 1983).
Для облегчения выбора источника орошения и с точки зрения охраны -водных ресурсов (в том числе экономного расходования воды) большое значение имеет улучшение качества оросительной воды, производимое путем простого разбавления соленой воды пресной, добавления мелиорантов (например, для увеличения доли кальция добавляют по 75—350 г гипса па 1 м-3 воды, для уменьшения доли карбонатов и бикарбонатов (СО32~ и НС03") —серную кислоту и другие окислители,-например, азотную кислоту по 0,2 мл/л). Добавление кальциевой селитры Ca(NO3)2-4H2O снижает рП воды if отношение rNa+- /rMg2++rCa2+ . Мелиоранты традиционно вносятся в почву. Однако больший эффект дает улучшение качества воды.
В заключение подчеркнем, что описаны не все методы оценки воды для .-орошения, .а -у приведенных нет четко очерченных критериев применения. Их нужно, считать приближен-то-
ными. В каждом конкретном случае необходим постоянный контроль и уточнение норм. Поэтому для оценки качества оросительной воды не исключается использование «устаревших норм» (например, по ирригационному мввффшшенту Стэблера).
6.3. Агрессивное действие воды на бетон
Агрессивность воды по отношению к бетону обусловлена действием некоторых химических ее компонентов. Это приводит к перерасходу значительных средств на защиту и ремонт бетонных и железобетонных .конструкций, особенно гидротехнических и водохозяйственных.
По химическому воздействию агрессивность воды подразделяют на пять видов — углекислую, выщелачивающую, об-щекислотную, магнезиальную и сульфатную, которые и обусловливают три вида коррозии бетона:
I — выщелачивание растворимых компонентов бетона (\г-лекислотная и выщелачивающая);
II — образование растворимых соединений, не обладающих вяжущими свойствами, в результате обменные реакций между компонентами цементного камня и воды (выщелачивающая, общекислотная, магнезиальная);
III — образование и накопление в бетоне малорастворимых солей, сопровождающиеся их увеличением в объеме (сульфатная). Любая агрессия может проявляться слабо и очень сильно — это зависит от времени контакта воды с бетонной .конструкцией, от плотности бетона, толщины бетонной конструкции и от типа цемента, что необходимо учитывать при оценке агрессивности воды.
Угле кислотная агрессивность воды проявляется в разрушении бетона за счет растворения кальцита СаС03, входящего в состав цементного камня, под действием агрессивной углекислоты, содержащейся в воде (см. гл. 2). Обычно ее определяют специальным анализом. Когда такой анализ не произведен, делают это расчетом. Содержание (концентрация) агрессивной углекислоты в воде (мг/л) может быть определено по следующей формуле:
[со2].„= ^+^*+Щ&&+ЙйЦ _.гШд-
£f\
где е — эквивалентная масса свободной углекислоты, р.аввая 22 мг/мг-экз;
А — коэффициент, учитывающий долю равновесной углекислоты в общей концентрации С02 и определяемый по формуле:
л= КЕ-Са^ ____
КгПРсаСО, -ГО^{Г+5,9б
где Кь Kg — константы первой и второй ступеней диссоциации угольной кислоты (табл. 6.3.1);
ПРсаСо,— произведение растворимости СаСОз (табл. 6.3.2); ц — ионная сила раствора (воды), определяемая как
ц-- ^,+2Мг3 ш_3|
где 2>i, £г2, 2>3 — суммы мг-экв одновалентных (i>i), дзух-(2>2) и трехвалентных (2г3) ионов, обнаруженных в 1 л исследуемой воды; Са24 - концентрация кальция в воде, мг/л; (С02)о — общее содержание свободной углекислоты в воде, которая также определяется по формуле:
/гг, л 44гЩп
(СО2)о=«
------- _
, мг/л,
KrlQPH-nw
гЩ0 — общая щелочность воды, определяется как /-Що = /-НС03- +2гСО-2мг-экв/л.
Определив содержание в иоде агрессивной углекислоты, сравнивают его с нормативным (прил. 2, табл. 5).
Выщелачивающая агрессивность воды проявляется при столь малом содержании угольной кислоты, при котором еще не достигнуто карбонатное равновесие, соответствующее произведению растворимости СаСО3, поэтому часть его перево дится в раствор даже при отсутствии агрессивной кислоты Выщелачивающая агрессия оценивается по нормам, приведенным в прил. 2 (табл. 3).
Общекислотная агрессия определяется по рН воды. При низком рН усиливается растворение СаСО3 и, следовательно, цемент теряет вяжущие свойства. Считается, что при рН<5 вода весьма опасна для бетона. Общекислотная агрессин оценивается, по нормам, приведенным в прил. 2 (табл. 3).
Магнезиальная агрессия заключается в том, что при значительном содержании магния в воде, в частности MyCla, on
Т а б ,'1 и ц .1 6.3.1
Значение констант первой и второй ступени диссоциации угольной кислоты и их отрицательные логарифмы
Температура воды, °С |
к,-ю-? |
рК, |
Ks-10-ч |
рК* |
0 5 10 15 20 25 30 40 50 60 70 80 |
2,65 3,04 3,43 3,80 4,115 4,45 4,71 5,06 5,16 '5,02 4,69 4,21 |
6,579 6,517 6,464 6,419 6,381 6,352 6,327 6,298 6,287 6,299 6,329 6,376 |
2,36 2,77 3,24 3,71 4,20 4,69 5,13 6,03 . 6,73 7,20 7,52 7,55 |
10,625 1 0,557 10,490 10,430 10,377 10,329 10,29 10,22 10,172 10,143 10,124 10,122 |
Т а б л п ц а 6.3.2
Значения произведения растворимости карбоната кальция
—и. ----- — _^~~__ |
|
|
|
1ри; те. |
me par |
/ре, °С |
|
|
|
Показатель |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
ПРСасо/ю-эй,022 8,152 8,282 8,406 8,518 8,625 8,738 8,370 8,092 Рпрсасо, 9'51 7>05 5'22 3'93 З'06 2>37 1.83 1,35 -1,002
вступает в обменную реакцию с кристаллическим гидратом окиси кальция бетона. В результате образуется гидрат окиси магния и хорошо растворимый хлорид кальция:
Ca(OH)2+MgCl2->CaCl2+Mg(OH)2.
Магнезиальная агрессия оценивается по содержанию ионов магния в воде {прил. 2, табл. 3).
Особое место занимает сульфатная агрессия, заключающаяся в том, что сульфат-ионы реагируют с гидратом окиси кальция, не связанного с силикатам.и цемента. В результате образуются сульфаты кальция, которые, кристаллизуясь, за-
Г- С\
нимают в 2,5 раза больший объем,'чем Са(ОН)2, бетон растрескивается и крошится. Реакция может проходить по схеме:
Ca(OH)2+Na2S04+2H2O^CaSO.I.2H20 + 2i\aOH.
nine
Сульфатная агрессия проявляется также и в образовании двойной сернокислой соли алюминия и кальция (соль Деволя, или цементная бацилла). Этот процесс особенно интенсивен в гипсовых водах. Реакция идет по схеме:
4CaO-Al2Os-12H20+3CaSO4;2H20+O-> ->3CaO-Al2(V3CaSO4+Ca(OH)2+17rl\0.
Сульфатная агрессия наиболее сильно проявляется при периодическом смачивании ,и высыхании бетона из-за изменения уровня воды у сооружения. В таких условиях в трещинах бетона может происходить кристаллизация солей, разрастание их очагов и образование более крупных трещин. Содержание с\льфатов в воде не должно превышать норм, приведенных в табл. 4 прил. 2.
Кроме разрушения цементного камня бетонного сооружения, некоторые компоненты, содержащиеся в воде, вызывают коррозию арматуры, что ведет к сильному ослаблению железобетонных сооружений, особенно с предварительно напряженной арматурой. В этом отношении опасно высокое содержание хлоридов, агрессивность которых усиливается в присутствии сульфатов (SO;j~).
Степень агрессивного воздействия хлоридов, содержащихся в воде, на арматуру оценивается по нормам, приведенным в табл. 3 прил. 2.
При совместном содержании в воде ионов хлора (С1~) и сульфатов ($0|~~) количество сульфатов пересчитывается на
хлориды и суммируется с содержанием хлоридов.
Таким образом, величина «хлоридов» (С1~)' для сравнения с нормами, табл. 4 прил. 2, определится как
(Cl-)' = Cl-+0,25SOr-3.
Кроме рассмотренных видов агрессии коррозия бетонных п железобетонных конструкций может происходить в воде и водных растворах, содержащих сложные комплексы химических соединений. К таким агрессивным средам относятся подземные и поверхностные воды высокой концентрации, а также жидкие технологические растворы. В этих случаях при опенке агрессивности по отдельным приведенным показателям во-
63
да может оказаться не агрессивной, но по общему содержанию активных соединений (сульфаты, хлориды, нитраты, ам-монийные соли, едкие щелочи) она может оцениваться как сильноагрессивная среда. Поэтому во всех случаях оценки агрессивности воды—среды рассматривают все виды коррозийного воздействия (табл. 4 црил. 2) и выбирают защитные меры по наиболее неблагоприятному виду.
6.4. Оценка коррозийного действия воды на металл
Коррозия стенок паровых .котлов, стальных труб происходит в результате замещения железа водородом и образования железистых соединений, если в воде присутствуют свободный кислород, углекислота и сероводород. Она усиливается в присутствии соединений магния, марганца, сернистого желе за, органического вещества (масла, жиры).
Оценивать коррозирующую способность воды можно по ее рН, который во многом определяется присутствием разных форм углекислоты. В нейтральной воде углекислотная система должна быть в равновесии. Такая вода называется стабильной, то есть не способной переводить в раствор карбонаты и другие соединения кальция, а также выводить их в осадок.
В природных водах, однако, утлекислотная система часто отклоняется от равновесного состояния. Оценивают это отклонение (стабильность воды) в результате сравнения измеренного рН с рассчитанным, соответствующим равновесному состоянию карбонатов в данной воде. Эта концентрация водородных ионов называется «рН равновесного насыщения воды .карбонатом кальция» и обозначается рНс. Величина рНс определяется по следующей схеме:
pHc=pK2-pnPCaco3-Ig(Ca2+)-lg(rlU0)+2,5lV~h7,6, где рК,2 — отрицательный логарифм второй ступени диссоциации угольной кислоты (табл. 6.3.1);
рПРсасо3— отрицательный логарифм произведения растворимости СаСОз (табл. 6.3.2);
Са2+ — содержание кальция в исследуемой воде, мг/л; гЩ0 — общая щелочность воды, мг-экв/л:
ц. --ионная сила раствора (см. 6.3).
Стабильность воды оценивается индексом насыщения / (индекс Ланжелье)
/ = рН-рНс. 64
Если / = 0 — вода стабильна. При /<0 — вода агрессивна и коррозионноопасна. При />0 — вода нестабильна и может образовывать корку из карбонатов кальция на стенках труб. Следует отметить, что этим способом можно определить Л'Ишь те свойства воды, которые зависят от наличия в пей агрессивной углекислоты. Однако с его помощью можно оценить способность воды к закупорке труб .карбонатом кальция, образованию корки на трубах, к уничтожению защитной пленки (корки) па стенках труб, отсутствие которой усиливает коррозию за счет других коррозионных агентов. По этой методике ведут технологические расчеты стабилизации воды.
